Содержание статьи
- 1 Введение
- 2 Эпидемиология мутаций гена PNPLA3 в популяции
- 3 Связь полиморфизмов гена PNPLA3 с показателями углеводного обмена
- 4 Связь полиморфизмов гена PNPLA3 с показателями липидного обмена
- 5 Связь полиморфизмов гена PNPLA3 с показателями обмена железа
- 6 Связь полиморфизмов гена PNPLA3 с прогнозом пациента
- 7 Обсуждение
- 8 Заключение
Введение
Гетерогенность фенотипов пациентов с неалкогольной жировой болезнью печени (НЖБП) обосновывает необходимость поиска факторов, оказывающих влияние на особенности течения данной патологии у разных пациентов [1]. Среди прочего рассматриваются и генетические предпосылки к развитию НЖБП. Так, чтобы идентифицировать генетические варианты, способствующие различиям в содержании жира в печени, S. Romeo et al. [2] провели полногеномное исследование ассоциаций вариантов нуклеотидных последовательностей в многоэтнической популяции (в конечный анализ были включены 9229 образцов). Было установлено, что мутация I148M, кодируемая аллелью G (в rs738409) в гене PNPLA3 (patatin-like phospholipase domain-containing protein 3 — белок 3, содержащий домен пататин-подобной фосфолипазы; прежнее название — адипонутрин), тесно связана с повышенным уровнем жира в клетках печени и воспалением органа. Аллель G наиболее часто выявлялась у латиноамериканцев — в популяции, более восприимчивой к НЖБП, при этом отмечалось двукратное увеличение содержания жира в печени у гомозигот PNPLA3-148M в сравнении с неносителями. По итогу работы был сделан вывод, что вариабельность PNPLA3 способствует этническим и межиндивидуальным различиям в содержании жира в печени и предрасположенности к НЖБП.
В статье рассмотрены данные по распространенности мутаций гена PNPLA3 в популяции, их взаимосвязь с лабораторными показателями и прогнозом, а также приведены результаты собственного исследования, включавшего пациентов с НЖБП.
Эпидемиология мутаций гена PNPLA3 в популяции
Мутация rs738409 C>G означает замену цитозина (С) на гуанин (G) в гене PNPLA3, что влечет за собой включение в трансляцию вместо изолейцина (I, кодируемого кодоном ATC) другой аминокислоты — метионина (M, кодируемого кодоном ATG) в 148 положении белка (I148M). «Дикий» тип гена PNPLA3 представляет собой гомозиготу С/С; замена на гуанин в одной (C/G) или обеих (G/G) хромосомах 22q13 приводит к образованию мутантного белка PNPLA3 (I/М и М/M соответственно), ассоциированного с увеличенным отложением жира в печени [2, 3]. В печени белок PNPLA3 (адипонутрин) находится в липидных каплях и может взаимодействовать с белком CGI-58 (comparative gene identification-58 — белок-58 сравнительной идентификации генов), регулируя активность триглицеридлипазы — фермента, катализирующего первую реакцию липолиза, при которой триацилглицеролы (триглицериды) гидролизуются до диацилглицеролов. У носителей rs738409 C>G мутантный PNPLA3 секвестрирует CGI-58, тем самым ограничивая его доступ к жировой триглицеридлипазе и ингибируя гидролиз депонированных липидов [4].
Процент носителей мутантного варианта гена PNPLA3 в популяции колеблется от 25 до 70% в разных этнических группах [4]. Так, поперечное исследование, включившее почти 5 тыс. взрослых участников III Национального обследования здоровья и питания США (Third National Health and Nutrition Examination Survey — NHANES III) за период 1991–1994 гг., выявило, что 50,7% выборки были гомозиготами по С-аллели гена PNPLA3, 36,7% — гетерозиготами (C/G) и 12,6% — гомозиготами по G-аллели. Согласно результатам статистического анализа G-аллель была сопряжена со статистически значимо более высокой распространенностью стеатоза печени и обусловливала сильную генетическую предрасположенность к повреждению печени, которое также зависело от уровня потребления алкоголя. При этом умеренное употребление алкоголя, если сравнивать с полным отсутствием его употребления, было связано со снижением риска стеатоза печени на 48%, но только среди тех, у кого не было аллели G (т. е. при С/С генотипе PNPLA3) [5, 6].
Другое исследование, целью которого являлась оценка связи полиморфизмов PNPLA3 с патологией печени, включало 140 ВИЧ-инфицированных пациентов разных рас и этнической принадлежности. Из них почти 40% оказались носителями аллели G, а 5% – гомозиготами по этой мутации (G/G). Данный вариант полиморфизма чаще встречался у латиноамериканцев и был связан с более тяжелым течением заболевания печени. Интересно, что у группы носителей аллели G был ниже индекс массы тела (ИМТ), что позволяет рассматривать полиморфизм гена PNPLA3 в качестве независимого компонента развития НЖБП [7]. Несмотря на более высокую встречаемость мутаций гена PNPLA3 среди латиноамериканцев [2], а также существующее мнение о более высоких (на 15% выше) показателях НЖБП среди лиц латиноамериканского происхождения [8, 9], недавний метаанализ показал, что распространенность НЖБП среди жителей стран Латинской Америки составляет около 24% [10], что не превышает таковую во всем мире [11].
В российском исследовании, включавшем 60 человек с НЖБП, мутантная аллель гена PNPLA3 I148M в гомозиготном состоянии (G/G) выявлена у 8 (13,3%) человек, 29 (48,3%) человек являлись носителями мутации (C/G) и у 23 (38,3%) пациентов мутации выявлено не было (С/С) [12].
При сравнении пациентов с НЖБП с ожирением и без него распространенность аллели G гена PNPLA3 была значительно выше среди лиц без ожирения (59,8% против 78,4% соответственно) и независимо ассоциировалась с НЖБП в многомерном анализе. Последующие японские исследования подтвердили более высокую встречаемость носителей аллели G или гомозигот G/G среди пациентов с НЖБП и нормальной массой тела, что позволяет рассматривать мутацию rs738409 C>G в гене PNPLA3 как независимый предиктор НЖБП у лиц без избыточной массы тела [13].
В исследовании, изучавшем генетический полиморфизм PNPLA3 и его связь с метаболическим синдромом, генотипы были распределены следующим образом. В контрольной группе (60 человек) без сахарного диабета (СД) и ожирения: С/С — 26 (43,4%), C/G — 20 (33,3%), G/G — 14 (23,3%). В группе лиц с СД 2 типа (СД2), но без ожирения (60 человек): С/С — 18 (30,0%), C/G — 14 (23,3%), G/G — 28 (46,7%). В группе и с СД2, и с ожирением (60 человек): С/С — 46 (76,67%), C/G — 2 (3,33%), G/G — 12 (20,0%). При сравнении исследуемых групп (СД2 с ожирением и без него) между собой и с контрольной группой отличия оказались достоверными (p<0,001) [14]. Исходя из представленных данных складывается впечатление о возможной протективной роли С/G и G/G в отношении развития СД2 у больных с ожирением.
Связь полиморфизмов гена PNPLA3 с показателями углеводного обмена
В одной из первых работ, посвященных изучению влияния мутаций PNPLA3 на показатели углеводного обмена, проводилась оценка уровней глюкозы и инсулина крови натощак и через 30 мин в рамках орального глюкозотолерантного теста (ОГТТ) с расчетом индекса инсулинорезистентности (HOMA-IR). По результатам обследования, носители G-аллели продемонстрировали большую резистентность к инсулину при меньшем ИМТ [15]. В дальнейшем некоторые авторы наблюдали связь между PNPLA3 I148М и инсулинорезистентностью у тучных пациентов [16]. Так, лица с тяжелым ожирением, носители PNPLA3 148M, были более резистентны к инсулину по HOMA-IR и более восприимчивы к СД2, чем лица с «диким» вариантом гена [17]. В уже упомянутом исследовании О. Aly et al. [14] генотипы C/G и G/G значительно чаще встречались среди пациентов с инсулинорезистентностью, а также в группе пациентов с СД2 без ожирения в сравнении с группой с СД2 и ожирением. В другой работе отмечают связь мутации PNPLA3 I148M с повышением HOMA-IR в когорте с гистологически подтвержденным неалкогольным стеатогепатитом (liver biopsy cohort — LBC; 1515 человек) и среди лиц с ожирением из Шведского исследования субъектов с ожирением (Swedish Obese Subjects Study — SOS; 3329 человек), но не в общей популяции (Dallas Heart Study — DHS; 4570 человек) [18]. По данным О.Р. Zaharia et al. [19], представленным на 56-й ежегодной встрече Европейской ассоциации по изучению диабета (EASD), полиморфизм PNPLA3 хоть и не влиял на чувствительность к инсулину всего организма, носители аллели G имели достоверно большую инсулинорезистентность жировой ткани по сравнению с неносителями. Общедоступная база данных полногеномных ассоциативных исследований (Genome-wide association studies — GWAS; 100 323 человека) позволила выявить достоверное, но небольшое (4%) увеличение риска СД2 у носителей мутантной аллели PNPLA3 [18].
Противоположные результаты были получены в работе K. Kantartzis et al. [20]. Так, носители G-аллели, наоборот, оказались более чувствительны к инсулину, чем C/C гомозиготы, при равной степени выраженности ожирения печени. Чувствительность к инсулину у G/G гомозигот с гепатостеатозом статистически не отличалась от таковой у контрольных субъектов без жировой дистрофии печени. При оценке чувствительности к инсулину в группе с низким ИМТ (с поправкой на возраст, пол, общий и висцеральный жир и степень стеатоза) не было выявлено связи показателей ОГТТ с генотипом PNPLA3, в то время как у лиц с ожирением чувствительность к инсулину значительно увеличивалась вместе с увеличением частоты G-аллели. Эти наблюдения позволили сделать предположение о протективном эффекте аллели G в отношении резистентности к инсулину.
Тем не менее исследование на животной модели показало отсутствие влияния I148M-варианта белка у мышей на чувствительность к инсулину с одновременным появлением нарушения толерантности к глюкозе (в сравнении с C/C мышами у C/G мышей наблюдалось развитие проявлений, характерных для СД 1 типа с поздним началом). Мыши — носители мутантной G-аллели продемонстрировали снижение выработки инсулина при повышенной секреции глюкагона, что было ассоциировано с усилением воспаления в поджелудочной железе. С учетом полученных экспериментальных данных, а также статистического анализа данных Британского биобанка и общедоступных исследований был сделан вывод, что генетически обусловленная НЖБП значительно увеличивает риск СД, но не инсулинорезистентности [21].
Данные систематического обзора и метаанализа 16 исследований также показали отсутствие значимой разницы среди генотипов PNPLA3 по индексу инсулинорезистентности HOMA-IR (оценены показатели у 1404 человек), уровням глюкозы (4160 человек) и инсулина (1721 человек), что подчеркивает самостоятельную роль мутации PNPLA3 в развитии стеатоза печени независимо от наличия компонентов метаболического синдрома [22, 23].
Таким образом, данных о том, что мутация в гене PNPLA3 способна приводить к развитию СД2 или, наоборот, обладает протективным в отношении нарушений углеводного обмена эффектом, недостаточно. Однако наличие СД у носителей мутантной G-аллели может способствовать существенному прогрессированию НЖБП. Недавние исследования взаимодействия между генетическими факторами и факторами окружающей среды при НЖБП показывают, что ожирение или другие метаболические нарушения могут значительно усиливать влияние генетических вариантов на патологию печени, приводя к трансформации из простого стеатоза в воспаление и цирроз печени. Фактически экспрессия PNPLA3 напрямую регулируется инсулинорегулируемым фактором транскрипции SREBP-1c (sterol regulatory element-binding protein 1c — белок 1c, связывающий регуляторный элемент стерола), а мутантные белковые вариации PNPLA3 накапливаются в условиях ожирения и резистентности к инсулину, усугубляя стеатоз печени, воспаление и цирроз (рис. 1) [4].
![Рис. 1. Метаболизм липидов в печени в условиях инсулинорезистентности и роль PNPLA3 (адапт. из [4]) Рис. 1. Метаболизм липидов в печени в условиях инсулинорезистентности и роль PNPLA3 (адапт. из [4])](https://medblog.su/wp-content/uploads/2023/12/Rasprostranennost-i-laboratornye-osobennosti-polimorfizmov-gena-PNPLA3-u-patsientov-s.png)
Связь полиморфизмов гена PNPLA3 с показателями липидного обмена
Одна из ранних работ, посвященная влиянию адипонутрина на показатели липидного спектра в крови человека и включавшая более 23 тыс. участников, установила, что наличие минорных мутаций в PNPLA3 приводит к снижению уровней общего холестерина (ХС), липопротеинов низкой плотности (ЛПНП) и холестеринов, не связанных с липопротеинами высокой плотности (не-ЛПВП). Корреляции с липопротеинами высокой плотности (ЛПВП) и ТГ отмечено не было, в связи с чем авторы пришли к выводу, что адипонутрин (PNPLA3) участвует в метаболизме апопротеин В (АпоВ)-содержащих липопротеинов [24]. Впоследствии их предположение подтвердилось: было показано, что как у людей, так и in vitro мутация PNPLA3 ассоциирована с более низкой секрецией АпоВ и больших, богатых ТГ липопротеинов очень низкой плотности (ЛПОНП), что приводит к накоплению ТГ в гепатоцитах [25].
Оценка генотипов 170 пациентов с НЖБП не выявила связи полиморфизма PNPLA3 с уровнями липидов крови натощак, однако отмечалась корреляция с размерами этих частиц. Так, мутация PNPLA3 I148M была связана с уменьшением размеров ЛПОНП и увеличением размеров ЛПНП и ЛПВП, что соответствует менее атерогенному липидному профилю [26].
В то же время в более позднем исследовании [27] каждая дополнительная аллель G rs738409 была связана со значительно более высоким уровнем ТГ и значительно более низким уровнем ЛПВП в плазме крови по сравнению с гомозиготами по аллели С или гетерозиготами C/G. И напротив, в работе M.C.G.J. Brouwers et al. [28] выявлена связь мутантного варианта PNPLA3 с более низкими уровнями ТГ и ЛПНП.
В исследовании, включавшем 298 пациентов, которым была выполнена биопсия печени во время бариатрической операции, и 345 добровольцев с менее выраженным ожирением, стеатоз печени у которых измерялся с помощью протонной магнитно-резонансной спектроскопии, оценивалось влияние мутации PNPLA3 на липидный профиль с учетом чувствительности к инсулину пациентов с НЖБП. Оказалось, что у гомозиготных носителей G/G с инсулинорезистентностью мутантный адипонутрин оказывал выраженное антигиперлипидемическое воздействие, проявляющееся снижением уровня ЛПОНП и ЛПНП, а также повышением уровня ЛПВП по сравнению с неносителями. Этот эффект был менее выражен в группе добровольцев с меньшей массой тела и отсутствовал у пациентов с более низкой резистентностью к инсулину [29].
Экзомное ассоциативное исследование липидов плазмы более чем у 300 тыс. человек [30] показало, что наличие мутантного варианта PNPLA3 ассоциировано с достоверно более низкими уровнями ЛПНП и ТГ в плазме крови, что сопровождалось снижением риска ишемической болезни сердца (ИБС) на 4%.
Таким образом, хотя данные о связи полиморфизма PNPLA3 с показателями липидного обмена противоречивы, большинство работ описывает благоприятное влияние G-аллели на липидный профиль и, по сути, отмечает его антиатерогенное действие. Особого внимания в этом контексте заслуживает публикация P.K. Luukkonen et al. [29], в которой атеропротективный эффект мутации PNPLA3 реализуется в группах пациентов с менее благополучным метаболическим статусом (с большей инсулинорезистентностью и выраженностью ожирения).
Связь полиморфизмов гена PNPLA3 с показателями обмена железа
Вопрос взаимосвязи гена PNPLA3 с обменом железа освещен в значительно меньшем количестве работ. В одной из них у группы лиц с мутантной аллелью, объединяющей генотипы C/G и G/G, отмечался достоверно более высокий уровень ферритина, а также более высокие уровни инсулина натощак, HOMA-IR, аланинаминотрансферазы (АЛТ) и окружности талии в сравнении с лицами с «диким» вариантом гена [31]. О связи G-аллели с повышенным уровнем ферритина сообщалось также в публикации K. Hotta et al. [32].
В исследовании, целью которого было изучить, связан ли полиморфизм PNPLA3 со стеатозом, стадией фиброза и циррозом печени у пациентов с наследственным гемохроматозом, уровни ферритина и насыщения трансферрина железом (НТЖ) значимо не различались между генотипами PNPLA3. Влияние полиморфизма гена на метаболические параметры (ИМТ, СД2, показатели липидограммы) также не было отмечено, но наличие G-аллели достоверно ассоциировалось с более выраженными стеатозом, фиброзом и более высокими уровнями трансаминаз. Связь мутантной аллели с циррозом печени наблюдалась только у лиц без избыточной массы тела [33].
В другой работе полиморфизм PNPLA3 у пациентов с наследственным гемохроматозом не коррелировал не только с параметрами железа и липидов, но и со степенью стеатоза и фиброза печени [34].
Связь полиморфизмов гена PNPLA3 с прогнозом пациента
По данным M.F. Xia et al. [4], у гомозигот G/G на 73% больше жира в печени, в 3,2 раза больше риск развития печеночного некровоспаления и в 1,9 раза выше риск цирроза, чем у гомозигот С/С, а наличие G-аллели ассоциировано с увеличением риска гепатоцеллюлярной карциномы (ГЦК) в 1,77 раза. Обзорная статья 2020 г. сообщает о двукратном увеличении вероятности НЖБП и трехкратном — неалкогольного стеатогепатита (НАСГ) и ГЦК на каждую G-аллель гена PNPLA3 [35].
Влияние генетических факторов на развитие цирроза печени и ГЦК оценивалось на 445 452 участниках из Дании и Великобритании. В работе изучались нуклеотидные варианты, способствующие формированию гепатостеатоза, в трех генах: PNPLA3, TM6SF2 и HSD17B13. Согласно метаанализу наличие хотя бы одной аллели, усиливающей накопление жира в печени (в случае с PNPLA3 это гетерозигота C/G при отсутствии мутаций в остальных генах), увеличивает риск развития цирроза в 1,6 раза, а двух аллелей (G/G гомозигота PNPLA3 при отсутствии мутаций в остальных генах) — в 2 раза. На риск формирования ГЦК наличие одной или двух мутантных аллелей, согласно данной работе, практически не влияло. Сосуществование 5–6 аллелей, способствующих формированию гепатостеатоза, связано с 12-кратным повышением риска цирроза печени и 29-кратным повышением риска ГЦК [36]. Роль полиморфизма PNPLA3 и других генов в развитии ГЦК рассматривается и в статье G.N Ioannou [37]. Автор предполагает, что мутантные аллели могут оказаться одним из факторов, способствующих онкологическим процессам в печени у пациентов с НЖБП на предцирротической стадии, однако вопрос требует дальнейшего изучения.
По результатам других исследований, у гомозигот G/G наблюдается 18-кратно повышенный риск смерти, связанной с поражением печени, в сравнении с гомозиготами С/С, а также примерно в 2 раза выше риск стеатоза печени, в 3–4 раза выше риск НАСГ и цирроза печени и до 12 раз выше риск ГЦК (рис. 2) [38].
![Рис. 2. Гомозиготность по PNPLA3 I148M и риск конечных точек, связанных с НЖБП [38] Рис. 2. Гомозиготность по PNPLA3 I148M и риск конечных точек, связанных с НЖБП [38]](https://medblog.su/wp-content/uploads/2023/12/1703561794_539_Rasprostranennost-i-laboratornye-osobennosti-polimorfizmov-gena-PNPLA3-u-patsientov-s.png)
По данным P. Gabriel-Medina et al. [39], наличие мутантной G-аллели увеличивает риск развития выраженного фиброза печени при НАСГ в 2,2 раза, в то время как при сочетании мутации PNPLA3 с СД2 этот риск возрастает в 14,7 раза. В работе российских исследователей отмечено более агрессивное течение НЖБП у лиц с генотипом C/G (гомозиготы PNPLA3 G/G в исследовании выявлены не были) с формированием высоких прогрессирующих стадий фиброза. Авторы предлагают рассматривать полиморфизм PNPLA3 I148M как неинвазивный маркер, отражающий формирование и прогрессирование фиброзных изменений в ткани печени у пациентов с НЖБП [40, 41].
В то же время мутантный вариант PNPLA3 rs738409 C>G ассоциирован со сниженным риском сердечно-сосудистых заболеваний и смертности, связанной с ИБС [4]. Так, в ретроспективном исследовании, включавшем 477 пациентов с гистологически подтвержденной НЖБП при медиане наблюдения 5,9 года генотип С/С оказался значимым фактором риска сердечно-сосудистых заболеваний, при этом среди лиц с данным генотипом распространенность СД2 и гиперурикемии была достоверно выше, чем среди лиц с мутантными аллелями [42]. В другой работе, включающей 60 801 пациента с ИБС и 123 504 контрольных пациента, G-аллель продемонстрировала умеренную защиту от ИБС, что может быть связано с более низкими уровнями липидов в плазме у этих пациентов [28]. Однако в публикации 2021 г. авторы пришли к выводу, что PNPLA3 не оказывает независимого влияния на сердечно-сосудистый риск у пациентов с СД2, а гипотеза о кардиопротективном действии G-аллели еще требует своего подтверждения [43]. Также у носителей аллели G описан более низкий риск атеросклероза сонных артерий: увеличение содержания жира в печени у лиц с генотипом PNPLA3 C/C сопровождалось достоверным увеличением средней и максимальной толщины комплекса интима-медиа сонных артерий, чего не было при генотипе G/G [44]. Однако в более ранней работе, напротив, сообщалось об ассоциации генотипа PNPLA3 G/G с более выраженным атеросклерозом сонных артерий у более молодых пациентов с НЖБП [45].
Описана связь между G/G генотипом PNPLA3 и риском хронической болезни почек и аномальной альбуминурии. Так, пациенты с НЖБП и нормальным уровнем АЛТ в случае носительства G-аллели (rs738409) имеют более высокий риск раннего повреждения почечных клубочков и канальцев. Авторы считают, что генотипирование PNPLA3 может помочь выявлять пациентов с НЖБП с более высоким риском тубулярного повреждения почек [46].
Генетические варианты PNPLA3 также влияют на эффективность терапии НЖБП. Например, в финском исследовании у пациентов с генотипом G/G 6-дневная гипокалорийная низкоуглеводная диета привела к большему снижению содержания жира в печени, чем у лиц с генотипом C/C (45% против 18%) [47]. В 12-месячной программе изменения образа жизни со снижением массы тела >10% G/G гомозиготы показали значительно большее снижение содержания жира в печени, чем гетерозиготы C/G и гомозиготы C/C [48]. Среди пациентов с морбидным ожирением и НЖБП у носителей G-аллели наблюдалось значительно большее уменьшение степени выраженности стеатоза печени через 1 год после бариатрической операции со средней потерей массы тела 40 кг, чем у носителей «дикого» типа [49]. Однако исследование эффективности лечения препаратом Омакор (омега-3-полиненасыщенные жирные кислоты) показало противоположный результат: содержание жира в печени снижалось благодаря лечению докозагексаеновой и эйкозапентаеновой кислотами только у носителей PNPLA3 C/C и C/G, но не у носителей генотипа G/G [50]. В недавнем исследовании EFFECT-II изучалось влияние дапаглифлозина и омега-3-карбоновой кислоты на стеатоз печени. Было обнаружено, что по сравнению с носителями «дикого» генотипа PNPLA3 носители G-аллели показывают меньшее снижение содержания жира в печени при лечении дапа-глифлозином, сопоставимое снижение — при лечении омега-3-карбоновой кислотой и большее снижение — в группе комбинированного лечения [4, 51]. Применение эксенатида in vitro и у пациентов с СД2 в течение 24 нед. было более эффективным для С/С-генотипа, что выражалось в уменьшении степени выраженности стеатоза печени у пациентов и в уменьшении стеатоза и воспалительных процессов in vitro в сравнении с пациентами с G/G гомозиготами PNPLA3 [52].
Собственное исследование
Цель исследования — изучить влияние полиморфизма PNPLA3 на клинико-лабораторные показатели, а также на выраженность стеатоза и фиброза печени у пациентов с НЖБП.
Материал и методы. В исследование включено 30 пациентов (из них 22 — мужчины) с НЖБП в возрасте от 18 до 74 лет (средний возраст 52,5±8,9 года). Исключались пациенты с сочетанной алкогольной болезнью печени, вирусными гепатитами, лекарственным поражением печени, наследственным гемохроматозом, аутоиммунными заболеваниями печени. Стеатоз печени оценивался по УЗИ брюшной полости, онлайн-калькуляторам Fatty Liver Index (FLI) и Hepatic Steatosis Index (HSI). Фиброз печени оценивался с помощью онлайн-калькулятора NAFLD Fibrosis Score (NFS) и фиброэластографии печени. Измерялись антропометрические данные, выполнялись клинический, биохимический анализы крови, генетическое тестирование на PNPLA3. Пациенты были разделены на 3 группы в зависимости от полученного генотипа PNPLA3 (C/C, C/G и G/G). Внутри групп для каждого параметра определялись медиана (Ме), 1-й (Q1) и 3-й (Q3) квартили. Достоверность различий между группами оценивалась по U-критерию Манна — Уитни для малых выборок. Достоверным считалось различие p<0,05 (доверительный интервал 95%).
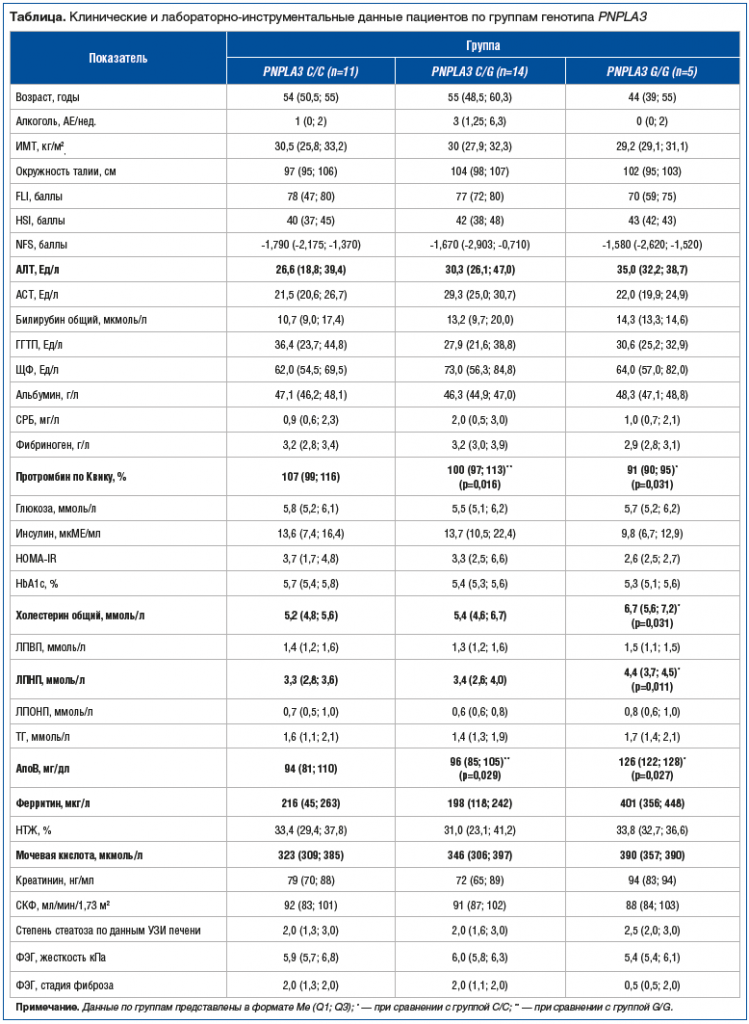
Результаты исследования. Генотип С/С был выявлен у 11 (36,7%) пациентов, С/G — у 14 (46,7%) пациентов и G/G — у 5 (16,7%) пациентов. Группы существенно не различались между собой по возрасту, количеству употребляемого алкоголя, ИМТ, окружности талии и большинству лабораторно-инструментальных показателей (см. таблицу).
Пациенты с генотипом G/G имели значительно более высокий уровень ОХ и ЛПНП в сравнении с лицами с «диким» вариантом генотипа, а уровень АпоВ в G/G-группе значимо превышал таковой у пациентов не только с С/С, но и с С/G-генотипом (рис. 3).
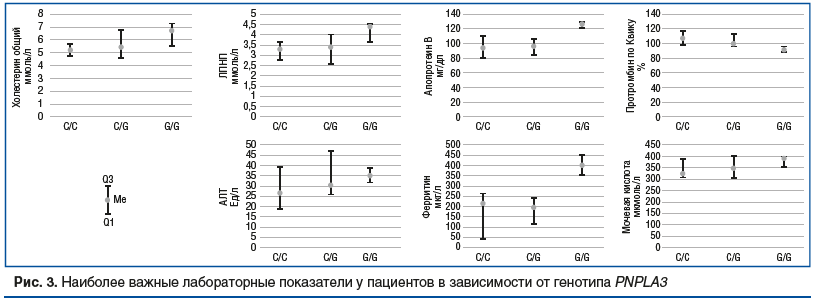
Неожиданно были получены существенно более низкие значения протромбина по Квику в группе гомозигот по G-аллели в сравнении с C/G и С/С-генотипами. Также отмечалась тенденция к более высоким показателям АЛТ, ферритина и мочевой кислоты у носителей G-аллели (см. рис. 3).
Заключение. Полиморфизм гена PNPLA3 не был достоверно связан с выраженностью стеатоза печени, что, с одной стороны, может быть обусловлено небольшим размером выборки, с другой — использованием косвенных методов оценки стеатоза, точность которых ниже, чем у протонной магнитно-резонансной спектроскопии или гистологического исследования. Отсутствие связи PNPLA3 с показателями углеводного обмена в целом не противоречит имеющимся мировым данным.
В то же время у носителей G/G-гомозигот оказался более атерогенный липидный профиль (существенно более высокие уровни ОХ, ЛПНП и АпоВ), что не совпадает с результатами большинства опубликованных ранее исследований. Причину подобного отличия еще предстоит выяснить с помощью включения в исследование большего числа пациентов и проведения корреляционного анализа с другими лабораторно-инструментальными показателями. Стоит отметить, что в группе с G/G-генотипом медиана возраста была ниже, чем у обладателей «дикого» генотипа (р=0,277, критерий Манна — Уитни). Возможно, более атерогенный липидный профиль молодых пациентов связан с отсутствием или недостаточно скорректированной гиполипидемической терапией. Однако в уже упомянутой работе S. Petta et al. [45] генотип PNPLA3 G/G был ассоциирован с более выраженным атеросклерозом сонных артерий именно у более молодых пациентов с НЖБП.
Существенно более низкие уровни протромбина по Квику у носителей G/G гомозигот PNPLA3 в сравнении с пациентами с С/С и С/G-генотипами могут свидетельствовать о начальном снижении белоксинтезирующей функции печени у таких пациентов, что требует наблюдения в динамике. Уровни альбумина между группами при этом не различались.
Тенденция к повышению уровня ферритина и мочевой кислоты у носителей G-аллели должна быть повторно оценена на большем числе исследуемых, поскольку достоверное различие по данным показателям повлияет на прогноз как со стороны заболевания печени, так и со стороны сердечно-сосудистой патологии.
Обсуждение
Благодаря накопленному опыту не остается сомнений, что мутация в гене PNPLA3 способна приводить к развитию стеатоза печени, увеличивать риски прогрессирования ее фиброза с последующим развитием цирроза и ГЦК. Однако влияние мутации на метаболические нарушения остается до конца не изученным. Интересен факт, что нередко G-аллель реализует свои негативные воздействия у лиц с меньшим ИМТ. Большинство исследователей расценивают такую особенность как «независимое влияние мутации» на возникновение того или иного отклонения (стеатоза печени, изменений показателей углеводного и липидного обмена). В рассмотренных выше работах обращают на себя внимание следующие факты:
Генотип G/G гораздо чаще встречается у лиц с СД2 без ожирения, чем у лиц с СД2 и ожирением (46,7 против 20%) [14].
У лиц с ожирением наличие G-аллели значительно увеличивало чувствительность к инсулину, чего не наблюдалось у лиц с низким ИМТ [20].
У носителей гомозигот G/G с ожирением и инсулинорезистентностью мутантный PNPLA3 оказывал значимое антигиперлипидемическое действие (снижение уровня ЛПОНП и ЛПНП, повышение уровня ЛПВП), которое было менее выражено в группе с меньшей массой тела и отсутствовало у лиц с меньшей инсулинорезистентностью [29].
У лиц с наследственным гемохроматозом связь G-аллели с циррозом печени наблюдалась только у лиц без избыточной массы тела [33].
В связи с вышеперечисленным складывается впечатление, что ожирение как таковое способно нивелировать негативные «системные» эффекты мутантной G-аллели PNPLA3 или, более того, реализовывать его «протективные» свойства. В то же время снижение массы тела приводит к лучшему разрешению стеатоза печени у носителей G-аллели [47–49], а назначение противодиабетических препаратов (дапаглифлозина, эксенатида), напротив, оказывается эффективнее для носителей С/С-гомозигот [4, 51, 52], что также указывает на большую роль инсулинорезистентности для носителей «дикого» варианта генотипа.
В настоящее время основой лечения НЖБП по-прежнему остается снижение массы тела, однако пациенты со стеатозом печени без избыточной массы тела, в большинстве случаев обладающие мутацией PNPLA3 I148M, требуют иного подхода. Для данной группы пациентов перспективным представляется применение урсодезоксихолевой кислоты (УДХК) — препарата Урдокса®. Согласно недавно проведенному исследованию прием УДХК (Урдокса®) в дозе 15 мг/кг массы тела в сутки в течение 6 мес. приводит к уменьшению выраженности стеатоза печени независимо от потери массы тела. Помимо этого, терапия УДХК (Урдокса®) сопровождается нормализацией уровня печеночных ферментов и улучшением липидного профиля [53]. Эффективность влияния препаратов УДХК на стеатоз печени требует изучения с учетом генотипа PNPLA3 пациентов.
Заключение
Таким образом, мутантный вариант гена PNPLA3 ассоциирован с более выраженным стеатозом и прогрессирующим фиброзом печени. Тем не менее его влияние на ряд лабораторных показателей остается предметом дискуссий. Понимание механизмов, лежащих в основе метаболических нарушений при полиморфизме PNPLA3, позволит более дифференцированно подходить к выбору терапии и определению прогноза пациента, поэтому требует дальнейших исследований на больших выборках пациентов.
Информация с rmj.ru






