Проявление первичного гиперпаратиреоза со стороны костной системы
Актуальность проблемы
Первичный гиперпаратиреоз (ПГПТ) — третье по частоте эндокринное заболевание после сахарного диабета и патологии щитовидной железы. Распространенность ПГПТ, по данным И.И. Дедова и соавт., в общей популяции составляет около 1%, среди населения старше 55 лет — 2%, ежегодная заболеваемость варьирует от 0,4 до 18,8 случая на 10 000 населения [1]. В России масштабных эпидемиологических исследований по этой теме не проводилось, однако, согласно данным пилотного проекта, распространенность ПГПТ в Москве составила 0,03%, заболеваемость —
6,8 на 1 млн населения [2]. Показатель распространенности ПГПТ напрямую зависит от возможностей лабораторной диагностики, в связи с чем в более развитых странах распространенность ПГПТ выше [3, 4]. В целом распространенность ПГПТ в настоящее время имеет тенденцию к росту, что связано в первую очередь с возрастающими возможностями лабораторной и инструментальной диагностики.
Поражение костей скелета является одним из ключевых проявлений ПГПТ и встречается при всех формах данной патологии. Наиболее выражены изменения скелета при манифестной форме заболевания, они характеризуются наличием фиброзно-кистозного остеита и так называемых бурых опухолей — остеолитических поражений кости, в тяжелых случаях приводящих к патологическим переломам. Дифференциальная диагностика фиброзно-кистозного остеита проводится с другими литическими поражениями скелета, в первую очередь со злокачественными опухолями. Гистологическая картина фиброзно-кистозного остеита схожа с некоторыми видами сарком и светлоклеточного рака, данное сходство может значительно затруднить дифференциальную диагностику и привести к ошибочной лечебной тактике. Изменения скелета при мало- и бессимптомном ПГПТ характеризуются уменьшением костной плотности и нарушениями микроархитектоники кости, что ведет
к повышенному риску малотравматичных переломов. После паратиреоидэктомии наблюдается регресс скелетной симптоматики, но процесс реминерализации,
его скорость и полнота нуждаются в дальнейшем изучении.
Содержание статьи
Этиология и формы ПГПТ
Причиной ПГПТ в 80–85% случаев является солитарная аденома паращитовидной железы, в 10–15% — множественные изменения (множественные аденомы и гиперплазии паращитовидных желез), в 1–5% случаев — рак щитовидной железы [1].
Различают нормокальциемическую, мягкую и манифестную формы ПГПТ. Для нормокальциемической формы характерны нормальные показатели общего и ионизированного кальция крови при повышенном уровне паратиреоидного гормона. Мягкая форма проявляется наличием только неспецифических жалоб при отсутствии объективных клинических проявлений. Манифестная форма ПГПТ в большинстве случаев сопровождается нарушениями опорно-двигательного аппарата (остеопороз, кистозная остеодистрофия, деформации костей, патологические переломы), патологией почек (нефролитиаз, нефрокальциноз, снижение фильтрационной и концентрационной функций), желудочно-кишечного тракта (рецидивирующие дефекты слизистой желудка и 12-перстной кишки, панкреатиты и панкреокалькулез) и нейрокогнитивными расстройствами [1]. В целом клинически значимые поражения костей встречаются у 5–15% пациентов с ПГПТ, в т. ч. кистозно-фиброзный остеит — у 2–5%, бурые опухоли — у 0,8% пациентов [5–7]. В ряде развивающихся стран Азии и Среднего Востока манифестная форма заболевания является превалирующей [8, 9], в этих регионах она в 58–69% случаев характеризуется наличием клинических форм кистозного фиброза [10, 11]. В России также диагноз ПГПТ в 70–80% случаев ставится на этапе тяжелых системных нарушений, однако в последние 10 лет наблюдается тенденция к диагностике на более раннем этапе [1]. По данным регистрового исследования, включавшего 1053 пациента с ПГПТ, нарушения со стороны опорно-двигательного аппарата были выявлены у 91% пациентов, боли в костях — у 66%, деформации скелета — у 20%, патологические переломы — у 36% пациентов [1].
Патогенез ПГПТ
Ключевым моментом патогенеза ПГПТ является повышенная выработка паратгормона (ПТГ). Избыточная секреция ПТГ вызывает активацию витамина D в почках, что ведет к повышению гастроинтестинальной абсорбции и канальцевой реабсорбции кальция, а также к повышению активности остеокластов и, как следствие, поражению костей. Кроме того, ПТГ снижает канальцевую реабсорбцию фосфатов и увеличивает их почечную экскрецию [5]. Таким образом, для классических форм ПГПТ характерны гиперкальциемия, гипофосфатемия и повышение сывороточного уровня ПТГ [5]. Костные поражения при ПГПТ частично происходят за счет деструкции кристаллов гидроксиапатита, но в основном за счет остеокластической резорбции [5]. Согласно последним исследованиям воздействие ПТГ на костную систему может носить как катаболический, так и анаболический характер: превалирование того или иного эффекта определяет костную массу и архитектонику кости. При ПГПТ постоянный высокий уровень ПТГ приводит к активации остеокластогенеза и функции остеокластов, что ведет к уменьшению костной массы и увеличивает риск переломов. Напротив, прерывистое назначение как полноценного ПТГ (ПТГ1-84 — зрелая форма ПТГ, содержащая 84 аминокислоты), так и его биологически активного укороченного фрагмента (терипаратид) стимулирует остеобластогенез, созревание и дифференциацию остеобластов [12].
Рандомизированные контролируемые и проспективные исследования, посвященные выраженным костным нарушениям при ПГПТ, отсутствуют. В основном вся научная литература по данной теме представлена лишь описаниями отдельных случаев и небольших серий.
Клиническая картина ПГПТ
Клинические проявления ПГПТ чаще всего неспецифичны и ограничиваются болями в костях, мышечной слабостью и гипорефлексией. Ряд авторов указывают на то, что у пациентов наблюдается значительная потеря веса в течение 3–4 мес. [5, 8]. При патологических переломах болевой синдром выражен умеренно, пациенты отмечают внезапную потерю опороспособности нижних конечностей или локальное усиление болей [13]. При клиническом обследовании выявляются умеренно выраженная болезненность и отек мягких тканей в зоне пораженного сегмента [5].
Рентгенологически ПГПТ проявляется характерными литическими изменениями, известными как фиброзно-кистозный остеит, фиброзно-кистозная остеопатия, костный кистоз или бурые опухоли. Типична диффузная деминерализация, особенно выраженная в длинных трубчатых костях. В костях черепа наблюдается так называемый симптом «перца и соли» — чередование мелких участков остеопороза с участками нормальной плотности кости. Также характерными являются субпериостальные эрозии кости дистальных и средних фаланг, обычно более выраженные с лучевой стороны, и кистозные просветления дистальных отделов ключиц [5]. Наиболее частой локализацией множественных изменений являются кости таза и длинные трубчатые кости (рис. 1) [8, 14].
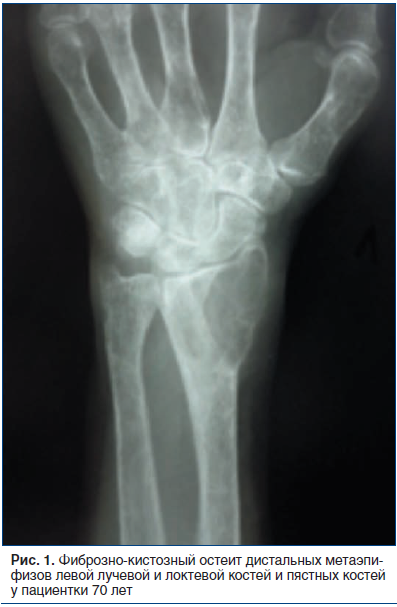
Финальной стадией фиброзно-кистозного остеита является образование так называемых бурых опухолей — крупных полостей, заполненных желеобразным коричневым содержимым. Бурые опухоли не являются новообразованиями в прямом смысле, а представляют собой результат быстрой потери костной массы с замещением костного мозга грануляциями и фиброзной тканью [13]. Они чаще развиваются в большеберцовой, бедренной кости, костях таза, позвонках, ребрах и нижней челюсти [15]. У некоторых пациентов на рентгенограммах кортикальные отделы кости настолько истончаются, что становятся неразличимыми [8, 14]. На КТ выявляются характерные изменения в виде одиночных или множественных остеолитических участков, заполненных фиброзной тканью и расположенных как в области костномозгового канала, так и кортикально. В структуре кости могут быть выявлены зоны некроза с образованием кист с определяющимся уровнем жидкости, кровоизлияний и обызвествлений [16]. Конечной стадией прогрессирования фиброзно-кистозного остеита является развитие патологического перелома. Наиболее часто наблюдаются патологические переломы плеча, бедра и костей таза (рис. 2).
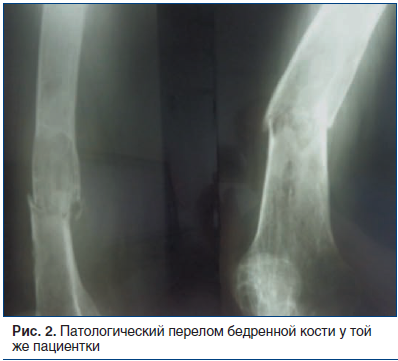
Дифференциальная диагностика ПГПТ
Дифференциальная рентгендиагностика фиброзно-кистозного остеита должна проводиться с другими остеолитическими поражениями: метастазами опухоли, неходжкинской лимфомой, миеломой, фиброзной дисплазией, доброкачественными и злокачественными сосудистыми опухолями, остеомиелитом и энхондромой [17].
Гистологически фиброзно-кистозный остеит представляет собой последствия остеокластической резорбции кости: нерегулярные трабекулярные структуры, окруженные рыхлой фиброзной тканью с увеличенным количеством остеобластов и остеокластов, а также зоны грануляционной ткани с воспалительными, гигантскими клетками и скоплениями гемосидерина. При тяжелых поражениях полости сливаются, образуя большие дефекты, содержащийся в них гемосидерин обусловливает бурую окраску содержимого, отсюда название — «бурые опухоли» [5, 18]. Наряду с фиброзной тканью и недостаточно минерализованной волокнистой костью эти кистозные образования содержат веретеновидные клетки [19, 20]. Гистологическая структура кистозно-фиброзных изменений при ПГПТ своим строением и клеточным составом может напоминать гигантоклеточные опухоли и некоторые виды сарком [18, 21, 22]. Таким образом, данные рентгенографического исследования, КТ и даже гистологического исследования не гарантируют точной диагностики паратиреоидной остеодистрофии. Схожесть рентгенологической картины и гистологической структуры, а также мультисегментарное поражение могут вводить в заблуждение клиницистов и симулировать злокачественные опухоли. Описаны случаи, когда пациентам с подобной картиной проводилась лучевая терапия и выполнялись различные резецирующие оперативные вмешательства, в т. ч. ампутация конечностей [13, 23].
Основными критериями дифференциальной диагностики гиперпаратиреоидной кистозно-фиброзной остеопатии являются лабораторные показатели: повышенное содержание ПТГ, гиперкальциемия и гипофосфатемия. Однако необходимо учитывать, что решающее значение имеют лишь высокие показатели ПТГ. Гиперкальциемия может наблюдаться и у пациентов со злокачественными опухолями — при распространенном онкологическом процессе частота ее достигает 30% [13].
После внедрения в начале 1970-х гг. в клиническую практику рутинного определения уровня кальция в сыворотке крови показатели распространенности ПГПТ значительно возросли. С другой стороны, ввиду более ранней диагностики значительно изменились клинические проявления заболевания. Если ранее основными клиническими признаками ПГПТ были рецидивы мочекаменной болезни, наличие фиброзно-кистозного остеита и нейромускулярной дисфункции, то в настоящее время преобладают асимптомные формы ПГПТ, часто определяемые по наличию гиперкальциемии или выявляемые при обследовании по поводу остеопороза и переломов, произошедших при минимальной травме [3, 4, 8, 17]. Однако вовлеченность костной системы в патологический процесс имеет место и при доклинических формах ПГПТ [12]. Обычное рентгеновское исследование костной системы в этих случаях малоинформативно, т. к. выявляет остеопению лишь при 20% потере костной ткани [24].
Одним из методов диагностики костных изменений при асимптомном и малосимптомном ПГПТ (мягкая и нормокальциемическая формы) является двухэмиссионная рентгеновская денситометрия. В этом исследовании классическим признаком ПГПТ является преимущественная редукция минеральной плотности дистальной кортикальной трети лучевой кости и, в меньшей степени, — губчатой (трабекулярной) кости [12]. В трабекулярной кости при ПГПТ увеличивается количество как остеокластов, так и остеобластов, но костная резорбция превалирует над формированием костной ткани. В результате период формирования новой кости затягивается, однако в определенной степени сохраняется, этим объясняется относительно меньшая ее редукция. Наоборот, в кортикальной кости порозность и эндокортикальная резорбция ведут к более значимой потере костной массы [12]. В поясничных позвонках, относительно богатых трабекулярным компонентом, при ПГПТ обычно выявляется умеренная редукция. Эти данные подтверждаются гистоморфометрическими исследованиями и микрокомпьютерным анализом костных биоптатов [25, 26]. Данные денситометрии и гистоморфометрии согласуются между собой, однако в определенной степени противоречат результатам большого числа эпидемиологических исследований, в которых у пациентов с ПГПТ демонстрируется высокий риск как вертебральных, так и невертебральных переломов [27–29].
В настоящее время все большее распространение получают новые технологии обследования, такие как периферическая количественная КТ, обладающая высокой разрешающей способностью и демонстрирующая нарушения архитектуры костной ткани, в т. ч. у пациентов с асимптомными формами ПГПТ [14]. Данные, полученные с помощью периферической количественной КТ, в большей степени согласуются с результатами эпидемиологических исследований. Согласно этим данным при ПГПТ поражаются как кортикальный, так и трабекулярный компонент кости, при этом уменьшается их объемная плотность, истончаются кортикальные слои, расстояние между трабекулами увеличивается, сами трабекулы истончаются, становясь прерывистыми и гетерогенными [30–32]. Нагрузка способствует некоторому смягчению нежелательных явлений, вследствие чего лучевая кость, не несущая нагрузки, обычно поражается в большей степени, чем регулярно испытывающая нагрузку большеберцовая [30–32]. У женщин с ПГПТ в постменопаузе периферическая количественная КТ выявляет измененную конфигурацию трабекулярной сети с уменьшением пластинчатых и продольных трабекул, трабекулярная сеть отличается менее выраженной аксиальной направленностью [31].
Новым суррогатным маркером костной структуры и микроархитектоники является трабекулярный костный индекс — тканевой показатель, оценивающий пиксельные отклонения по шкале градаций серого на денситометрических изображениях и определяемый при двухэмиссионной рентгеновской денситометрии с помощью специальных компьютерных программ [33–35]. Высокие показатели трабекулярного костного индекса ассоциируются с плотной трабекулярной сетью и высокой прочностью кости, низкие — с низким качеством костной структуры [34, 35]. Проспективные исследования, выполненные у женщин в постменопаузе, демонстрируют состоятельность данного показателя как предиктора переломов позвонков, бедра и других малотравматичных переломов [36, 37]. При ПГПТ трабекулярный костный индекс показывает частичную деградацию микроархитектуры, в т. ч. у пациентов с преимущественно асимптомными и мягкими формами заболевания. У пациентов с асимптомной формой ПГПТ, по данным двухэмиссионной рентгеновской денситометрии, нормальное строение костной ткани поясничных позвонков определяется в 50% случаев, а по данным трабекулярного костного индекса — лишь в 27% случаев. Низкие показатели трабекулярного костного индекса у пациентов с ПГПТ ассоциируются с повышенным риском переломов позвонков [38, 39].
Сопутствующие ПГПТ изменения опорно-двигательного аппарата
Динамика скелетных изменений у пациентов с мягкой формой ПГПТ изучена в 2 проспективных когортных исследованиях. D.S. Rao et al. в течение 11 лет провели мониторинг 80 пациентов с асимптомной формой ПГПТ и не выявили отрицательной динамики биохимических и денситометрических показателей [40]. S.J. Silverberg et al. наблюдали 101 пациента с асимптомным течением ПГПТ в течение 10 лет. У 25% пациентов было отмечено прогрессирование заболевания. Единственным независимым фактором риска прогрессирования был возраст: отрицательная динамика в 3 раза чаще наблюдалась у пациентов, возраст которых был моложе 50 лет на момент включения в исследование [25]. Через 15 лет наблюдения этих же пациентов удельный вес прогрессии увеличился до 37% [41]. У пациентов с мягкой формой ПГПТ без паратиреоидэктомии в анамнезе минеральная плотность кости в течение более 8 лет оставалась стабильной, но затем начинала прогрессивно уменьшаться в кортикальном слое, отмечалась усиленная потеря костной массы дистальной трети лучевой кости и шейки бедра, выявленная в промежутке между 10 и 15 годами наблюдения [41].
Многие специалисты рекомендуют определять уровень ПТГ у пациентов с имеющимися или предполагаемыми метаболическими костными проявлениями ПГПТ, протекающими на фоне нормального уровня кальция крови [25, 42, 43]. Вследствие этого нормокальциемическая форма ПГПТ чаще всего диагностируется в популяции обратившихся по поводу метаболической костной патологии, что косвенно подтверждает мнение о том, что данная форма ПГПТ не является в полном смысле бессимптомной. В продольном когортном исследовании Н. Lowe et al., включавшем 37 пациентов, на момент диагностики нормокальциемической формы ПГПТ у 57% пациентов имелся остеопороз (позвонков — у 34%, бедренных костей — у 38%, дистальных отделов лучевой кости — у 28%), у 11% в анамнезе присутствовали малотравматичные переломы, у 14% — нефролитиаз [44]. По данным двухэмиссионной рентгеновской денситометрии, в отдаленном периоде со средним сроком наблюдения 3,1 года у 43% пациентов с нормокальциемической формой ПГПТ наблюдалось уменьшение костной массы минимум на 5% [44].
В большинстве исследований указывается на повышенный риск переломов при ПГПТ по сравнению с общей популяцией, однако степень этого риска крайне вариабельна [12]. При проведении в Голландии крупного когортного исследования, включавшего 1201 пациента, было выявлено увеличение общей частоты переломов, а также переломов предплечья и позвоночника у пациентов с ПГПТ, в т. ч. за 10 лет, предшествующих установлению диагноза [27]. В проспективном контролируемом исследовании Е. Vignali et al. (150 пациенток с ПГПТ и 300 пациенток в контрольной группе) было выявлено увеличение частоты переломов позвонков у женщин с ПГПТ в постменопаузе, однако это наблюдалось лишь у пациенток, имеющих показания к паратиреоидэктомии (28,1% против 11,1%, р=0,03). У пациенток, не имевших показаний к паратиреоидэктомии, частота переломов позвонков существенно не отличалась от таковой в контрольной группе (р=0,06) [28]. По данным С. Marcocci et al., несмотря на преимущественное вовлечение в патологический процесс кортикального компонента кости, при ПГПТ наблюдался увеличенный риск переломов периферических отделов скелета (состоящих в основном из губчатой кости) и позвоночника [12]. Риск переломов бедра у пациентов с ПГПТ представляется лишь незначительно повышенным [45].
Лечение ПГПТ
Наличие выраженного фиброзно-кистозного остеита, бурых опухолей и патологических переломов является одним из абсолютных показаний к хирургическому лечению — паратиреоидэктомии [1]. Большинство исследователей отмечают восстановление пораженной кости после хирургического лечения, однако сроки и объем восстановления значительно варьируют. Согласно исследованию G. Agarwal et al. через 3 мес. после лечения, несмотря на регрессию болевого синдрома, остеопенические изменения поясничных позвонков, бедренных костей и дистальных отделов лучевых костей сохранялись, хотя и имели тенденцию к уменьшению. Наиболее быстрое восстановление минеральной плотности наблюдалось в бедренных костях, наименее быстрое — в дистальных отделах лучевых костей [46]. Данные S. Sathyakumar et al. свидетельствуют о более быстром восстановлении минерализации трабекулярного компонента кости по сравнению с кортикальным: через 1 год после оперативного вмешательства t-показатель минеральной плотности кости шейки бедра увеличился от -4,2 до 1,3, поясничных позвонков — от -3,2 до 0,1, дистальных отделов луча — лишь от -4,2 до -2,1 [15]. По данным различных источников, прирост минеральной плотности кости через 1–4 года после успешной паратиреоидэктомии составил от 6 до 84% [5, 47]. M.A.S. Sandoval et al. отметили полную реминерализацию литических дефектов фаланг пальцев кисти через 3 года после паратиреоидэктомии, при этом в зоне бывших литических изменений регистрировалась повышенная плотность кости [48].
В запущенных случаях даже после успешной паратиреоидэктомии могут оставаться выраженные кистозные изменения пораженных костей, ведущие к грубым деформациям таза, верхних и нижних конечностей и требующие впоследствии оперативной коррекции [46].
Патологические переломы обычно консолидируются спонтанно через 6 мес. после паратиреоидэктомии. В ряде случаев используется дополнительное хирургическое лечение — фиксация костей пластинами с угловой стабильностью с цементным усилением или без него, однако показания к данному лечению до настоящего времени не определены [5].
Показаниями к паратиреоидэктомии у пациентов с асимптомной формой ПГПТ считаются снижение t-показателя костной плотности любой локализации менее -2,5 и наличие в анамнезе остеопенических переломов [42]. В когортном исследовании M.R. Rubin et al., включавшем 116 пациентов, у 85% из которых ПГПТ протекал асимптомно, изучено восстановление костной плотности по данным двухэмиссионной рентгеновской денситометрии через 5, 10 и 15 лет после успешной паратиреоидэктомии. Прирост костной плотности поясничных позвонков через 5 лет составил 9%, через 10 лет — 6%, через 15 лет — 12%; шейки бедра — соответственно 1%, 7% и 10%, дистального отдела лучевой кости — 4%, 8% и 7% [41]. В проспективном исследовании S. Hansen et al. была изучена динамика изменений костей скелета у женщин с ПГПТ до и через 1 год после паратиреоидэктомии. Для оценки динамики использовались двухэмиссионная рентгеновская денситометрия и периферическая количественная КТ. Группа исследования включала 27 пациенток, контрольная группа — 31. По данным двухэмиссионной рентгеновской денситометрии положительная динамика была отмечена в поясничных позвонках и бедренных костях (р<0,05). По данным периферической количественной КТ, значительная положительная динамика как кортикальных, так и трабекулярных компонентов была отмечена в лучевых и большеберцовых костях (p<0,05) [30].
Медикаментозная терапия может проводиться пациентам с гиперкальциемией и снижением минеральной плотности кости, у которых имеются противопоказания к оперативному лечению. Целью терапии является поддержание уровня кальция сыворотки и коррекция дефицита витамина D [12]. Медикаментозная терапия может увеличивать минеральную плотность кости или уменьшать уровень кальция сыворотки.
По данным метаанализа S. Sankaran et al. (40 включенных исследований, из них 11 рандомизированных контролируемых и 29 обсервационных), антирезорбтивная терапия (эстрогены, бисфосфонаты) способна увеличить минеральную плотность кости у пациентов с мягкой формой ПГПТ до уровня, сравнимого с уровнем после паратиреоидэктомии, что позволяет использовать ее у больных с умеренно выраженной гиперкальциемией и низкой минеральной плотностью кости [49]. Кальцимиметики опосредованно угнетают секрецию ПГТ и канальцевую реабсорбцию кальция. Согласно данным С. Marcocci et al., минеральная плотность кости у пациентов, в течение 5 лет принимавших данные препараты, не менялась. Кальцимиметики могут использоваться у пациентов с умеренным снижением минеральной плотности кости, но выраженной гиперкальциемией [12].
Вопрос об уменьшении риска переломов после успешной паратиреоидэктомии остается неясным [12]. В одном из когортных исследований, включавшем 674 пациента, сообщается об уменьшении общей частоты переломов с 1,8 до 1,0 (р<0,006) и частоты переломов предплечья с 1,9 до 0,7 (р<0,03), однако частота переломов позвонков и бедра не изменялась. Через 10 лет после паратиреоидэктомии частота переломов вновь возрастала, в основном за счет переломов лучевых костей [50]. В другом исследовании, включавшем 1934 пациента, указывается, что паратиреоидэктомия уменьшала риск переломов в целом и переломов дистального отдела предплечья и бедра в частности [27]. Благоприятный эффект паратиреоидэктомии отмечен как у пациентов, перенесших переломы до операции, так и у тех, у кого до операции не было переломов [12]. Эффект влияния медикаментозной терапии на частоту переломов не изучен [12].
Заключение
Таким образом, поражение костей скелета является одним из ключевых проявлений ПГПТ и встречается при всех его формах. При манифестной форме заболевания патология опорно-двигательного аппарата наиболее выражена, она характеризуется наличием фиброзно-кистозного остеита, в тяжелых случаях приводящего к патологическим переломам. Дифференциальная диагностика фиброзно-кистозного остеита проводится с другими литическими поражениями скелета, в первую очередь со злокачественными опухолями. Основными дифференцирующими критериями являются повышенное содержание ПТГ, гиперкальциемия и гипофосфатемия. Патология костной ткани при мало- и бессимптомном течении ПГПТ характеризуется уменьшением костной плотности и нарушениями микроархитектоники кости. Наиболее распространенным методом их диагностики является двухэмиссионная рентгеновская денситометрия. В последнее время все большую популярность приобретает периферическая количественная компьютерная томография, обладающая высокой разрешающей способностью и позволяющая осуществлять точную оценку микроархитектоники пораженной кости. Наличие выраженного фиброзно-кистозного остеита, патологических переломов, снижение t-показателя костной плотности менее -2,5 и наличие в анамнезе остеопенических переломов являются показаниями к паратиреоидэктомии, после которой отмечаются увеличение минеральной плотности кости и реминерализация литических дефектов. Данные о полноте и продолжительности процессов восстановления кости противоречивы, процесс реминерализации нуждается в дальнейшем изучении. Консервативная терапия проводится при наличии противопоказаний к паратиреоидэктомии. Вопрос об уменьшении риска переломов после успешной паратиреоидэктомии изучен недостаточно: в имеющихся исследованиях указывается на его снижение, но данные о степени этого снижения при различных локализациях неоднозначны.
Информация с rmj.ru





