Содержание статьи
Протеин С и хроническая венозная недостаточность при роже
нижних конечностей
Е. Г. Фокина, кандидат медицинских наук
ФБУН ЦНИИЭ Роспотребнадзора, Москва
Рожа лица и рожа нижних конечностей как острое стрептококковое заболевание
встречается повсеместно, без тенденции к снижению в обозримом будущем. Чаще
всего воспалительный процесс развивается на нижних конечностях (67%), реже — на
лице (24%). Многие авторы указывают на связь рожи нижних конечностей с наличием
соматических заболеваний, таких как ожирение, сахарный диабет 2-го типа и
фоновая грибковая инфекция стоп и ногтей. Не менее часто фактором,
предрасполагающим к развитию рожи, являются хроническая венозная недостаточность
(ХВН) и хроническая лимфовенозная недостаточность (ХЛВН) [1–6].
В последние годы частота выявления геморрагических форм рожи заметно
нарастает, что заставляет исследователей особое внимание уделять состоянию
сосудистой стенки и системы свертывания крови в целом [7–10].
Протеин С, витамин К-зависимая протеаза, синтезируется в печени, откуда
поступает в кровоток. В норме он находится в неактивном состоянии. При
инфекционно-воспалительных процессах в крови наблюдается связывание протеина С с
кофактором (протеином С) и дальнейшее его взаимодействие с тромбомодулином и
эндотелиальным рецептором протеина С. Активированный протеин С (АПС) ингибирует
каскадный механизм свертывания на ранней стадии тромбинообразования (за счет
инактивации Va и VШа факторов свертывания). Другой важной его функцией является
способность ускорять плазминоген-зависимый лизис тромба, что является прямым
проявлением его ангиопротекторных свойств. Снижение протеина С коррелирует с
уровнем плазминогена в крови при инфекционно-септических состояниях [11–19].
Различные исследования показали, что подавление реакций активации протеина С
вызывает резкое увеличение продукции интерлейкина-6 и интерлейкина-8, фактора
некроза опухоли и других цитокинов и снижает толерантность организма к различным
эндотоксинам. Получены доказательства того, что протеин С не только блокирует
активацию лейкоцитов, но и регулирует активность матричных металлопротеиназ,
вызывающих деградацию экстрацеллюлярного матрикса и локальное изъязвление [18,
19, 22–26].
Предотвращение эндотелиальной дисфункции микроциркуляторного русла эффективно
используется для профилактики и лечения многих заболеваний [18, 19]. На этом
фоне роль протеина С (одного из ключевых эндотелий-зависимых антикоагулянтов) в
формировании дисфункции сосудистой стенки при роже изучена слабо.
Мы попытались восполнить имеющийся пробел, изучив динамику протеина С у
больных рожей нижних конечностей (с наличием и без наличия хронической венозной
недостаточности) в сравнении с больными рожей лица и здоровыми добровольцами для
уточнения патогенеза и определения целесообразности проведения заместительной (антитромботической)
терапии.
Пациенты и методы исследования
Обследовано 60 человек в возрасте от 25 до 71 года с диагнозом «рожа нижних
конечностей II степени тяжести» (36) и «рожа лица II степени тяжести» (24).
Эритематозная форма рожи была установлена в 33% всех наблюдений (в 52% при роже
лица), эритематозно-буллезная в 15%, эритематозно-геморрагическая в 22% и
буллезно-геморрагическая в 30% случаев. Эритематозно-геморрагическая (11
случаев) и буллезно-геморрагическая (15 случаев) рожа развивались на нижних
конечностях чаще, чем на лице (2 и 3 случая соответственно). Частота
геморрагических нарушений была достоверно выше при местном воспалительном
процессе (78%) на нижних конечностях по сравнению с лицом (20%); отношение
шансов (ОШ) = 9,9 [2,8; 34,7].
Первичная рожа лица (16 женщин, 8 мужчин) диагностирована в 92% случаев и
преобладала у женщин. При роже нижних конечностей случаи первичной рожи
регистрировались в 50%, повторной в 31% и рецидивирующей в 19%; в отличие рожи
лица: первичной (92%), повторной (4%) и рецидивирующей (4%). Риск рецидива рожи
был статистически достоверно выше при локализации воспалительного очага на ногах
по сравнению с лицом (ОШ) = 5,55 [1; 51,2], p = 0,009.
При роже нижних конечностей гендерное соотношение было сопоставимым (мужчин —
17, женщин — 19). Среди сопутствующих заболеваний обращала на себя внимание
высокая (88%) частота микозов стоп и онихомикозов. У 11 больных было ожирение от
2-й до 4-й степени, у 5 больных субкомпенсированный сахарный диабет 2-го типа.
У больных рожей лица фоновая патология в 37,5% была представлена кожными
заболеваниями (заушный дерматит, стрептодермия, псориаз) и в 29% — хронической
ЛОР-патологией (отит, тонзиллит, ринит). Сахарный диабет 2-го типа — у четырех
человек.
Пациенты находились на стационарном лечении в отделении рожи ИКБ № 2 г.
Москвы. 32 больным назначена антибактериальная монотерапия: бензилпенициллина
новокаиновая соль внутримышечно по 0,6 млн МЕ два раза в сутки (7–10 дней) и еще
двум больным — цефалоспорины (цефазолин) внутримышечно по 1 г 3 раза в сутки (5
дней). Комбинированная терапия из двух антибиотиков (бензилпенициллина
новокаиновая соль внутримышечно по 0,6 млн МЕ два раза в сутки (7–10 дней) и
Ципролет per os по 0,5 г два раза в сутки (10 дней)) проведена 14 больным. 12
человек пролечены комбинацией из трех антибиотиков (бензилпенициллина
новокаиновая соль внутримышечно по 0,6 млн МЕ два раза в сутки (7 дней) +
ципрофлоксацин внутривенно по 800 мг в сутки (3 дня) с последующим переводом на
1 г в сутки per os (10 дней) + цефазолин внутримышечно по 1 г 3 раза в сутки (5
дней)). Дополнительно пациенты получали: антигистаминные препараты (Зодак,
диазолин), местную физиотерапию и регулярную обработку рожистого очага нижних
конечностях дубящим раствором перманганата калия. Пациенты, участвующие в
исследовании, не получали лекарственные средства с направленным действием на
состояние системы гемостаза. Средний срок пребывания больных в стационаре с
рожей нижних конечностей составил 11,9 ± 4,1 дня; с рожей лица — 8,4 ± 1,6 дня.
Исследование ключевых показателей системы гемостаза проводили в начале
заболевания (1–3 день — 1-я точка), в динамике (4–6 и 7–10 день — соответственно
точки 2, 3) и в периоде реконвалесценции (11–15 дни болезни — 4-я точка
исследования). Каждому третьему больному рожей нижних конечностей проводилось
катамнестическое исследование (через 5 месяцев после выписки из стационара),
позволяющее разграничить изменения, вызванные рожей, от фона сопутствующих
заболеваний.
Контрольная группа состояла из 32 здоровых лиц в возрасте от 24 до 50 лет в
равном соотношении мужчин и женщин.
Содержание протеина С в плазме крови определяли на автоматическом
коагулометре SYSMEX CA-500 (Siemens Healthcare, США, реагенты Siemens AG,
Германия) в экспресс-лаборатории детской городской клинической больницы № 13 им.
Н. Ф. Филатова ДЗ г. Москвы совместно с врачом клинической лабораторной
диагностики Н. К. Лагутиной. Всего обработано 90 образцов плазмы.
Статистическая обработка полученных результатов проводилась с помощью
программы Statistica 10.0 for Windows 7.0. Критический уровень значимости
(достоверности) был принят как p < 0,05. В таблице результаты приведены как Mе +
s (медиана и стандартное отклонение). В случае статистически значимых различий
между группами вычислялось отношение шансов (ОШ) и 95% доверительный интервал (ДИ)
(ОШ [-95%ДИ; +95%ДИ]).
Полученные результаты
Исходные значения протеина С на 1–3 дни болезни (при поступлении) в группе
больных рожей нижних конечностей были ниже (81,9 ± 4,9%), чем у больных рожей
лица (94,1 ± 6,0%) и достоверно ниже контрольных значений (100 ± 5%, р < 0,05)
(табл. 1).
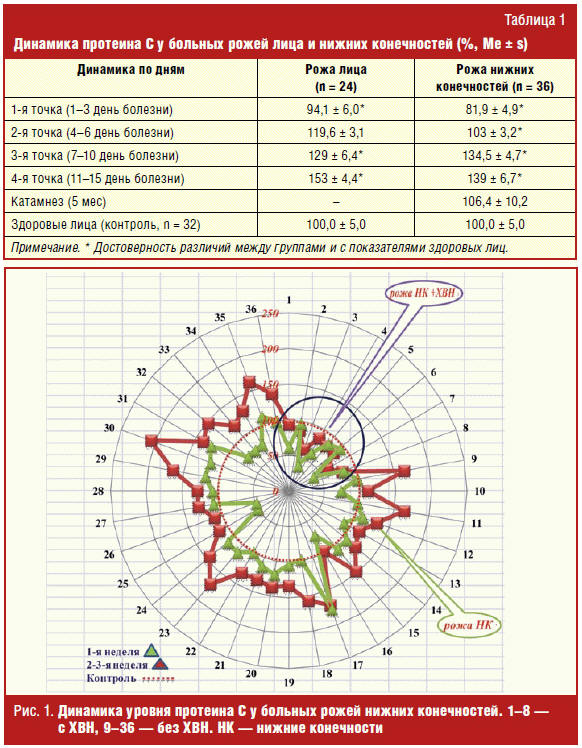
По мере угасания рожистого очага уровень протеина С постепенно
восстанавливался в обеих группах: 119,6 ± 3,1 на 4–6 день болезни, 129 ± 6,4% на
7–10 день болезни, 153 ± 4,4% на 11–15 день болезни — при роже лица (р < 0,05
между 1/4, 2/4 и 3/4 точками исследования) и 103 ± 3,2%, 134,5 ± 4,7%, 139 ±
6,7% при роже нижних конечностей (р < 0,05 между 1/4, 2/4 точками исследования).
Полученные значения протеина С логично укладывались в общую картину
эндотелиальной дисфункции микроциркуляторного русла, ранее описанную нами у
больных рожей [20, 21]. В то же время динамика протеина С у отдельных больных: с
49,7% (1-я точка исследования) до 112% (4-я точка) — прирост 125%; с 48,9% (1-я
точка) до 110,7% (4-я точка) — прирост 126%; с 65,5% (1-я точка) до 119,7% (4-я
точка) — прирост 86%, заслуживает внимания как эффективный механизм работы
факторов саногенеза в кровеносном русле в периоде реконвалесценции (рис. 2,
табл. 2).
У больных рожей нижних конечностей с сопутствующей хронической венозной
недостаточностью активность протеина С оставалась ниже нормы в течение всего
периода наблюдений (рис. 1).
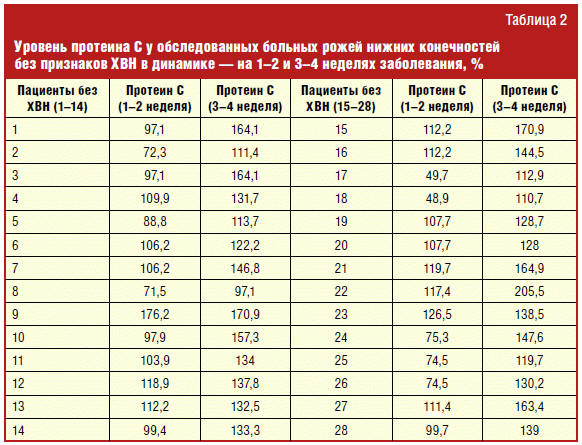
Так, у больных рожей нижних конечностей без ХВН (n = 28) уровень протеина С
был 99,8 ± 4,7% в остром периоде болезни и увеличился до 140 ± 4,5% в стадии
реконвалесценции (р < 0,001) (табл. 2). При роже нижних конечностей с ХВН
исходно низкий уровень протеина С — 69,8 ± 8,1% статистически значимо не менялся
в периоде реконвалесценции — 79,15 ± 4,0%, р = 0,21 (табл. 3). Различия были
настолько выразительными, что в публикацию включены все абсолютные значения
протеина С, полученные у больных рожей нижних конечностей с наличием (табл. 2) и
без наличия признаков ХВН (табл. 3).
Кроме того, период реконвалесценции у больных рожей нижних конечностей без
признаков ХВН (и положительной динамикой протеина С) протекал более
благоприятно, чем у больных рожей нижних конечностей с сопутствующей ХВН, что
демонстрируют два клинических наблюдения.
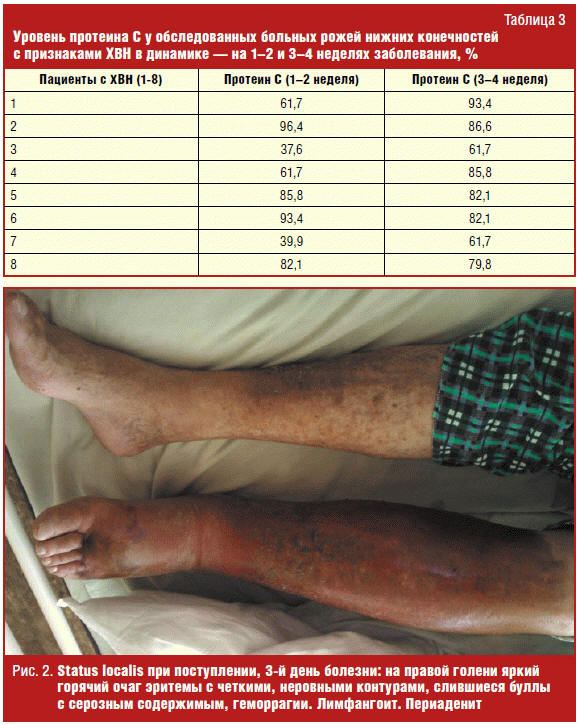
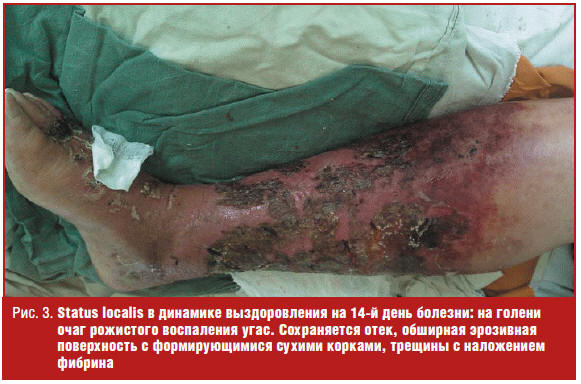
Пациент К. (71 год), диагноз «буллезно-геморрагическая рожа правой нижней
конечности, II степени тяжести, 2-й поздний рецидив, сопутствующая хроническая
лимфовенозная недостаточность». Уровень протеина С при исследовании: 37,6% на
3-й, 39,9% на 4-й, 61,7% на 9-й, 85,8% на 15-й, 93,4% на 19-й день болезни. Даже
после выписки, в катамнезе через 5 месяцев, уровень С-протеина оставался ниже
уровня здоровых лиц — 82,1%. Status localis при поступлении представлен на рис.
2, status localis в динамике выздоровления — на рис. 3.
Аналогичный по тяжести клинический случай рожи (но без признаков ХВН)
демонстрирует более благоприятное течение болезни в сочетании с восстановлением
уровня протеина С на 11-й день болезни.
Пациент К. (40 лет), диагноз «эритематозно-геморрагическая рожа левой нижней
конечности, II степени тяжести, повторная». Уровень протеина С: 74,5% на 2-й,
74,5% на 3-й, 119,7% на 11-й, 130,2% на 12-й день болезни. Клинические признаки
лимфовенозной недостаточности отсутствуют (рис. 4–5).
Восстановление протеина С до нормы наблюдалось на третьей неделе болезни при
роже лица (108,2 ± 5,1% при поступлении и 144 ± 4,6% при выписке; 1/4 точка — р
< 0,001); на 4-й неделе болезни — при роже нижних конечностей без ХВН (99,8 ±
4,7% при поступлении и 140 ± 4,4% при выписке, 1/4 точка — р < 0,001) и
отсутствовало у пациентов с рожей нижних конечностей и ХВН (69,8 ± 8,1% при
поступлении, 79,15 ± 4,07% при выписке; 1/4 точка — р = 0,21) (рис. 6).
Проведенное исследование позволило доказать, что при нормальных значениях
протеина С (100,0 ± 5,0%) шансы благоприятного течения рожи нижних конечностей
достоверно выше (ОШ = 2,89, [0,15; 55]), чем при роже нижних конечностей с
хронической венозной недостаточностью и низким уровнем протеина С.
Обсуждение и заключение
Как показали проведенные нами ранее исследования [20, 21], рожа
сопровождается развитием скрытого внутрисосудистого гемолиза и ДВС-подобного
синдрома. Исследование протеина С дополнило общую картину изменений системы
гемостаза при роже, выявив дефицит одного из важнейших естественных
антикоагулянтов.
Уровень протеина С при поступлении в группе больных рожей нижних конечностей
был ниже, чем в группе больных рожей лица, и ниже значений, полученных в группе
здоровых лиц. В периоде реконвалесценции активность эндотелий-зависимого
антикоагулянта восстанавливалась у больных рожей лица и рожей нижних
конечностей, за исключением пациентов с наличием хронической венозной
недостаточности.
Было установлено, что уровень протеина С отличается рефрактерностью к
стандартной терапии рожи у таких больных, а документально подтвержденный дефицит
протеина С сопровождается затягиванием периода реконвалесценции и удлинением
сроков стационарного лечения больных рожей нижних конечностей с признаками ХВН.
Значения протеина С только у 7 из 8 больных с ХВН возвращались к норме через 5
месяцев после перенесенной рожи.
Отсутствие положительной динамики протеина С в процессе лечения рожи и
затяжной период реконвалесценции у больных рожей нижних конечностей с
сопутствующей ХВН требуют пересмотра существующей тактики лечебных мероприятий.
Документально подтвержденный дефицит протеина С может служить показанием для
проведения заместительной терапии, начинать которую целесообразно в остром
периоде болезни [12, 13]. Согласно литературным данным эффективность
заместительной терапии зависит от уровня снижения протеина С (не ниже 50–60% от
нормы) [18, 19, 26].
Возмещение документированного дефицита протеина С при роже может быть
перспективным направлением терапии, направленной на лечение хронической венозной
недостаточности и уменьшение системного воспалительного ответа.
Литература
-
Фазылов В. Х. Состояние сосудисто-тромбоцитарного гемостаза и
коррекция его нарушений при роже. Автореф. дис. … к.м.н. Л., 1990. -
Фролов В. М. Клиника и патогенетические механизмы рецидивирующей
рожи. Автореф. дис. … к.м.н. Киев, 1986. -
Храмцов М. М. Патогенетическая и прогностическая роль факторов
межклеточных взаимоотношений при рожистом воспалении. Автореф. дис. … д.м.н.
М., 2000. -
Еровиченков А. А. Клинико-патогенетическое значение нарушений
гемостаза и их коррекция у больных геморрагической рожей. Автореф. дис. д.м.н.
М., 2003. -
Черкасов В. Л. Патогенез и лечение различных клинических форм
рожи и бициллинопрофилактика ее рецидивов. Автореф. дис. … д.м.н. М., 1977. -
Denis F., Martin C., Ploy M. C. Erysipelas: microbiological and
pathogenic data // Annales de Dermatologie et de Venereologie. 2001, v. 128; №
3, C2; 317–326. -
Фазылов В. Х. Нарушение гемостаза и иммунитета при формировании
рецидивов рожи, их терапевтическая коррекция. Автореф. дис. … д.м.н. СПб,
1996. -
Митрофанова М. Ю. Нарушения гемостаза и функции эндотелия сосудов
у больных рожей. Автореф. дис. к.м.н. М., 2010. -
Дубовикова Т. А. Нитроксидергический профиль и состояние
свертывающей системы крови при геморрагических формах рожи. Автореф. дис.
к.м.н. М., 2012. -
Ратникова Л. И., Дубовикова Т. А. Оценка состояния
сосудисто-тромбоцитарного гемостаза у больных геморрагическими формами рожи //
Журнал инфектологии. 2012. Т. 4, № 1, 53–57. -
Егорова В. В., Титова М. И., Демидова В. С. Современные
методологические аспекты лабораторной диагностики системы протеина С и
значение ее исследования в хирургии // Медицинский алфавит. Современная
лаборатория. 2013. № 3, 12–17. -
Liaw P. C. Y., Neuennschwander P. F., Smirnov M. D. Mechanisms by
wich soluble endothelial cell protein C receptor modulates protein C and
activated protein C function // J. Biol. Che. 2000, vol. 275, № 8; 5447–5452. -
Dahlback B. Resistance to activated protein C as risk factor for
thrombosis: molecular mechanism, laboratory investigation and clinical
managements // Semin in hematol. 1997, 34 (№ 3); 217–234. -
Суханов В. А. Воспалительный коагуляционный ответ как часть
синдрома системной воспалительной реакции (SIRS) // Интенсивная терапия. 2006,
№ 1; 21–23. -
Светухин А. М., Амирасланов Ю. А., Земляной А. Б. и др.
Особенности нарушений системы гемокоагуляции и их коррекция у больных с
гнойно-некротическими формами синдрома диабетической стопы // Хирургия. 2006.
№ 10; 30–34. -
Ерин Д. Н. Роль снижения уровня протеинов C, S и антитромбина III
при инфекционно-септическом ДВС-синдроме и коррекция их дефицита
криосупернатантом. Автореф. дис. к.м.н. Барнаул, 1999. -
Ена Я. М., Платонова Т. Н., Сушко Е. А. и др. Биологическая роль
и клиническое значение протеина С // Врачебное дело. 1992. № 6; 20–25. -
Климович Л. Г., Козар Е. Ф., Крайнюченко Т. В. и др.
Противовоспалительные и антикоагулянтные эффекты рекомбинантного
активированного протеина С в комплексной интенсивной терапии сепсиса у
новорожденных и грудных детей после операции на сердце / 3-я Всероссийская
конференция Клиническая гемостазиология и гемореология в сердечно-сосудистой
хирургии: материалы конференции. 2007. С. 101. -
Бокерия Л. А., Лобачева Г. В., Харькин А. В., Очаковская Е. Ю.,
Самсонова Н. Н., Климович Л. Г. Первый опыт применения рекомбинантного
активированного протеина С в комплексной интенсивной терапии сепсиса у
новорожденных и грудных детей после кардиохирургических вмешательств //
Детские болезни сердца и сосудов. 2006. № 35. С. 60–64. -
Фокина Е. Г., Рослый И. М. Лабораторная оценка рожистого
воспаления // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2014.
№ 1; 28–32. -
Фокина Е. Г. Некоторые особенности первичной рожи лица в
современных условиях // Терапевтический архив. 2014. № 11; 70–77. -
White B., Schmidt M. // Activated protein C inhibits
lipopolysacchartde-induced nuclear translocation of NFkB and TNF-alpha
production in THP-1 monocytic cell line // Br J Haematol. 2000. V. 110. P.
130–134. -
Esmon C. T., Taylor F. B. Inflammation and coagulation: Linked
processes potentialliregulated through a common pathway mediated by protein C
// Thromb Haemost. 1991. V. 66. P. 160–165. -
Esmon C. T. Role of coagulation inhibitors in inflammation //
Thromb. 2001. V. 86. P. 51–56. -
Coughlin S. R. Protease-activated receptors in vascular biology
// Thromb Haemost. 2001. V. 86. P. 298–307. -
Bernard G. R., Vincent J. L. Efficacy and safety of recombinant
human activated pritein C for severe sepsis // N Engl J Med. 2001. V. 344. P.
699–709.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru