Содержание статьи
Введение
Согласно определению Российской гастроэнтерологической ассоциации под гастроэзофагеальной рефлюксной болезнью (ГЭРБ) понимают хроническое рецидивирующее заболевание, в основе развития которого лежит нарушение моторно-эвакуаторной функции верхних отделов пищеварительного тракта, что способствует забросу содержимого желудка и/или двенадцатиперстной кишки в пищевод с развитием симптомов повреждения слизистой оболочки вплоть до эрозивно-язвенного эзофагита (рефлюкс-эзофагита) и цилиндроклеточной метаплазии [1].
В клинической практике принято выделять неэрозивную рефлюксную болезнь (НЭРБ), которая встречается в подавляющем большинстве случаев, и эрозивный эзофагит [1]. При этом необходимо подчеркнуть, что диагноз НЭРБ правомочен при наличии жалоб, вызванных патологическим рефлюксом, при наличии катарального эзофагита или без видимых эндоскопических изменений слизистой оболочки пищевода, а также не принимающих препараты из группы ингибиторов протонной помпы или Н2-гистаминоблокаторов. Отдельную проблему представляет тот факт, что при недостаточном контроле заболевания ГЭРБ ассоциирована с повышенным риском развития осложнений — пищевода Барретта и аденокарциномы пищевода.
Эпидемиологические данные последних лет свидетельствуют о неуклонной тенденции к росту частоты встречаемости ГЭРБ среди взрослого населения. Распространенность заболевания существенно варьирует в зависимости от региона и в среднем составляет около 13% [2–4]. В России частота выявления ГЭРБ, по данным отдельных эпидемиологических исследований, оценивается в 11,3–23,6% [5, 6], на долю пищевода Барретта приходится до 8% случаев ГЭРБ в популяции [7, 8].
Факторы риска ГЭРБ и механизмы их реализации
Широкая встречаемость ГЭРБ в популяции, безусловно, связана с мультифакторной природой заболевания. Все факторы риска, способствующие развитию ГЭРБ, можно разделять на модифицируемые и немодифицируемые. К модифицируемым относятся курение, избыточная масса тела и ожирение, к относительно модифицируемым — прием лекарственных препаратов, способствующих расслаблению нижнего пищеводного сфинктера (НПС), например холинолитиков, антагонистов кальция, антидепрессантов, β-адреноблокаторов, миотропных спазмолитиков, нитратов, глюкокортикостероидов, теофиллина, бисфосфонатов и др. [9]. При наличии ГЭРБ и невозможности отмены указанных препаратов целесообразно рассмотреть вопрос об изменении медикаментозной терапии с предпочтительным выбором тех средств, которые менее выраженно влияют на релаксацию НПС, моторику пищевода или затрудняющие его клиренс.
К немодифицируемым факторам риска ГЭРБ относятся мужской пол, возраст старше 50 лет и грыжа пищеводного отверстия диафрагмы (ГПОД). Кроме того, беременность является физиологическим фактором, предрасполагающим к развитию ГЭРБ.
По данным метаанализа L.H. Eusebi et al. [2], объединившего данные 102 исследований (более 460 тыс. участников), факторами риска ГЭРБ являются возраст старше 50 лет (отношение шансов (ОШ) 1,32, 95% ДИ 1,12–1,54), курение (ОШ 1,26, 95% ДИ 1,04–1,52), прием нестероидных противовоспалительных препаратов или аспирина (ОШ 1,44, 95% ДИ 1,10–1,88) и наличие ожирения (ОШ 1,73, 95% ДИ 1,46–2,06).
Интересно, что в Северной Америке и Европе не обнаружено связи между полом и симптомами ГЭРБ, тогда как в Южной Америке и на Ближнем Востоке женщины примерно на 40% чаще сообщают о симптомах заболевания [2]. Однако у мужчин в 1,57 (95% ДИ 1,40–1,76) раза чаще выявляется эрозивный эзофагит, пищевод Барретта и развивающаяся на его фоне аденокарцинома пищевода [10].
Возраст старше 50 лет тесно ассоциирован не только с наличием ГЭРБ, но и с осложненным течением заболевания, высокой частотой госпитализаций по поводу эрозивного эзофагита и стриктур пищевода [2, 11]. Примечательно, что в конце 1980-х годов зрелый и пожилой возраст не были связаны с развитием эрозивного эзофагита [12]. Подобный феномен, по мнению экспертов, может быть объяснен так называемым когортным эффектом, при котором люди, рожденные в более раннем поколении, менее склонны к развитию заболевания, чем их потомки, когда они достигают того же возраста [13]. Такой когортный эффект, скорее всего, связан с изменениями воздействия факторов окружающей среды, прежде всего с увеличением в популяции числа лиц с избыточной массой тела и ожирением.
Ожирение является основным модифицируемым фактором риска ГЭРБ [2]. При этом важно подчеркнуть, что ключевую роль в реализации заболевания при ожирении имеет не сам факт наличия последнего, а характер распределения жировой клетчатки. Абдоминальное ожирение кажется более важным, чем ожирение в целом, поскольку симптомы ГЭРБ и эрозивный эзофагит положительно связаны с абдоминальным ожирением независимо от индекса массы тела (ИМТ) [14]. Так, по данным S. Singh et al. [15], абдоминальное ожирение увеличивает риск эрозивного эзофагита (ОШ 1,87, 95% ДИ 1,51–2,31), пищевода Барретта (ОШ 1,98, 95% ДИ 1,52–2,31) и аденокарциномы пищевода (ОШ 2,51, 95% ДИ 1,54–4,06).
Механизмы, посредством которых висцеральная жировая ткань способствует формированию патологических рефлюксов, не ограничиваются только механическим воздействием (повышение внутрибрюшного давления, формирование ГПОД), но также включают повышенный синтез адипоцитами различных гормонов и цитокинов с провоспалительным потенциалом, что в конечном итоге приводит к снижению экспрессии белков плотных контактов в слизистой оболочке пищевода и снижению ее устойчивости к воздействию агрессивных молекул рефлюктата [16]. Несколько исследований выявили положительную корреляцию между уровнем адипокина жировой ткани лептина и тяжестью симптомов ГЭРБ, эрозивным эзофагитом [16, 17]. Кроме того, у пациентов с абдоминальным ожирением независимо от ИМТ описано увеличение в области гастроэзофагеального перехода площади метаболически активного жира, оказывающего паракринный эффект [18].
Установлены также положительные корреляционные связи уровня лептина в сыворотке крови с показателями кислотности в кардиальном отделе и теле желудка: разбросом, индексом агрессивности и максимальным значением рН, с показателем времени рН>8 в пищеводе [19]. Очевидно, что наличие ожирения является фактором формирования некислотных рефлюксов, и это может быть связано с наличием сопутствующей патологии гепатобилиарного тракта в условиях метаболических нарушений [20, 21]. В целом ряде работ сообщается о связи ГЭРБ с неалкогольной жировой болезнью печени (НАЖБП) и желчнокаменной болезнью (ЖКБ) [22–25]. Хорошо известно, что у пациентов с НАЖБП ухудшение свойств желчи за счет изменения в ней соотношения холестерина, муцина и желчных кислот, а также нарушения моторики пищеварительного тракта способствуют риску развития дуоденогастроэзофагеального рефлюкса (ДГЭР) [23, 26]. Кроме того, у пациентов с ЖКБ, в том числе в период после холецистэктомии, отмечается повышенная секреция холецистокинина в ответ на прием пищи, что является фактором, участвующим в расслаблении НПС и, вероятно, повышенной частоте патологического рефлюкса [27]. Сообщается, что смешанный характер рефлюктата отмечается у 1/4 больных с ГЭРБ [28].
Еще одним предполагаемым механизмом развития ГЭРБ у пациентов с ожирением являются нарушения диеты. Чрезмерное потребление жира способствует секреции таких гормонов, как секретин и холецистокинин, которые, в свою очередь, стимулируют расслабление НПС [29]. Исследование, проведенное M. Fox et al. [30], продемонстрировало повышенную частоту и длительность патологических рефлюксов у пациентов, придерживающихся диеты с высоким содержанием жиров.
Механизмы формирования патологического рефлюкса при ГЭРБ
Ключевым фактором патогенеза ГЭРБ является стойкое нарушение моторики пищевода и/или желудка с формированием патологических рефлюксов содержимого из нижележащих отделов в дистальный отдел пищевода [31].
К основным механизмам формирования патологического рефлюкса относятся:
Недостаточность антирефлюксного барьера в результате снижения давления в НПС, увеличения частоты эпизодов его спонтанной релаксации, нарушения анатомической структуры НПС при ГПОД [32, 33].
При ГПОД НПС перемещается из зоны высокого внутрибрюшного в зону низкого внутригрудного давления, происходит разобщение внутреннего и наружного компонентов антирефлюксного барьера, что нарушает его нормальное функционирование. При ГПОД страдает пищеводный клиренс, увеличивается частота транзиторных расслаблений НПС, происходит формирование «кислотного кармана» [34].
Ухудшение клиренса пищевода вследствие ослабления его перистальтики, уменьшения секреции слюны, бикарбонатов и муцина пищеводной слизи.
Нарушение моторно-эвакуаторной функции желудка, которая характеризуется ухудшением его аккомодации и антродуоденальной дискоординацией, создающими условия для ДГЭР, в состав которого входят детергенты (токсичные желчные кислоты, лизолецитин и трипсин), отягощающие течение ГЭРБ и повышающие риск формирования эрозивного эзофагита и пищевода Барретта [35]. Известно, что замедление эвакуации желудочного содержимого вследствие затруднения расслабления фундального отдела желудка ассоциировано с учащением эпизодов спонтанной релаксации НПС, с этим связывают высокую частоту перекреста ГЭРБ с функциональной диспепсией (ФД) [36].
Наличие феномена висцеральной гиперчувствительности у части пациентов, который вносит свой вклад в развитие моторных нарушений, что также объясняет перекрест ГЭРБ с функциональными расстройствами пищеварительного тракта.
Подходы к диагностике ГЭРБ
Диагноз ГЭРБ устанавливается на основании характерных жалоб, данных анамнеза и результатов инструментального обследования (обнаружение рефлюкс-эзофагита при эндоскопическом исследовании, патологического рефлюкса при рН-метрии и рН-импедансометрии, моторных нарушений при манометрии высокого разрешения).
Типичными клиническими проявлениями ГЭРБ являются изжога и регургитация кислым. Среди других симптомов могут встречаться одинофагия (боль по ходу пищевода при глотании) и эзофагодиния (боль по ходу пищевода без связи с приемом пищи). При указании пациентом на наличие у него затруднений при глотании (дисфагия) необходимо безотлагательно направить пациента на рентгеноскопию пищевода с целью оценки его проходимости и исключения грубой органической патологии (стеноз, стриктура, злокачественное новообразование) [1, 37]. Отдельную проблему в клинической практике представляют внепищеводные симптомы ГЭРБ или так называемые маски заболевания (кардиологическая, оториноларингологическая, пульмонологическая, стоматологическая), которые затрудняют проведение дифференциальной диагностики и увеличивают время постановки диагноза, а следовательно, и начала терапии [1, 37–39].
Все пациенты с симптомами ГЭРБ при первичной постановке диагноза обязательно должны быть направлены на эзофагогастродуоденоскопию [1, 36]. При этом, согласно Лионскому консенсусу, убедительными доказательствами ГЭРБ по результатам эндоскопии является лишь обнаружение эзофагита высокой степени (степени C или D по Лос-Анджелесской классификации), длинного сегмента пищевода Барретта или пептической стриктуры [40]. В консенсусе акцентируется внимание на том, что эталонными методами диагностики ГЭРБ являются методы исследования, подтверждающие наличие патологического рефлюкса (табл. 1), в частности, pH-импедансометрия, которая позволяет зафиксировать различные рефлюксы (жидкие, газообразные и смешанные), независимо от их кислотности. Также для выявления двигательных расстройств пищевода Лионский консенсус рекомендует оценивать показатели манометрии высокого разрешения с провокационным тестом (пять глотков воды по 2 мл с интервалом <4 с) [40]. Следует отметить, что в соответствии с отечественными клиническими рекомендациями пересмотр диагноза с применением спектра дополнительных тестов, описанных выше, необходим при отсутствии ответа на проводимую терапию ИПП в течение 4–8 нед. [1].
![Таблица 1. Интерпретация инструментальных методов диагностики ГЭРБ [40] Table 1. Interpretation of oesophageal test results in the context of GERD [40] Таблица 1. Интерпретация инструментальных методов диагностики ГЭРБ [40] Table 1. Interpretation of oesophageal test results in the context of GERD [40]](https://medblog.su/wp-content/uploads/2023/07/Prokinetiki-rol-v-terapii-bolnogo-GERB-Livzan-MA-Bordin.png)
Принципы коррекции моторных нарушений у пациентов с ГЭРБ
Цели лечения пациентов с ГЭРБ включают полное устранение клинических проявлений заболевания, заживление эрозивно-язвенных повреждений слизистой оболочки пищевода и предотвращение формирования пищевода Барретта и аденокарциномы пищевода [1].
Важная роль немедикаментозной терапии в курации пациентов с ГЭРБ подчеркивается во всех международных руководствах и клинических рекомендациях [1, 41, 42]. Мероприятия по немедикаментозной коррекции включают нормализацию режима питания (5–6-разовое питание, исключение длительных интервалов между приемами пищи и поздних приемов пищи, небольшой объем порций), выявление и ограничение в рационе продуктов-триггеров, исключение интенсивных физических нагрузок и работы в наклон, сон с приподнятым головным концом кровати, по возможности — отмену лекарственных препаратов, снижающих тонус НПС. Пациент в обязательном порядке должен быть проинформирован о необходимости отказа от курения. Крайне важным условием, с точки зрения достижения эффективного контроля над симптомами ГЭРБ, является нормализация массы тела. Исследования демонстрируют, что снижение ИМТ по крайней мере на 3,5 кг/м2 улучшает контроль над симптомами ГЭРБ в 1,5–2,4 раза [15]. Потеря веса сопровождалась уменьшением времени воздействия кислоты на пищевод в 2 рандомизированных клинических исследованиях (с 5,6 до 3,7% и с 8,0 до 5,5% соответственно) [43, 44].
Несмотря на то, что ГЭРБ является заболеванием, в основе которого первично лежит нарушение моторики гастроэзофагеальной зоны, стандартом медикаментозной терапии является подавление кислотопродукции желудка. Назначение ИПП в стандартной дозировке уменьшает скорость секреции соляной кислоты и объем желудочного сока и позволяет снизить повреждающий потенциал рефлюктата [45]. Однако полный ответ на терапию ИПП, в соответствии с данными проведенного метаанализа, наблюдается не более чем в 80% случаев [46], что требует оценки приверженности пациента, состава рефлюктата (смешанный или щелочной) и перехода на комбинированные схемы (в составе комплексной терапии с ИПП), включающие: антациды, эзофагопротекторы, прокинетики, урсодезоксихолевую кислоту, ребамипид [1].
В данной обзорной статье особое внимание уделено принципам коррекции моторных нарушений у пациентов с ГЭРБ.
Систематические обзоры и метаанализы демонстрируют, что терапия ИПП совместно с прокинетиком более эффективна, чем монотерапия ИПП [47], так как повышение тонуса НПС и нормализация моторики органов гастроэзофагеальной зоны являются важными целями патогенетической терапии ГЭРБ как при кислотных, так и при смешанных рефлюксах [48]. К особым группам пациентов следует отнести лиц с ДГЭР, с синдромом перекреста с ФД, длительным приемом ИПП [49]. Последнее связывают с тем, что ИПП тормозят моторно-эвакуаторную функцию желудка вследствие ингибирования кислотозависимого пептического гидролиза пищевого комка на фоне подавления продукции соляной кислоты и компенсаторной гипергастринемии. С этих позиций включение прокинетиков в схему лечения пациентов дополнительно к антисекреторной терапии является патогенетически оправданным и позволяет нивелировать указанные нарушения моторики [50].
Несмотря на то, что многие исследования убедительно продемонстрировали клиническое улучшение симптомов ГЭРБ и уменьшение частоты эпизодов патологического рефлюкса при добавлении прокинетиков к стандартной терапии ИПП [51–54], между экспертами все еще есть некоторые противоречия в отношении целесообразности назначения прокинетиков при ГЭРБ [52, 53, 55]. Одобренные к применению для лечения ГЭРБ прокинетики, в соответствии с рекомендациями международных профильных гастроэнтерологических сообществ, представлены в таблице 2.
![Таблица 2. Прокинетики, одобренные для лечения ГЭРБ, в соответствии с рекомендациями международных профиль- ных гастроэнтерологических сообществ [1, 41, 56–60] Table 2. Prokinetics approved for the treatment of GERD, in accordance with the recommendations Таблица 2. Прокинетики, одобренные для лечения ГЭРБ, в соответствии с рекомендациями международных профиль- ных гастроэнтерологических сообществ [1, 41, 56–60] Table 2. Prokinetics approved for the treatment of GERD, in accordance with the recommendations](https://medblog.su/wp-content/uploads/2023/07/1689110517_241_Prokinetiki-rol-v-terapii-bolnogo-GERB-Livzan-MA-Bordin.png)
Прокинетики являются фармакологической группой, которая усиливает и координирует мышечные сокращения пищеварительного тракта, включая координацию между различными сегментами кишечника, тем самым усиливая движение внутрипросветного содержимого [61]. Патогенетические мишени терапии прокинетиком в условиях ГЭРБ представлены на рисунке.
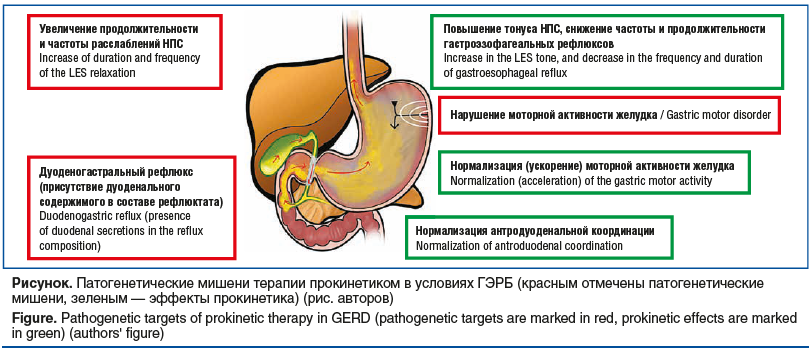
Среди прокинетиков выделяют две основные группы: антагонисты (блокаторы) D2-рецепторов дофамина (метоклопрамид, домперидон, итоприд) и агонисты (активаторы) 5-НТ4-рецепторов серотонина (цизаприд, мозаприд, прукалоприд, тегасерод, велусетраг). Блокируя D2-рецепторы и активируя 5-НТ4-рецепторы, прокинетики приводят к высвобождению ацетилхолина из окончаний холин-ергических двигательных нейронов нервных сплетений, расположенных в стенке желудка и двенадцатиперстной кишки. Возникающее возбуждение М3-холинергических рецепторов на мышечных клетках способствует усилению моторики пищевода и желудка.
В настоящее время спектр лекарственных препаратов, обладающих прокинетическим действием, заметно расширился (табл. 3). Рекомендованы к применению, находятся на стадии клинических испытаний или обладают известным прокинетическим эффектом такие молекулы, как акотиамид, буспирон, эритромицин, азитромицин, митемцинал (производное эритромицина), левосульпирид, миртазапин, камицинал, цинитаприд, реламорелин (RM-131), улеморелин, ботулинический токсин и др. [62].
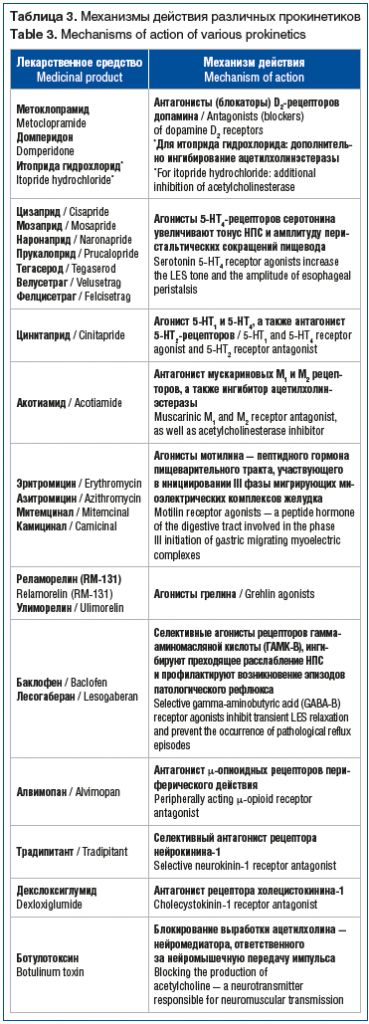
Остановимся на характеристике отдельных лекарственных препаратов с прокинетическим действием, зарегистрированных на территории Российской Федерации. Первыми представителями препаратов из группы прокинетиков являются метоклопрамид и домперидон. Антидофаминергическое действие метоклопрамида и домперидона обеспечивает целый спектр прокинетических эффектов, включая нормализацию тонуса НПС и моторной активности органов гастродуоденальной зоны. При этом необходимо отметить, что способность метоклопрамида блокировать дофаминовые рецепторы в центральной нервной системе сопряжена с развитием таких побочных эффектов, как головная боль, головокружение, сонливость, беспокойство, экстрапирамидные расстройства, депрессия, что лимитирует курсовое применение препарата в клинической практике. Кроме того, антидофаминергические препараты из группы прокинетиков при длительном приеме могут приводить к развитию гиперпролактинемии, галактореи и гинекомастии, что также ограничивает их длительное назначение [45, 63].
По результатам клинических исследований домперидон был связан с сердечными аритмиями из-за его способности блокировать калиевые каналы проводящей системы миокарда, что привело к внесению в инструкции к препарату рекомендации по ограничению длительности его приема. Кроме того, Европейская фармакопея перевела препарат из статуса «безрецептурный» в статус «отпускается по рецепту врача». По сравнению с метоклопрамидом домперидон имеет более низкий риск сердечно-сосудистых событий в целом при назначении его менее 30 мг/сут, такая дозировка не вызывает удлинения интервала QT, согласно метаанализу профиля сердечной безопасности препарата в 2018 г. [64], но рекомендуется избегать назначения домперидона, если корригированный интервал QT на электрокардиограмме пациента составляет >470 мс у мужчин и >450 мс у женщин [61]. Кроме того, сообщается, что следует соблюдать осторожность при одновременном назначении домперидона с агентами, которые изменяют или метаболизируются цитохромом Р450 (CYP) 3A4 (например, эритромицин), поскольку лекарственные взаимодействия могут быть связаны с риском внезапной сердечно-сосудистой смерти [65].
Необходимо отметить, что в национальных рекомендациях по диагностике и лечению ГЭРБ [1, 66] в качестве препарата выбора из группы прокинетиков рекомендовано назначение итоприда гидрохлорида, который помимо блокирования D2-рецепторов ингибирует фермент ацетилхолинэстеразу, регулирующую выработку ацетилхолина, который усиливает прокинетическое действие препарата. Результаты пилотного исследования [67] показывают, что прием итоприда гидрохлорида в дозировке 150 мг/сут на протяжении 4 нед. существенно уменьшает частоту патологических рефлюксов и облегчает симптомы ГЭРБ без каких-либо клинически значимых побочных эффектов.
При использовании итоприда гидрохлорида (Ганатон®) в составе комбинированной терапии с ИПП при ГЭРБ обнаружено, что он достоверно повышает тонус НПС и стимулирует моторно-эвакуаторную функцию желудка, улучшает его аккомодацию [48, 68]. Итоприда гидрохлорид в комбинации с ИПП показал свою эффективность и в лечении внепищеводных проявлений ГЭРБ [69].
Высокий профиль безопасности итоприда гидро-хлорида также был отмечен экспертами Римского фонда по изучению функциональных гастроинтестинальных расстройств в отношении терапии ФД. При этом эффективность препарата доказана не только при лечении постпрандиального дистресс-синдрома [70], но и при лечении эпигастральной боли и смешанного варианта диспепсии вне зависимости от механизма ее возникновения. Положительное влияние прокинетиков на симптомы различных клинических вариантов диспепсии подтверждено в ряде метаанализов и систематических обзоров [71, 72]. Так, по данным двух крупных метаанализов, терапия препаратом итоприда гидрохлорида сопровождалась более выраженным купированием симптомов диспепсии по сравнению с другими прокинетиками [70, 72], при этом частота нежелательных явлений при приеме итоприда гидрохлорида была сопоставима с таковой в группе плацебо [73, 74]. В многоцентровом рандомизированном плацебо-контролируемом исследовании G. Holtmann et al. [74] с участием 523 пациентов с ФД итоприда гидрохлорид не увеличивал длительность интервала QT даже при применении увеличенных в 3 раза дозировок в течение 8 нед. Важно подчеркнуть, что все упомянутые исследования проведены на оригинальном препарате итоприда гидрохлорида (Ганатон®) и экстраполировать их результаты на воспроизведенные препараты итоприда гидрохлорида не представляется возможным.
Заключение
Согласно современным представлениям ключевое место в формировании и персистенции симптомов ГЭРБ отводится нарушениям моторики пищевода и желудка, которые приводят к ретроградным забросам содержимого желудка (а у части пациентов — и двенадцатиперстной кишки) в дистальный отдел пищевода. Указанный факт обосновывает целесообразность добавления прокинетиков в схемы терапии ГЭРБ дополнительно к ИПП, прежде всего при наличии ДГЭР, а также при сочетанном течении ГЭРБ и ФД.
В качестве препарата выбора из группы прокинетиков, учитывая доказанную эффективность и высокий профиль безопасности, оптимально рекомендовать назначение итоприда гидрохлорида.
Сведения об авторах:
Ливзан Мария Анатольевна — д.м.н., профессор, член-корреспондент РАН, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор ФГБОУ
ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017.
Гаус Ольга Владимировна — к.м.н., доцент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9370-4768.
Бордин Дмитрий Станиславович — д.м.н., заведующий отделом патологии поджелудочной железы, желчных путей и верхних отделов пищеварительного тракта ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86, стр. 6; профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1; профессор кафедры общей врачебной практики и семейной медицины ФГБОУ ВО Тверской ГМУ Минздрава России; 170100, Россия, г. Тверь, ул. Советская, д. 4; ORCID iD 0000-0003-2815-3992.
Лисовский Максим Андреевич — ординатор кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9674-0545.
Контактная информация: Гаус Ольга Владимировна, e-mail: gaus_olga@bk.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.03.2023.
Поступила после рецензирования 05.04.2023.
Принята в печать 26.04.2023.
About the authors:
Maria A. Livzan — Dr. Sc. (Med.), Professor, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Faculty Therapy and Gastroenterology, rector, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Olga V. Gaus — C. Sc. (Med.), Assistant Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9370-4768.
Dmitry S. Bordin — Dr. Sc. (Med.), Head of the Department of Pathology of the Pancreas, Biliary Tract and Upper Digestive Tract, A.S. Loginov Moscow Clinical Research Center; 86, bldg. 6, Entuziastov Road, Moscow, 111123, Russian Federation; Professor of the Department of Propaedeutics of Internal Medicine and Gastroenterology, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, bldg. 1, Delegatskaya str., Moscow, 127473, Russian Federation; Professor of the Department of General Medical Practice and Family Medicine, Tver State Medical University; 4, Sovetskaya Str., Tver, 170100, Russian Federation; ORCID iD 0000-0003-2815-3992.
Maxim M. Lisovskiy — resident of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9674-0545.
Contact information: Olga V. Gaus, e-mail: gaus_olga@bk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 15.03.2023.
Revised 05.04.2023.
Accepted 26.04.2023.
Информация с rmj.ru






