Проблемы комбинированной терапии у больных сахарным диабетом и сердечной недостаточностью: гипогликемии
Ан. А. Александров, доктор медицинских наук, профессор
И. И. Чукаева*, доктор медицинских наук, профессор
О. А. Шацкая**, кандидат медицинских наук
С. С. Кухаренко**, кандидат медицинских наук
Е. Н. Дроздова**
М. Н. Ядрихинская**, кандидат медицинских наук
*РГМУ, **ФГУ Эндокринологический научный центр Минздравсоцразвития, Москва
Анализ больших клинических исследований, посвященных применению ингибиторов ангиотензинпревращающего фермента (АПФ) у больных с застойной сердечной недостаточностью, свидетельствует о частом сочетании сахарного диабета и недостаточности кровообращения. Пропорция больных сахарным диабетом среди лиц с застойной сердечной недостаточностью в исследовании CONSENSUS cоставляла 23% [1], в исследовании SOLVD — 25% [2], а в исследовании V-HeFT II — 20% [3]. В исследовании ATLAS [4] больные сахарным диабетом также составляли 20% от всех обследованных больных с застойной сердечной недостаточностью.
Так как эти исследования проводились на специально отобранной популяции, их данные необходимо интерпретировать с определенной осторожностью. В исследовании NETWORK, специально спланированном для оценки популяции больных с застойной недостаточностью кровообращения, больные сахарным диабетом составили 10% [5].
В то же время в исследовании RESOLVD количество больных сахарным диабетом составило среди больных недостаточностью кровообращения 35% [6]. В этом исследовании, как и ранее в исследовании SOLVD, было показано, что диабет является независимым предиктором инвалидизации и смертности как при клинически явной, так и при бессимптомной застойной сердечной недостаточности [6, 7].
Фрамингемское исследование было первым эпидемиологическим исследованием, доказавшим нарастание риска застойной сердечной недостаточности у больных сахарным диабетом. По сравнению с мужчинами и женщинами, не страдающими сахарным диабетом, у молодых мужчин с сахарным диабетом недостаточность кровообращения обнаруживалась в 4 раза чаще, а у женщин с сахарным диабетом — в 8 раз чаще [8].
В популяционных исследованиях пожилых больных было обнаружено, что сахарный диабет является независимым фактором риска развития недостаточности кровообращения и что этот риск возрастает при увеличении тяжести заболевания. Многофакторный анализ показал, что увеличение в крови концентрации HbA1c увеличивает риск развития застойной сердечной недостаточности на 15% [9]. Большая подверженность диабетических больных развитию недостаточности кровообращения, как считают, связана с более частым развитием у них ишемической болезни сердца с выраженным снижением резерва коронарного кровотока вследствие развития диабетической микроангиопатии [10], со специфическим диабетически обусловленным поражением миокарда [11] и обусловленной ею диастолической дисфунцией [12], а также с развитием диабетической автономной кардиальной дисфункции [13].
Существенный, независимый от степени имеющихся сосудистых поражений, вклад в злокачественное развитие застойной сердечной недостаточности вносят характерные для сахарного диабета сопутствующие гормонально-метаболические нарушения. Повышенная активность симпатической нервной системы, отмечаемая при сахарном диабете, резко возрастает при присоединении застойной сердечной недостаточности, усугубляя течение обоих заболеваний и ускоряя развитие тяжелых фатальных осложнений [14–17].
Рекомендации Европейского общества кардиологов и Европейского общества по изучению диабета 2007 года подчеркивают, что применение бета-адреноблокаторов и ингибиторов АПФ (иАПФ) является основой лечения хронической сердечной недостаточности (ХСН) у больных сахарным диабетом (табл. 1) [18].

Необходимо отметить, что впервые в подобных официальных рекомендациях внимание врачей привлекается к факту возможности увеличения риска развития гипогликемических состояний при назначении больным сахарным диабетом препаратов группы иАПФ. Значимость этого связана с тем, что в последние несколько лет на основании результатов ряда широкомасштабных исследований достоверно доказано, что гипогликемии являются независимым фактором риска смертности у больных с поражением сердечно-сосудистой системы.
В вышеуказанных международных рекомендациях 2007 года подчеркивается настоятельная необходимость тщательного мониторирования уровня глюкозы крови при назначении АПФ-ингибиторов больным сахарным диабетом, особенно в начальный период сочетанной кардиальной и сахароснижающей терапии.
Риск развития гипогликемий при этом зависит от многих факторов и, по-видимому, не одинаков у различных контингентов больных сахарным диабетом. По имеющимся данным больные с сердечной недостаточностью имеют повышенную склонность к гипогликемиям из-за уменьшения компенсаторных способностей организма противостоять снижению уровня глюкозы в крови. Подобная функциональная недостаточность во многом определяется нарушением процессов глюконеогенеза в печени и секреции глюкагона поджелудочной железой, которые в норме включены в систему защиты организма от выраженного снижения глюкозы в крови.
Потенциальная опасность гипогликемий у больных сахарным диабетом с сердечной недостаточностью, получающих АПФ-ингибиторы, может возрастать при добавлении к терапии бета-адреноблокаторов.
Во-первых, бета-адреноблокаторы затрудняют своевременную диагностику гипогликемий и, как следствие, затрудняют ее купирование. Это связано с тем, что бета-адреноблокаторы подавляют клинические симптомы гипогликемии. Подобное действие более выражено у неселективных, чем у селективных бета-адреноблокаторов.
Во-вторых, неселективные бета-адреноблокаторы способны препятствовать воздействию катехоламинов на бета2-адренорецепторы, которые отвечают за стимуляцию глюконеогенеза и гликогенолиза в печени у больных с сердечной недостаточностью, таким образом, уменьшая поступление глюкозы из печени в кровяное русло.
Кроме того, использование бета-адреноблокаторов при сахарном диабете связано с рядом других нежелательных эффектов на показатели углеводного обмена. Так, ухудшение компенсации углеводного обмена происходит вследствие снижения секреции инсулина, уменьшения периферического инсулинозависимого захвата глюкозы, повышения инсулинорезистентности.
Тем не менее, согласно данным клинических исследований, применение бета-адреноблокаторов у больных сахарным диабетом при недостаточности кровообращения, как правило, улучшает прогноз больных, уменьшает клинические проявления сердечной недостаточности и улучшает качество жизни больных.
Анализ подгрупп больных сахарным диабетом, входящих в большие многоцентровые исследования недостаточности кровообращения, показывает, что бета-блокаторы снижают смертность и облегчают симптоматику умеренной и тяжелой недостаточности кровообращения в той же степени, как и у больных без диабета. На основании результатов многоцентровых клинических исследований следующие бета-блокаторы рекомендованы для лечения больных сахарным диабетом с недостаточностью кровообращения: метопролол (исследование MERIT-HF, 2000 год), бисопролол (исследование CIBIS II, 1999 год), карведилол (исследования COPERNICUS, 2001 год и COMET, 2003 год) [19–23].
Применение метопролола липорастворимого бета1-селективного блокатора адренорецепторов, без внутренней симпатической активности и вазодилятирующих свойств, в исследовании MERIT-HF у 3991 больного с застойной сердечной недостаточностью II–IV cтепени тяжести по NYHA привело к достоверному снижению смертности на 34%.
Использование 1,25–10 мг бисопролола, липо- и гидрорастворимого бета1-селективного блокатора адренорецепторов, без внутренней симпатической активности и вазодилятирующих свойств, в исследовании CIBIS II у 2647 больных с застойной сердечной недостаточностью III–IV cтепени тяжести по NYHA также привело к 34% снижению смертности.
Исследование COPERNICUS было первым рандомизированным, плацебо-контролируемым исследованием, которое продемонстрировало существенные преимущества бета-блокады карведилолом у больных с тяжелой ХСН. В исследование вошли 2283 больных со стабильным течением тяжелой ХСН, с фракцией выброса < 25%. Карведилол, липорастворимый неселективный бета-блокатор адренорецепторов с альфа1-блокирующей активностью, без внутренней симпатической активности, с вазодилятирующими свойствами, применялся на фоне оптимизированной стандартной терапии ингибиторами АПФ, диуретиками и, во многих случаях, препаратами наперстянки. Исследование было прервано преждевременно в марте 2000 года, так как было обнаружено высокодостоверное улучшение выживаемости в группе, получавшей карведилол. Общая смертность в группе карведилола достоверно высоко снижалась на 35% (р < 0,00013). В настоящее время именно карведилол является препаратом выбора у больных сахарным диабетом с тяжелой застойной ХСН.
В связи с этим неудивительно, что рекомендации 2007 года подчеркивают необходимость использования бета-блокаторов на фоне терапии АПФ-ингибиторами у больных сахарным диабетом с явлениями сердечной недостаточности.
При этом препаратом выбора является карведилол. Наличие у карведилола свойств неселективного бета-адреноблокатора делает вполне оправданным опасения, что его применение может сопровождаться увеличением риска развития декомпенсации углеводного обмена у больных сахарным диабетом и в то же время затруднять своевременную диагностику гипогликемических состояний, вероятность развития которых у больных с выраженной застойной сердечной недостаточностью, получающих сахароснижающие препараты, особенно высока.
Кроме того, использование препарата с альфа-адреноблокирующей активностью сопровождается, как правило, увеличением периферического кровотока, ведущим к увеличению доставки глюкозы к периферическим тканям, усилением ее тканевого потребления и снижением в связи с этим проявлений их инсулинорезистентности. При этом увеличение периферического кровотока у больных с недостаточностью кровообращения и сниженной фракцией выброса левого желудочка неизбежно приведет к снижению фракции церебрального кровотока, ухудшит доставку глюкозы к его центрам, регулирующим компенсаторные реакции организма на гипогликемию, чем еще более обострит опасность ее неблагоприятных сердечно-сосудистых последствий.
Вот почему вполне уместно ожидать, что применение неселективного бета-адреноблокатора с добавочной альфа-адреноблокирующей активностью в условиях повышенного риска развития гипогликемических состояний (недостаточность кровообращения, сахароснижающая терапия и прием АПФ-ингибиторов) может реально повысить риск развития гипогликемий и их неблагоприятных исходов у больных сахарным диабетом и реально снизить число больных с застойной сердечной недостаточностью, получающих пользу от применения данного препарата.
К сожалению, адекватные сведения о влиянии карведилола на частоту развития гипогликемий у больных сахарным диабетом с выраженной сердечной недостаточностью практически отсутствуют.
Для оценки безопасности применения карведилола у больных сахарным диабетом 2-го типа с сердечной недостаточностью, получающих терапию АПФ-ингибиторами, мы обследовали 13 больных сахарным диабетом 2-го типа с сердечной недостаточностью, обусловленной наличием ишемической болезни сердца. Критерием включения было наличие у больных фракции выброса левого желудочка менее 45% и наличие клинических признаков сердечной недостаточности: снижение толерантности к физической нагрузке, одышки при физической нагрузке, жесткого дыхания в легких при аускультации и отеков нижних конечностей.
Группа состояла из 10 мужчин и 3 женщин, возраст которых колебался от 51 до 70 лет, средний возраст — 59,8 ± 6,7 года. Гипертоническая болезнь II–III ст. отмечалась у 10 больных. У 3 больных подъем артериального давления был связан с наличием у них диабетической нефропатии. Ни у одного из больных не было выявлено признаков почечной недостаточности. Среди обследованных больных ожирение было отмечено у 10 больных (ожирение I ст. — 8 человек, II ст. — 2 человека). Все больные до включения в исследование получали АПФ-ингибиторы (периндоприл — 2 человека и эналаприл — 11 человек) и бета-адреноблокаторы (атенолол — 9 человек, метопролол — 3 человека, бисопролол — 1 человек). Терапия пероральными сахароснижающими препаратами проводилась у 2 больных (сульфаниламиды — у 1 человека, бигуаниды + сульфаниламиды — у 1 человека). 7 человек находились на инсулинотерапии, комбинированную терапию (пероральные сахароснижающие препараты (ПССП) + инсулинотерапия) получали 4 человека. Средний уровень гликемии при включении в исследование составил — 7,1 ± 2,1 ммоль/л, гликозилированный гемоглобин — 8,4 ± 1,4%. Анамнез гипогликемий отмечался у 4 больных. Ни у одного из больного не было анамнеза тяжелых гипогликемий, послуживших причиной их госпитализации или экстренной помощи со стороны третьих лиц.
Исследование состояло из трех этапов наблюдения: 1-го этапа исходного обследования при включении; 2-го этапа повторного обследования после замены исходного бета-адреноблокатора на карведилол, средняя продолжительность терапии — 62,0 ± 17,4 дня, средняя доза карведилола — 25 ± 12,5 мг/сутки, и 3-го этапа заключительного обследования после отмены карведилола и возвращения к исходной терапии (средняя продолжительность — 56,5 ± 21,8 дня).
Каждое из обследований включало в себя: непрерывный мониторинг глюкозы системой CGMS Gold, Medtronic MiniMed USA; определение уровня гликозилированного гемоглобина (HbA1c); эхокардиографию с оценкой диастолической дисфункции миокарда; контроль артериального давления.
При первом, втором и третьем обследовании не отмечалось статистически достоверных различий уровней систолического и диастолического артериального давления (табл. 2).

Средние показатели гликемии натощак и через 2 часа после еды у больных сахарным диабетом 2-го типа с ХСН до, во время и после лечения карведилолом не изменились (р > 0,05). На всех этапах обследования не было зафиксировано и достоверной динамики гликированного гемоглобина (табл. 3). Полученные данные свидетельствуют о том, что изменение типа бета-адреноблокатора не сопровождалось существенным изменением показателей компенсации углеводного обмена у больных сахарным диабетом с ХСН.
При анализе данных мониторирования концентрации глюкозы в крови с помощью системы CGMS были получены следующие данные.
Замена исходного бета-адреноблокатора на карведилол сопровождалась статистически достоверным уменьшением среднего количества снижения эпизодов гликемии ниже физиологического уровня (гликемия < 4,5 ммоль/л) (исходно — 2,1 ± 1,9 эпизода/человека; на карведилоле — 0,2 ± 0,4 эпизода/человека, р < 0,05). После отмены карведилола отмечалось увеличение случаев гликемии < 4,5 ммоль/л (0,8 ± 0,9 эпизода/человека, р < 0,05) (рис. 1).
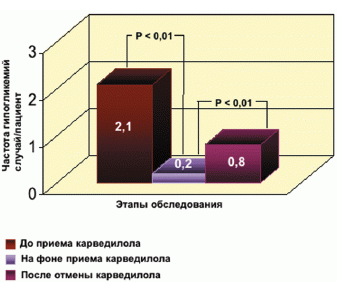
Рис. 1. Частота эпизодов гликемии ниже физиологического уровня (< 4,5 ммоль/л) у больных сахарным диабетом 2-го типа с сердечной недостаточностью до, на фоне и после лечения карведилолом
Прием карведилола повлиял на общую длительность эпизодов, сопровождающихся низким уровнем гликемии. До назначения карведилола общее время гликемии < 4,5 ммоль/л составило 80,6 ± 105,4 мин. На фоне терапии карведилолом отмечалось достоверное снижение общей продолжительности эпизодов гликемии < 4,5 ммоль/л до 0,9 ± 2,0 мин. При возврате к исходной терапии зарегистрировано статистически достоверное нарастание продолжительности периодов гликемии ниже физиологического уровня до 31,3 ± 51,4 мин (рис. 2).
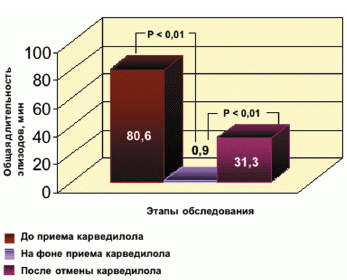
Рис. 2. Общая продолжительность эпизодов гликемии ниже физиологического уровня (< 4,5 ммоль/л) у больных сахарным диабетом 2-го типа с сердечной недостаточностью до, на фоне и после лечения карведилолом
Эпизоды тяжелой гипогликемии (< 2,5 моль/л) отмечались до приема карведилола (1,2 ± 1,6 эпизода/человека) и после его отмены (0,5 ± 0,8 эпизода/человека), на фоне терапии карведилолом случаи тяжелой гипогликемии не зарегистрированы (рис. 3).
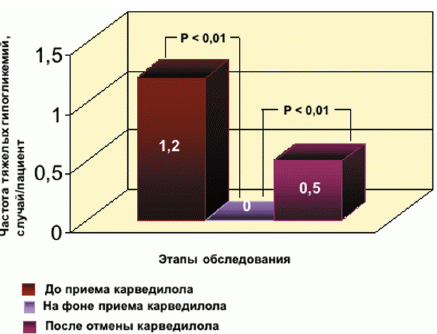
Рис. 3. Частота эпизодов тяжелой гипогликемии (гликемия < 2,5 моль/л) у больных сахарным диабетом 2-го типа с сердечной недостаточностью до, на фоне и после лечения карведилолом
Результаты проведенного исследования оказались для нас абсолютно неожиданными.
Максимум, на который нам, казалось, можно было рассчитывать, это то, что в условиях выраженной сердечной недостаточности карведилол за счет дополнительного гемодинамически благоприятного воздействия на периферическое кровообращение и улучшения за счет этого общего состояния больных не будет достоверно отличаться по частоте развития гипогликемий от аналогичного влияния селективных бета-адреноблокаторов.
Однако мы «просчитались». Замена селективных бета-адреноблокаторов на карведилол сопровождалась достоверным объективным уменьшением частоты возникновения и снижением длительности эпизодов гипогликемии.
Более того, при применении карведилола полностью исчезали тяжелые формы гипогликемических состояний, которые до начала приема карведилола отмечались, а после его отмены вновь появлялись у больных сахарным диабетом с выраженной застойной сердечной недостаточностью на фоне приема селективных бета-адреноблокаторов.
Данные исследования GEMINI, включавшие в себя сравнение влияния карведилола и метопролола на показатели гипогликемии у больных сахарным диабетом 2-го типа, получавших иАПФ и/или АТ-блокаторы [24] по поводу артериальной гипертонии, в определенной мере не противоречат нашим наблюдениям.
Исследование GEMINI представляет собой рандомизированное, двойное слепое, многоцентровое, контролируемое клиническое исследование «Гликемический контроль при сахарном диабете: сравнение карведилола и метопролола у гипертоников (The Glypcemic Effect in Diabetes Mellitus: Carvedilol-Metоprolol Comparison in Hypertensives — GEMINI). В исследовании cравнивался метаболический эффект добавления вышеуказанных бета-адреноблокаторов к лечению лиц с сахарным диабетом 2-го типа и артериальной гипертонией, уже получающих блокаторы ренин-ангиотензиновой системы [24]. В исследование были включены 1210 больных, из которых 726 после рандомизации получали метапролол (средняя доза 104,7 мг/сут), 424 — карведилол (средняя доза 15,6 мг/сут).
Исследование GEMINI продолжалось пять месяцев. Было обнаружено, что добавление метопролола и карведилола в одинаковой степени снижало систолическое и диастолическое давление. Однако метаболические последствия добавления этих бета-адреноблокаторов оказались различными. Так, при приеме карведилола в отличие от метопролола отмечался достоверно более стабильный уровень гликированного гемоглобина A1c (средние сдвиги HbA1c на карведилоле 0,02%, p = 0,65; на метопрололе — 0,15%, p < 0,001) и достоверное снижение резистентности к инсулину (на карведилоле резистентность снижалась на 9,1%, p = 0,004; на метопрололе — на 2%, p = 0,48).
Кроме того, в исследовании GEMINI с помощью специального опросника оценивалась выраженность клинической симптоматики сахарного диабета, сгруппированной в 8 групп, отражающих различные стороны психического состояния, нейропатии, кардиологии, офтальмологии, гипергликемии и гипогликемии. По данным опросника GEMINI добавление карведилола к терапии больных сахарным диабетом 2-го типа вело к достоверному уменьшению частоты появления симптомов гипогликемии (-12; 95% CI -0,23, -0,02; p = 0,02). При добавлении метопролола каких-либо достоверных сдвигов в частоте симптомов гипогликемий выявлено не было (0, -0,08, 0,08; p = 0,98) [25].
В то же время при использовании объективных данных об уровнях гликемии, получаемых при контроле глюкозы крови в течении дня самими больными, достоверных отличий по частоте гипогликемий получено не было. Так, бессимптомная гипогликемия отмечалась у 11,6% больных на карведилоле и у 10,3% больных на метопрололе (p = 0,46). Объективно подтвержденные симптомы гипогликемии на карведилоле отмечались у 8,4% больных, а на метопрололе — у 8,8% (p = 0,81).
Несмотря на то, что авторы исследования GEMINI подчеркивают, что методически оценка эпизодов гипогликемии в их исследовании была недостаточно совершенна, из него вполне очевидно вытекает заключение о том, что карведилол в отношении гипогликемий, по крайней мере, не более опасен, чем метопролол. И это несмотря на то, что при применении карведилола отмечалось достоверное снижение инсулинорезистентности, то есть риск развития гипогликемий объективно возрастал.
Российские исследователи из Томского кардиологического центра [26], анализируя применение карведилола российского производства у больных сахарным диабетом 2-го типа с артериальной гипертонией, зафиксировали не только снижение уровня артериального давления и улучшение показателей перфузии головного мозга, но и достоверное снижение уровня глюкозы в крови после приема пищи, что также может свидетельствовать об улучшении у этих больных чувствительности к инсулину. Во всяком случае, вновь было обнаружено, что применение карведилола объективно повышает риск развития гипогликемий. Московские исследователи, используя российский карведилол у больных сахарным диабетом 2-го типа с начальными проявлениями диастолической дисфункции левого желудочка, в свою очередь отмечают достоверное снижение тощаковой глюкозы в крови больных [27]. Вывод напрашивается совершенно аналогичный. К сожалению, ни в одной из этих работ специальная оценка риска развития гипогликемий не привлекла внимания исследователей.
В российском многоцентровом исследовании АККОРД при наблюдении за 592 больными артериальной гипертонией, ожирением или сахарным диабетом терапия карведилолом не сопровождалась выраженным изменением уровня глюкозы в крови [28]. Только 154 больных одновременно получали сахароснижающие препараты. О явлениях гипогликемии в работе не упоминается. Ясно только то, что препарат не вызывает выраженного ухудшения показателей углеводного обмена. А этого, собственно, трудно было бы и ожидать при наличии его вазодилятирующих свойств.
Интересно, что еще в одной работе, проведенной исследователями, ранее описавшими снижение уровня глюкозы при применении карведилола, они же при обследовании другой группы больных сахарным диабетом 2-го типа с явлениями изолированной диастолической недостаточности кровообращения III–IV функционального класса (по классификации NYHA) уже не обнаружили достоверного снижения уровня глюкозы в крови [29]. К сожалению, и в этой работе возможность развития у подобных больных гипогликемий не была принята во внимание.
И все же результаты этого исследования напоминают полученные нами данные. Ведь мы тоже достоверного изменения уровня глюкозы и гликированного гемоглобина в группе больных, получавших карведилол, не обнаружили. Что же касается наших результатов по оценке выраженности и частоты гипогликемий у подобного контингента больных с помощью наиболее современных методов ее фиксации, то до сих пор аналоги ее нам пока не встречались.
Безусловно, только последующие исследования смогут достоверно объяснить механизмы обнаруженной «гипогликемической» безопасности карведилола в условиях выраженной сердечной недостаточности.
Карведилол отличается от всех других бета-адреноблокаторов рядом дополнительных свойств, которые, вероятно, имеют клиническое значение: он оказывает альфа1-адреноблокирующее действие, отличается высокой липофильностью, предупреждает развитие толерантности к нитратам и проявляет выраженную антиоксидантную активность. По степени липофильности он превосходит все липофильные бета-адреноблокаторы: ацебутолол, бетаксолол, бисопролол, метопролол, тимолол [30]. Доказано, что липофильные бета-адреноблокаторы, которые способны более легко проникать через гематоэнцефалический барьер, повышают активность вагуса, снижают возможность желудочковой фибрилляции и снижают риск внезапной смерти [31–36].
Основные механизмы развития «гипогликемической» безопасности карведилола также могут быть, в первую очередь, связаны с его альфа-блокирующими свойствами.
Известно, что активизация адренергической нервной системы является решающим фактором для ликвидации гипогликемических состояний [37]. Блокада альфа1-адренорецепторов при гипогликемии предотвращает избыточную дилятацию периферических сосудов, поддерживая таким образом нормальное кровяное давление и стабилизируя церебральный кровоток.
Увеличение последнего при приеме карведилола описано многими исследователями [26]. Вазодилятации мозговых сосудов способствует и прямое воздействие карведилола на их альфа1-адренорецепторы [38].
Блокада альфа-адренорецепторов клеток регуляторных центров ЦНС мощно усиливает развитие адренергической и нейрогликопенической симптоматики, связанной со снижением уровня глюкозы в крови, что ведет к своевременной активации компенсаторных механизмов гипогликемии, нарушенных у больных сахарным диабетом [38].
К этим механизмам относится увеличение под влиянием блокады альфа-адренорецепторов секреции глюкагона [38] и одновременное выраженное угнетение стимулированного катехоламинами потребления глюкозы периферическими тканями, особенно жировой [39].
Особое место в увеличении риска развития гипогликемии у больных сахарным диабетом с выраженной хронической сердечной недостаточностью занимает изменение регуляции процесса гликогенолиза в печени.
В физиологических условиях регуляция этого процесса связана с активацией в первую очередь бета2-адренорецепторов [40]. В то же время активации печеночного гликогенолиза возможна и при стимуляции альфа1-адренорецепторов [40].
В условиях выраженной застойной сердечной недостаточности, сопровождающейся резким нарастанием гиперсимпатикотонии и гипоксии печеночной ткани, обусловленной системной вазоконстрикцией, изменяется влияние различных адренорецепторов на процессы гликогенолиза и неоглюкогенеза, нарушая способность печени участвовать в компенсаторных процессах, связанных со снижением уровня глюкозы в крови. Снижение уровня гиперсимпатикотонии и печеночной вазоконстрикции при применении адреноблокаторов нормализует данную ситуацию. Так, было показано, что комбинированная альфа- и бета-адренэргическая блокада увеличивает секрецию глюкозы печенью [41].
Таким образом, изменение регуляторных механизмов компенсации гипогликемических состояний, возникающей при развитии выраженной застойной сердечной недостаточности у больных сахарным диабетом, делает неселективный бета-адреноблокатор с альфа1-блокирующими свойствами карведилол наиболее безопасным бета-блокатором в условиях повышенного риска развития гипогликемии.
В заключение хочется напомнить, что только карведилол достоверно улучшает прогноз больных с ХСН в сочетании с сахарным диабетом. Ни бисопролол, ни метопролол CR/XL не оказывают существенного влияния на течение ХСН у больных сахарным диабетом [30]. А такие больные составляют до 20–30% от всех больных ХСН. Трудно избавиться от мысли, что вышеописанная «гипогликемическая» безопасность карведилола играет при этом одну из ведущих ролей.
Развитие тяжелой недостаточности кровообращения у больных сахарным диабетом это переход в принципиально другое состояние. С принципиально другим уровнем смертности и другими действующими механизмами развития осложнений. Вот почему действие лекарственных средств у подобных больных может значительно отличаться от их проявлений у пациентов без признаков ХСН. В этих условиях ранее «невозможное» может оказаться практически единственно действующим.
Будьте клиницистами, реально оценивайте состояние больного и реальные последствия специфической лекарственной терапии в данной конкретной ситуации.
Литература
- The CONSENSUS trial study group. Effect of enalapril on mortality in severe congestive heart failure // N Engl J Med. 1987; 316: 1429–1435.
- The SOLVD investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fraction and congestive heart failure // N Engl J Med. 1991; 325: 293–302.
- Cohn J. N., Johnson G., Ziesche S. et al. A comparison of enalapril with hydralazine–isosorbide dinitrate in the treatment of chronic congestive heart failure // N Engl J Med. 1991; 325: 303–310.
- Packer M., Poole-Wilson P. A., Armstrong P. M. et al. on behalf of the ATLAS Study Group. Comparative effects of low doses of the angiotensin converting enzyme inhibitor lisinopril on morbidity and mortality in chronic heart failure. Submitted, 1998.
- The NETWORK investigators. Clinical outcome with enalapril in symptomatic chronic heart failure; a dose comparison // Eur Heart J. 1998; 19: 481–489.
- Suskin N., McKelvie R. S., Roteaus J., Sigouin C., Wiece K. E., Yusuf S. Increased insulin and glucose levels in heart failure // J Am Coll Cardiol. 1998; 3 (suppl): 249 A.
- Schindler D. M., Kostis J. B., Yusuf S. et al. For the SOLVD investigators. Diabetes mellitus: a predictor of morbidity and mortality in the studies of left ventricular dysfunction (SOLVD) trials and registry // Am J Cardiol. 1996; 77: 1017–1020.
- Clark C. M., Perry R. C. Type 2 diabetes and macro vascular disease. Epidemiology and etiology // Am Heart J. 1999.
- Chae C. U., Glynn R. J., Manson J. E., Guralnik J. M., Taylor J. O., Pfeffer M. A. Diabetes predicts congestive heart failure risk in the elderly // Circulation. 1998; 98 (suppl I); 721.
- Detry J. M. The pathophysiology of myocardial ischaemia // Eur Heart J. 1996; 17 (suppl G): 48–52.
- Youkoyama I., Momomura S.-I., Ohtake T. et al. Reduced myocardial flow reserve in non-insulin-dependent diabetes mellitus // J Am Coll Cardiol. 1997; 30: 1472–1477.
- Lundb?ck K. Diabetic angiopathy: a specific vascular disease // Lancet. 1954; 2: 377–379.
- Ewing D. Cardiac autonomic neuropathy. In: Jarret R, ed. Diabetes and heart disease. Amsterdam: Elsevier. 1984: 99–132.
- Amato L., Paolisso G., Cacciatore F. et al. On behalf of the observatorio geriatrico regione campania group. Congastive heart failure predicts the development of non-insulin dependent diabetes mellitus in the elderly // Diabetes Metab. 1997; 23: 213–218.
- Mosterd A., Cost B., Hoes A. W., de Bruijne M. C., Decrers J. W., Hofman A. et al. The prognosis of heart failure in the general population. The Rotterdam Study // Eur Heart J. 2001; 22: 1318–1327.
- De Groote P., Lamblin N., Mouquet F., Plichon D., McFadden E., Van Belle E. et al. Impact of diabetes mellitus on long–term survival in patients with congastive heart failure // Eur Heart J. 2004; 25: 656–662.
- Thrainsdottir I. S., Aspelund T., Hardarson T., Malmberg K., Sigurdsson G., Thorgeirsson G., Gudnason V., Ryden L. Glucose abnormalities and heart failure prognosis in the population based Reykjavik Study // Eur J Cardiovasc Prev Rehabil. 2005; 12: 465–471.
- Guidelines on diabetes, pre-diabetes and cardiovascular diseases: full text // Eur Heart J. 2007; 1–72.
- Haas S. J., Vos T., Gilbert R. E., Krum H. Are?-blockers as efficacious in patients with diabetes mellitus as in patients without diabetes mellitus who have chronic heart failure? A meta-analysis of large-scale clinical trials // Am Heart J. 2003; 146: 848–853.
- Hjalmarson A., Goldstein S., Fagerberg B., Wedel H., Waagstein F., Kjekshus J. et al. For the MERIT-HF Study Group. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well–being in patients with heart failure: The Metoprolol CR/XL Randomized intervention Trial in Congestive Heart Failure (MERIT–HF) // JAMA. 2000; 283: 1295–1302.
- Deedwania P. C., Giles T. D., Klibaner M., Herlitz J., Hildebrandt P., Kjekshus J., Spinar J., Vitovec J., Stanbrook H., Wikstrand J. MERIT–HF Study Group. Efficacy, safety nd tolerability of metoprolol CR/XL in patients with diabetes and chronic heart failure: experiences from MERIT-HF // Am Heart J. 2005; 149: 159–167.
- Packer M., Coats A. J., Fowler M. B., Katus H. A., Krum H., Mochacsi P. et al. for the Carvedilol Prospective Randomized Cumulative Survival in severe chronic heart failure // N Engl J Med. 2001; 344: 1651–1658.
- Pool-Wilson P. A., Swedberg K., Cleland J. G., Di Lenarda A., Hanrath P., Komajda M. et al. for the COMET Investigators. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomized controlled trial // Lancet. 2003; 57: 601–609.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru