Содержание статьи
Принципы лечения бронхолегочной инфекции у больных миастенией
В. И. Соколова, кандидат медицинских наук
А. Г. Санадзе, доктор медицинских наук, профессор
Д. А. Сычев, доктор медицинских наук, профессор
М. Б. Бабарина, кандидат медицинских наук
Д. А. Зайков
ГБОУ ДПО РМАПО МЗ РФ, Москва
Миастения является классическим аутоиммунным заболеванием, в основе которого
лежит аутоиммунный процесс, направленный против ацетилхолинового рецептора
постсинаптической мембраны мышцы [1]. Ведущим звеном в развитии миастении
является нарушение нейромышечной проводимости, что клинически выражается в
развитии нарастающей мышечной слабости различной локализации. В настоящее время
достигнуты большие успехи в изучении патогенеза заболевания, в диагностике, в
подходах ведения и лечения различных групп больных миастенией [2]. Однако
несмотря на патогенетическую терапию не существует специфических подходов
полного излечения этого заболевания. Исход развития болезни зависит от
эффективности подобранной терапии и скорости прогрессирования нарастающей
мышечной слабости, которое может привести к полной невозбудимости определенных
групп мышц.
Наиболее клинически значимым у больных миастенией является вовлечение в
патологический процесс основной и вспомогательной дыхательной мускулатуры, что,
в конечном итоге, выражается разной степенью дыхательной недостаточности [7].
Данные изменения приводят к нарушению вентиляционной функции легких, вызывая
застойные явления, которые являются «благоприятными» для развития
инфекционно-воспалительного процесса. В исследовании, проведенном в Госпитале
Университета Джона Хопкинса с 1990–1998 г., было показано, что у 46% пациентов,
испытывающих те или иные дыхательные нарушения на фоне миастении, развивается
пневмония [3].
Важность развития инфекционного процесса связана с лечением, проводимым у
больных различной формы миастениий. Помимо основной терапии антихолинэстеразными
препаратами лечение миастении направлено на подавление активности аутоиммунного
процесса, что осуществляется путем подавления общего иммунного ответа организма.
В методы лечения миастении входит применение пульс-терапии
глюкокортикостероидами, применение цитотоксических иммунодепрессантов (азатиоприн,
циклофосфамид), тимэктомия. Перечисленные методы лечения в связи с подавлением
иммунитета создают дополнительный фон для развития бактериальных осложнений.
Важно отметить, что для некоторых лекарственных препаратов, например
Циклофосфана, отмечено прямое токсическое действие на легочную ткань. Таким
образом, роль инфекции при миастении очевидна [4].
Актуальность проблемы развития бронхолегочных заболеваний связана и со
сложностью лечения подобных осложнений у больных с миастенией. Некоторые
препараты, которые применяются в стандартной практике при лечении сопутствующих
заболеваний (курареподобные препараты, D-пеницилламин, интерферон-альфа, соли
магния, бета-блокаторы, блокаторы кальциевых каналов и т. д.), противопоказаны
при миастении из-за их угнетающего воздействия на нейромышечную проводимость. К
препаратам, которые абсолютно противопоказаны при миастении, также относятся
некоторые антибиотики: аминогликозиды, макролиды, фторхинолоны. Это накладывает
определенные ограничения у данных больных на лечение инфекционных осложнений
(ИО), как уже было отмечено ранее, столь часто проявляющихся со стороны
дыхательной системы.
Таким образом, из-за сложности лечения ИО у больных с миастенией возникает
необходимость поиска новых подходов в терапии данной группы больных. К
сожалению, при подготовке материалов не было найдено англоязычной литературы,
посвещенной этой проблеме.
Целью настоящего исследования явилось изучить микробиологический пейзаж
мокроты, трахеобронхиального секрета и оценить клиническую эффективность
антибиотико- и иммунотерапии у больных с инфекционно-воспалительными
заболеваниями на фоне миастении.
Материалы и методы исследования
Группу исследования составили 19 больных с генерализованной формой миастении
(6 мужчин, 13 женщин; возраст больных составил от 22 до 81 года); из них 3
мужчин, 7 женщин — с обострением хронического трахеобронхита, 3 мужчин, 1
женщина — с остаточными признаками перенесенной госпитальной пневмонии; 2
женщины — с хроническим обструктивным бронхитом; 1 женщина — с синдромом
Ламберта–Итона; 2 женщины — с бактериальной очаговой пневмонией (у одной из них
— тимэктомия в анамнезе). Клинические признаки обострения инфекционного процесса
были следующие: кашель со слизисто-гнойной мокротой, увеличение ее продукции,
одышка, быстрая утомляемость, у некоторых больных наблюдался субфебрилитет.
Перед началом лечения проводили общепринятое клинико-лабораторное исследование,
изучение бактериологического состава мокроты, секрета из трахеи (или трахеостомы),
исследования показателей функции внешнего дыхания (ФВД), рентгенографию или
компьютерную томографию (КТ) грудной клетки.
Образцы, полученные от больных, доставляли в течение 2 часов в
бактериологическую лабораторию, где проводилась микроскопия мазка для оценки
качества биоматериала и посев на стандартные питательные среды. Образцы мокроты
считались приемлемыми, если число лейкоцитов было больше 25, а число
эпителиальных клеток — меньше 10 в одном поле зрения. При посеве выделенных
возбудителей проводили видовую идентификацию (тест-системы BBL Crystal).
Антибиотикочувствительность микроорганизмов определяли методом диффузии в агаре.
Тяжесть состояния и трудность лечения пациентов обусловлены иммунодефицитом и
ятрогенией. Так, у одной пациентки имел место стеноз трахеи, развившийся
вследствие длительной искусственной вентиляции легких, проводимой в связи с
миастеническим кризом. У другого пациента был рак языка, в связи с чем больному
была выполнена открытая трахеостомия. В этих случаях ситуация усугубляется:
снижается иммунологическая защита, нарушается эвакуация трахеобронхиального
секрета, что способствует колонизации нозокомиальными резистентными штаммами
микроорганизмов и развитию гнойно-инфекционных осложнений. И еще у одного
пациента тяжесть состояния усугублялась непосредственно приемом
антихолинэстеразного препарата пиридостигмин (Калимин), назначаемого при
миастении. На фоне приема пиридостигмина у больного усиливалось выделение
мокроты до 300 мл/сут. В связи с этим пациент был вынужден отказаться от приема
препарата и самостоятельно проводить позиционный утренний дренаж.
Аускультативная картина была скудной: дыхание везикулярное, ослабленное в
нижнелатеральных отделах легких, локальные влажные и рассеянные сухие хрипы,
частота дыхания в покое 18–20 в мин.
При исследовании ФВД выявлены вентиляционные нарушения. Снижение ОФВ1
составило в среднем от 60% до 49%.
В качестве антибиотикотерапии все больные получали цефоперазон/сульбактам
внутривенно или внутримышечно в дозе 1,0 г 2 раза в сутки. Длительность терапии
составила 7–10 дней (в зависимости от степени активности инфекционного
процесса). С целью улучшения реологических свойств мокроты всем пациентам
назначали муколитики (ацетилцистеин (Флуимуцил) по 300 мг 2 р/сут) через
небулайзер или per os.
В программу лечения с иммунозаместительной целью был включен человеческий
внутривенный иммуноглобулин G (ВВИГ: Октагам, Биавен В. И., Октаглобин). Лечение
проводилось на фоне основной базовой терапии, включающей метилпреднизолон,
пиридостигмин и хлористый калий.
Нам представляется важным описать клинический случай в данном исследовании.
Больной 74 лет имел диагноз «генерализованная миастения» с декабря 2010 г. По
тяжести состояния принимал 80 и 40 мг метилпреднизолона по альтернирующей
ежедневной схеме. Обратился в августе 2012 года с жалобами на резкую слабость,
быструю утомляемость, нарастающую одышку при незначительном физическом усилии.
При объективном исследовании больного отмечено состояние средней тяжести, кожные
покровы без видимой патологии, периферические лимфоузлы не увеличены, стопы
пастозны. При перкуссии грудной клетки определялся коробочный звук, экскурсия с
обоих сторон — 3 см (1,5 + 1,5). При аускультации — дыхание в проекции сегментов
S4–5, S9 справа резко ослаблено, хрипы отсутствовали, число дыхательных движений
сидя 18 в мин. ЧСС — 85 в мин, АД — 130/85 мм рт. ст., температура 36,8 °C.
Пальпация живота безболезненна, абдоминальные органы не увеличены. Результаты
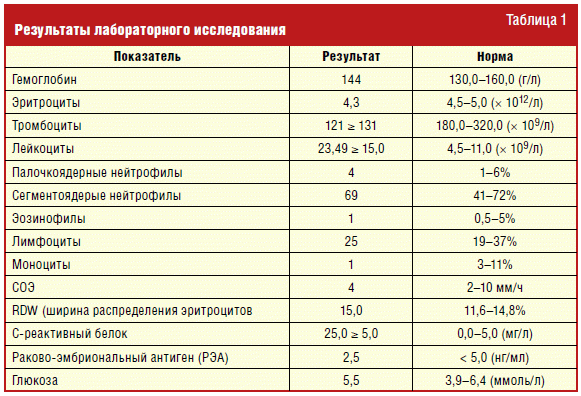
лабораторного исследования представлены в табл. 1. На представленных снимках КТ
органов грудной клетки слева в проекции сегментов S1–2 определяется полостное
образование неправильной формы с неровными, несколько инфильтрированными
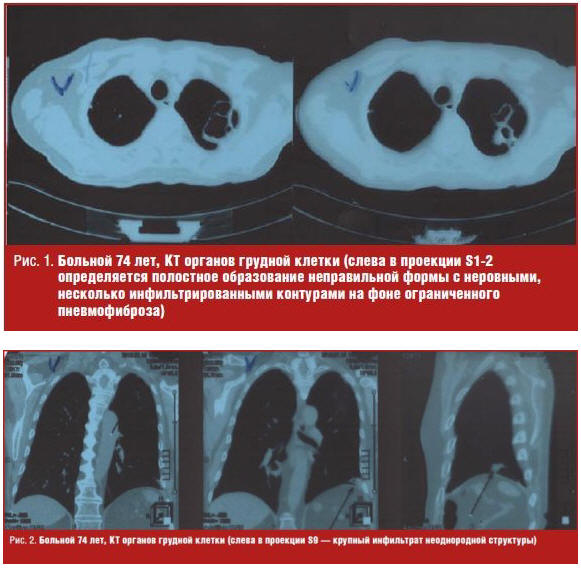
контурами на фоне ограниченного пневмофиброза (рис. 1). Слева в проекции
сегмента S9 — крупный инфильтрат неоднородной структуры (рис. 2). Была
произведена диагностическая бронхоскопия: бронхи проходимы, слизистая
бледно-розового цвета, атрофична. Заключение: хронический атрофический
трахеобронхит II ст.
Итак, у больного на фоне миастении развилась пневмония с деструкцией легочной
ткани. Этиологический фактор выявить не представилось возможным из-за отсутствия
мокроты. Важно отметить, что на фоне длительного приема высоких доз
метилпреднизолона у пациента появились признаки тромбоцитопении, проявляющиеся
кожными кровоподтеками на теле, начат курс комплексной антибиотико- и
иммунотерапии. Внутривенно капельно вводился цефоперазон/сульбактам в течение 10
дней. Одновременно вводился ВВИГ, курсовая доза составила 15,0 г. Проведенная
терапия с включением ВВИГ позволила добиться более быстрой ремиссии
инфекционно-воспалительного процесса, подтвержденной клинико-лабораторными
данными и результатами повторных КТ исследований легких, где отмечена
положительная динамика патологического процесса (табл. 1): повышение уровня
тромбоцитов — до 131 × 109/л, снижение лейкоцитоза до 15,0 × 109/л,
снижение уровня С-реактивного белка — до 5,0 мг/л.
Пациент консультирован эндокринологом: отмечаются жалобы на боли в спине при
ходьбе и физических нагрузках, снижение роста на 4 см за 3 года, чувство
усталости в спине сидя; при осмотре определяется грудной кифоз, результаты
лабораторного обследования представлены в табл. 2.
По рентгенографии позвоночника в боковой проекции выявлены компрессионные
переломы 1-го, 2-го поясничных позвонков. Двуэнергетическая рентгеновская
абсорбциометрия: минеральная плотность костной ткани по Т-критерию в поясничном
отделе позвоночника — 3,0 SD, минеральная плотность костной ткани по Т-критерию
в шейке бедра — 2,0 SD.
Диагноз: лекарственный (глюкокортикоидный) остеопороз с компрессионными
переломами тел позвонков. Рекомендовано: рациональное питание с увеличением
употребления продуктов, богатых кальцием и витамином D, поддержание адекватной
физической активности и выполнение упражнений с нагрузкой, соответствующей
состоянию здоровья; альфакальцидол (Альфа Д3-Тева) 0,75 мкг ежедневно,
ибандроновая кислота (Бонвива) 3,0 мл болюсно 1 раз в 3 месяца.
Результаты и обсуждение
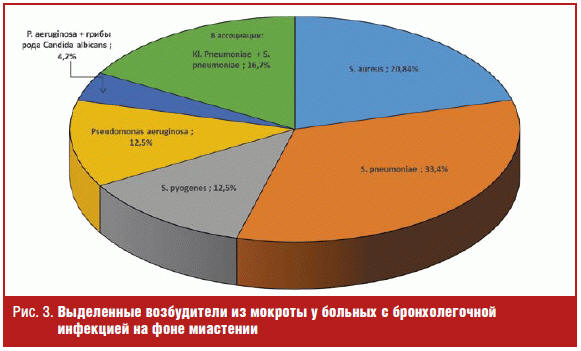
Было изучено 24 образца мокроты и бронхиального секрета, выделенных у больных
с бронхолегочными заболеваниями. Основными клинически значимыми микроорганизмами
были: S. pneumoniae (33,4%), S. aureus (20,8%), S.
pyogenes (12,5%) (рис. 3). Среди неферментирующих грамотрицательных
бактерий были штаммы P. aeruginosa (12,5%). В четырех образцах
биоматериала наблюдался рост микробной ассоциации: P. aeruginosa и
грибы Candida albicans и еще в одном образце Kl. pneumoniae + S.
pneumoniae. Большой интерес представляет изучение чувствительности
выделенных возбудителей к цефперазону/сульбактаму. Отмечено, что все штаммы
микроорганизмов вошли в антимикробный спектр действия цефоперазона/сульбактама;
и лишь в одном образце (P. aeruginosa + Candida albicans) антибиотик
проявил слабую активность к выделенному патогену.
Итак, клиническое исследование мокроты у больных с обострением хронического
бронхита и пневмонии на фоне миастении позволило выявить неоднородность
микробиологического пейзажа. Лидирующими возбудителями были грамположительные
патогены, такие как S. pneumoniae, S. aureus, S. pyogenes (что
составило 66,7%). Цефоперазон/сульбактам проявил высокую активность к этим
штаммам микроорганизмов. Одновременно наблюдался рост грамотрицательных
патогенов P. aeruginosa и Kl. pneumoniae (по 12,5% соответственно),
которые были чувствительны к цефоперазону/сульбактаму. Некоторые
грамотрицательные микроорганизмы представляли ассоциации P. aeruginosa
с грибами рода Candida (4,2%), Kl. pneumoniae с S. pneumoniae
(16,7%); в таких случаях назначалась фунгицидная терапия флуконазолом (Дифлюкан),
что значительно улучшило течение болезни.
Инфекционный процесс респираторного тракта у данной группы больных протекал
торпидно, несмотря на адекватную антимикробную терапию. Известно, что при
миастении имеет место общая депрессия иммунной системы вследствие угнетения как
специфических, так и неспецифических факторов защиты, что требует коррекции
иммунных «поломок».
Важно отметить основные свойства использованного антибиотика. Цефоперазон/сульбактам
проявил активность как к грамположительным, так и к грамотрицательным
микроорганизмам, в том числе к P. aeruginosa. Кроме того, антибиотик
стабилен к действию бета-лактамаз, благодаря необратимому ингибитору —
сульбактаму, синергично повышающему эффективность применяемого антибиотика (до 4
раз снижается минимальная подавляющая концентрация цефоперазона в отношении
чувствительных к нему штаммов микроорганизмов). Большое значение имеет хорошая
переносимость больными препарата, т. е. антибиотик не влияет на нервно-мышечное
проведение.
Итак, кроме дезинтоксикационной, антибактериальной и других видов терапии, в
настоящее время широко используются ВВИГ при различной локализации
инфекционно-воспалительного процесса [5–8]. ВВИГ (Октагам, Биавен В. И.,
Пентаглобин и др.) содержат репертуар антител, способных инактивировать широкий
спектр антигенов. Иммуноглобулины являются фактором приобретенного иммунитета,
осуществляющего опсонизацию инфекционных очагов, способствуют быстрой элиминации
бактериального агента и его метаболитов, активируя целый каскад иммунных
реакций.
Заключение
Многолетний опыт позволяет использовать ВВИГ в комплексной терапии
бактериальной инфекции респираторного тракта. Значимо улучшается течение
болезни, ускоряются сроки излечения больных, а главное — снижается риск
колонизации резистентными штаммами микроорганизмов и, соответственно, риск
повторного эпизода инфекции.
Литература
- Санадзе А. Г. Миастения и миастенические синдромы. 2012, с. 252.
-
Щербакова Н. И. Патогенетические обоснования стратегии и тактики
лечения миастении (Автореферат докторской диссертации). 2007, с. 3–50. -
Varelas P. N., Chua H. C., Natterman J., Barmadia L., Zimmerman P.,
Yahia A., Ulatowski J., Bhardwaj A., Williams M. A., Hanley D. F.
Ventilatory care in myasthenia gravis crisis: assessing the baseline adverse
event rate // Crit Care Med. 2002, Dec; 30 (12): 2663–2668. -
Sulkowski S., Sulkowska M. Alveolar cells in
cyclophosphamide-induced lung injury. II. Pathogenesis of experimental
endogenous lipid pneumonia // Histol Histopathol. 1999, Oct; 14 (4):
1145–1152. -
Санадзе А. Г., Соколова В. И., Щербакова Н. И., Никифорук Н. М.
Эффективность применения минимальных доз иммуноглобулина в лечении тяжелой
миастении, осложненной абсцедирующей пневмонией // Актуальные вопросы
клинической транспортной медицины. 2001, т. 6: с. 280–286. -
Skeie G. O. et al. Guidelines for treatment of autoimmune
neuromuscular transmission disorders // Journal of Neurology. 2010, 17:
893–902. -
Serrano M. C., Rabinstein A. A. Causes and outcomes of acute
neuromuscular respiratory failure // Arch Neurol. Sep. 2010, Vol. 67 (№ 9):
1089–1092. -
Латышева Е. А., Латышева Т. В. Применение внутривенных
иммуноглобулинов в интенсивной терапии // Общая реаниматология. 2012, VIII; 3:
45–49.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







