Преконцепционная подготовка пациенток со смешанным вагинальным дисбиозом
Содержание статьи
Актуальность
В настоящее время одним из ведущих аспектов гинекологической заболеваемости являются инфекции влагалища неспецифической этиологии, связанные с нарушением микробиоценоза. Их частота варьирует в широких пределах и, по данным научной литературы, составляет от 30 до 80% в структуре всех воспалительных заболеваний нижнего отдела гениталий у женщины [1–3]. При данной патологии происходит изменение микроэкологии влагалища с замещением нормальной микрофлоры (Н2О2-продуцирующие лактобактерии) условно-патогенной эндогенной микрофлорой (грамположительные, грамотрицательные, аэробные, факультативно-анаэробные и облигатно-анаэробные микроорганизмы, такие как Atopobium vaginae, Gardnerella vaginalis, Prevotella spp., Porphyromonas spp., Peptostreptococcus spp., Fusobacterium spp., Mobiluncus spp., Mycoplasma и др.) [4, 5].
Кроме того, в последнее время в литературе стали часто встречаться наблюдения, когда на фоне вагинальных дисбиотических нарушений в составе патогенной микробиоты выявляются грибы рода Candida как маркер воспалительных заболеваний нижнего отдела гениталий [6–8].
При этом даже у практически здоровых женщин репродуктивного возраста более чем в 20% случаев выявляются нарушения состава вагинальной микробиоты, не сопровождающиеся никакой клинической симптоматикой [2, 5, 9]. Манифестная же картина вагинального дисбиоза (или бактериального вагиноза) сопровождается длительными (иногда в течение нескольких лет) выделениями из влагалища с неприятным запахом, дизурическими расстройствами, диспареунией, приводящими к невротическим состояниям, расстройству семейных отношений, снижению работоспособности, а в некоторых случаях служат фоновым заболеванием, способствующим репликации папилломавирусов с последующим предраковым и раковым поражением шейки матки и влагалища (нитрозамины как продукты метаболизма анаэробов также являются коферментами канцерогенеза) [4, 8, 10].
Кроме того, вагинальный дисбиоз является одним из наиболее значимых факторов риска осложнений беременности и родов. Результатом наличия большого количества условно-патогенной и патогенной микрофлоры влагалища во время беременности часто являются: 1) преждевременные роды, 2) хорионамнионит, 3) преждевременный разрыв плодных оболочек, 4) плацентарная недостаточность, 5) внутриутробная инфекция плода, 6) послеродовые инфекционные осложнения как для матери, так и для ее ребенка [4, 11]. Все вышеперечисленное предполагает проведение своевременной комплексной деконтаминационной и последующей контаминационной терапии смешанных форм вагинального дисбиоза в плане преконцепционной подготовки пациенток, планирующих беременность.
В современной гинекологической практике имеется достаточно большое количество лекарственных препаратов для лечения смешанных вагинальных дисбиозов, в то же время часто монотерапия или неправильно подобранная терапия оказывается неэффективной, что объясняется недостаточными условиями для создания оптимального вагинального гомеостаза [6, 12–15].
Исходя из вышеизложенного определена цель исследования: оценка клинического опыта и эффективности различных вариантов локальной терапии пациенток со смешанной формой вагинального дисбиоза, планирующих беременность.
Материал и методы
Проведено сравнительное открытое рандомизированное исследование результатов лечения 123 женщин со смешанной формой вагинального дисбиоза (шифр по МКБ-10: N89. Другие невоспалительные заболевания влагалища), у которых после окончания курса лечения в течение 6 мес. произошло зачатие с последующим вынашиванием и рождением ребенка. Исследование проведено на базе кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России, женских консультаций г. Краснодара. Обследование проводилось согласно приказу от 12.11.2012 № 572н Минздрава России.
Критерии включения в исследование: положительные критерии Amsel, выявление G. vaginalis и/или A. vaginae в концентрации не менее 106 ГЭ/мл методом полимеразной цепной реакции (ПЦР), а также других условно-патогенных микроорганизмов, ассоциированных с вагинальным дисбиозом; отрицательные результаты исследований, направленных на выявление Neisseria gonorrhoeae, Trichomonas vaginalis, Chlamydia trachomatis, Mycoplasma genitalium; отсутствие антибактериальной и противогрибковой терапии, иммунотерапии в течение предшествующих 2 мес.; наличие информированного добровольного согласия и соблюдение всей процедуры исследования.
Методы исследования: клинико-анамнестическое и общеклиническое обследование; бактериоскопия отделяемого из цервикального канала и влагалища; ПЦР с детекцией результатов в режиме реального времени (ПЦР-РВ — Фемофлор-скрин) для определения возбудителей инфекций, передающихся половым путем (OOO «НПO ДНK-Тeхнология», Мoсквa); ПЦР-РВ для определения условно-патогенной микрофлоры (Фемофлор-16); pH-метрия вагинального содержимого (кольпотест); цервикальные мазки на онкоцитологию.
Оценку вагинального дисбиоза проводили по критериям Hay/Ison (микроскопия окрашенного по Граму мазка): нулевая степень — нет связи с бактериальным вагинозом, определяются только эпителиальные клетки, отсутствуют лактобактерии — свидетельствует о недавней терапии антибиотиками; первая степень (норма) — преобладают морфотипы лактобактерий; вторая степень (промежуточная) — смешанная флора с небольшим количеством лактобактерий и присутствием морфотипов Gardnerella или Mobiluncus; третья степень (бактериальный вагиноз) — преобладают морфотипы Gardnerella или Mobiluncus, присутствуют ключевые клетки, небольшое количество или отсутствие лактобактерий; четвертая степень — нет связи с бактериальным вагинозом, только грамположительные кокки, отсутствуют лактобактерии (флора, соответствующая анаэробному вагинозу).
Все пациентки (n=123) с верифицированным диагнозом «смешанная форма вагинального дисбиоза» по методу локальной терапии были разделены на 4 группы: I группа (n=31) получала комплексный препарат, содержащий метронидазол и миконазол (Метромикон-Нео®) по 1 суппозиторию 2 р./сут в течение 7 дней интравагинально; II группа (n=32) — интравагинальные аппликации клотримазола (2% крем) 1 р./сут в течение 6 дней; III группа (n=30) — интравагинальные аппликации 2% крема клиндамицина фосфата 1 р./сут в течение 6 дней; IV группа (n=30) — комплексный препарат, содержащий тернидазол, неомицина сульфат, нистатин и преднизолон, по 1 вагинальной таблетке на ночь в течение 10 дней.
Контаминация лактобактериями и нормализация уровня кислотности влагалищного содержимого проводилась всем женщинам четырех групп через 2 дня после окончания основного лечения препаратом, содержащим пробиотические штаммы лактобактерий Lactobacillus rhamnosus GR-1® и Lactobacillus reuteri RC-14® не менее 1×109 КОЕ/г), вагинально по 1 капсуле в сутки в течение 15 дней.
Препарат Метромикон-Нео® (ОАО «Авексима», Россия) представляет собой комбинацию метронидазола (500 мг) и миконазола нитрата (100 мг). Метронидазол (5-нитроимидазол) является бактерицидным препаратом и активен в отношении как простейших (Trichomonas vaginalis), так и облигатных анаэробов (грамотрицательных: Bacteroides spp., Fusobacterium spp., Veillonella spp., Prevotella spp.; грамположительных: Clostridium spp., Eubacterium spp., Peptococcus spp., Peptostreptococcus spp., Mobiluncus spp. и факультативного анаэроба Gardnerella vaginalis). Метронидазол включен в рекомендации IUSTI (2018) по лечению влагалищных выделений в качестве препарата выбора терапии бактериального вагиноза [8, 15]. Фунгицидный и фунгистатический эффекты миконазола обусловлены ингибированием биосинтеза эргостерола оболочки и плазматических мембран патогенных грибов с изменением липидного состава и проницаемости клеточной стенки, что вызывает гибель клетки. В состав данных суппозиториев также входит полусинтетический глицерид Суппоцир АМ, который способствует равномерному распределению действующего вещества по слизистой оболочке, что обеспечивает высокие мукоадгезивные свойства.
Клотримазол (производное имидазола) оказывает антимикробное действие в отношении грамположительных микроорганизмов (Streptococcus spp., Staphylococcus spp.) и анаэробов (Bacteroides spp., G. vaginalis), а также воздействует на патогенные формы грибов, проникая внутрь грибковой клетки и нарушая синтез эргостерина, а в фунгицидных концентрациях взаимодействует с митохондриальными и пероксидазными ферментами, что также способствует разрушению грибковых клеток.
Клиндамицина фосфат — препарат из группы антибиотиков-линкозамидов, бактериостатик. Активен в отношении Staphylococcus spp., Streptococcus spp., анаэробных и микроаэрофильных грамположительных кокков (включая Peptococcus spp. и Peptostreptococcus spp.), Mycoplasma spp., Bacteroides spp., анаэробных грамположительных неспорообразующих бацилл (включая Propionibacterium spp., Eubacterium spp., Actinomyces spp.). Клиндамицина фосфат включен в рекомендации IUSTI (2018) по лечению влагалищных выделений в качестве альтернативного варианта терапии бактериального вагиноза [15].
Комплексный препарат содержал в своем составе: тернидазол (200 мг) — воздействует на анаэробный компонент микрофлоры влагалища; антибиотик-антимикотик — нистатин (100 000 ЕД) и неомицина сульфат (100 мг) — воздействуют на грамположительные и грамотрицательные бактерии; преднизолон (3 мг) — для купирования симптомов воспаления.
Все пациентки совершили по 4 визита к врачу-исследователю согласно определенным этапам исследования: 1-й визит: информированное согласие, сбор анамнеза, бактериоскопия отделяемого из цервикального канала и влагалища с окраской по Граму и забор биологического материала для исследования методом ПЦР-РВ, pH-метрия влагалищного содержимого; 2-й визит (3-й день): оценка результатов исследований, верификация диагноза «смешанная форма вагинального дисбиоза», рандомизация пациенток в одну из исследуемых групп, назначение лечения; 3-й визит (5-й день после окончания терапии): оценка эффективности лечения (жалобы, осмотр, бактериоскопия отделяемого из цервикального канала и влагалища с окраской по Граму, pH-метрия вагинального содержимого); 4-й визит (через месяц после окончания лечения): забор материала на ПЦР-РВ, бактериоскопия отделяемого из цервикального канала и влагалища с окраской по Граму, pH-метрия. Микроскопическое исследование вагинальных мазков (окраска по Граму с оценкой по критериям Hay/Ison) проводили через 5 и 30 дней после завершения терапии.
Комплаентность во всех группах оценивали по клинико-психологической тестовой методике (шкала Мориски — Грин). Комплаентными считаются больные, набравшие 4 балла (2 балла и менее считались неприверженными лечению, 3 балла — недостаточно приверженными) [16].
Полученные результаты обработаны методом вариационной статистики (критерий Фишера (F) для оценки непараметрических показателей групп малых выборок и Стьюдента (t) для независимых групп) с использованием программы Statistica 6,0.
Результаты исследования
Наблюдались 123 женщины в возрасте 18–40 лет (средний возраст 24,1±3,2 года) с диагнозом «смешанная форма вагинального дисбиоза». Большинство пациенток предъявляли жалобы на выделения из половых путей разной интенсивности с неприятным запахом, субъективные ощущения в виде зуда, жжения в области вульвы и влагалища, болезненности при половом акте (диспареуния) (рис. 1). При влагалищном исследовании в зеркалах у 96,7% женщин выявлены воспалительные изменения слизистых влагалища и вульвы, цервицит (45,5% пациенток), патологический характер белей с неприятным запахом.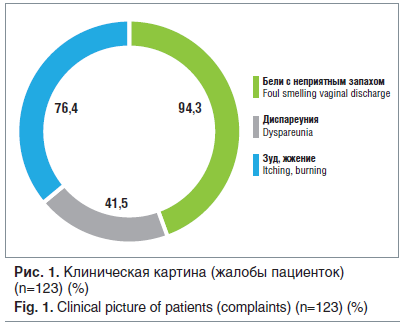
Значения pH вагинального содержимого находились в пределах от 5,4 до 8,1 (в среднем 6,4±2,1) (рис. 2).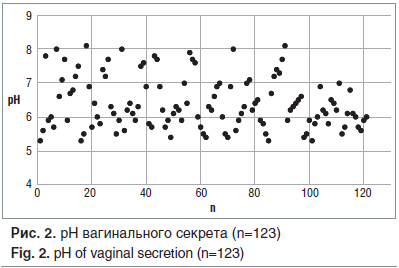
Микроскопическая картина вагинальной микробиоты соответствовала понятию вагинального дисбиоза. В вагинальных мазках обнаруживались «ключевые клетки» (82,1%), мицелий и клетки дрожжевых грибов (42,3%), при этом Lactobacillus spp. в адекватных количествах (палочки Дедерлейна) выявлены лишь у 13,0% пациенток. Количество лейкоцитов в пределах нормы (4–10 в поле зрения) выявлено в 56,1% мазков, выше 10 в поле зрения — в 35,7%, ниже 4 — в 8,2% (рис. 3). Оценка признаков вагинального дисбиоза по критериям Hay/Ison показала вторую (промежуточную) степень в 71,5% случаев и третью степень (бактериальный вагиноз) в 28,5% случаев.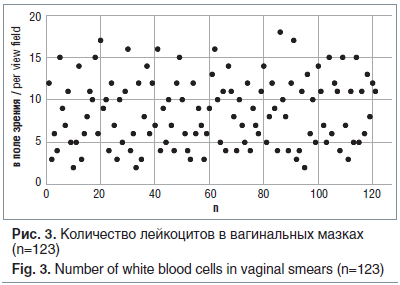
ПЦР-детекция условно-патогенной вагинальной микрофлоры показала преобладание факультативно-анаэробных и облигатно-анаэробных микроорганизмов: Gardnerella vaginalis (97,5%), Atopobium vaginae (76,4%), Mobiluncus spp. (55,3%) и Bacteroides spp. (43,9%) (рис. 4). Также доминировала кокковая микрофлора (в сумме 65,8%). Детекция Mycoplasma hominis и Ureaplasma spp. (больше 104 ГЭ/мл) определялась соответственно в 26,0 и 30,9% случаев.
В ходе лечения 4 пациентки не явились на контрольное обследование, таким образом, исследование завершили 119 женщин.
Клиническая эффективность
На 5-й день после окончания лечения во всех группах отмечено достоверное (p® (I), клотримазол (II) и комплексный препарат (IV) патологические бели выявлялись в среднем в 6,6±0,2% случаев. Субъективная симптоматика в виде зуда, жжения в области наружных половых органов на данном сроке мониторинга имела такую же тенденцию к исчезновению: в I и IV группах лишь у 6,4 и 3,4% пациенток соответственно остались вышеперечисленные жалобы, во II и III группах — у 10 и 17,2%. На 30-й день после окончания лечения ни в одной из групп клиническая симптоматика не претерпела выраженных изменений: патологические бели с неприятным запахом отмечены у 3,2% пациенток I группы (положительная динамика), у 6,7% — II группы (без изменений), у 3,4% — III группы и у 10,3% — IV группы (некоторая отрицательная динамика). Ощущения в виде зуда и жжения в области вульвы и влагалища в I группе определялись в 6,4% случаев, во II группе — в 3,3% (уменьшились), в III — в 10,0%, в IV группе — в 13,8% случаев. При этом данные изменения не были статистически достоверными (p>0,05). После проведенной терапии pH вагинального секрета во всех группах снизился и составил в среднем 4,5±2,1 (p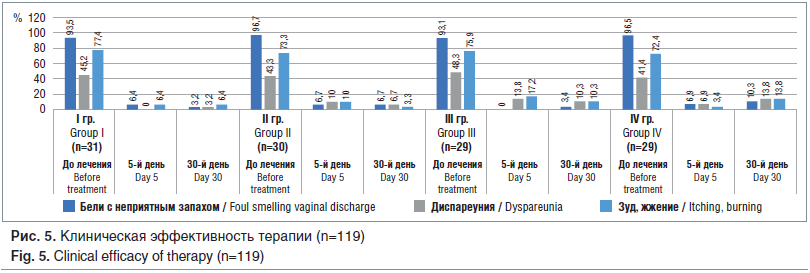
При бактериоскопической оценке вагинального дисбиоза по критериям Hay/Ison на 5-е сут после окончания лечения первая степень (норма) определялась у 87,1% пациенток I группы, у 76,7% II группы, у 86,3 и 82,8% III и IV групп соответственно (рис. 6). При этом на данном сроке мониторинга женщины с третьей степенью вагинального дисбиоза не были выявлены ни в одной из групп. На 30-й день после окончания терапии, как и субъективно-объективное исследование, оценка по критериям Hay/Ison показала практически те же данные (разница была статистически недостоверной, p>0,05).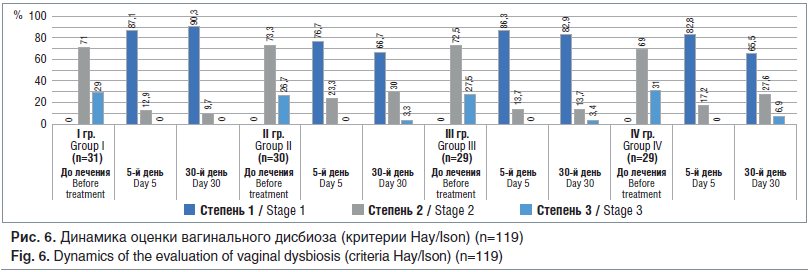
Вышеперечисленные изменения в субъективной и объективной симптоматике вагинального дисбиоза показывают высокую клиническую эффективность всех используемых в данном сравнительном исследовании лекарственных средств для местного лечения указанной патологии, при этом отмечена тенденция к большей эффективности комбинированного препарата, содержащего метронидазол и миконазол (Метромикон Нео®).
Микробиологическая эффективность
Оценка клинической эффективности лечения смешанных вагинальных дисбиозов методом ПЦР-РВ показала достоверное (p Gardnerella vaginalis (9,3±3,6%) и пятикратное — Atopobium vaginae (10,1±2,7%), а также уменьшение количества грибов Candida spp. (9,4±6,1%) и количества Г+ и Г– микрофлоры (рис. 7). Наиболее заметно уменьшилось количество факультативно-анаэробных микроорганизмов и условно-патогенных аэробов в I и III группах (препарат Метромикон-Нео® и клиндамицина фосфат соответственно). Но при этом в III группе наблюдался высокий процент обсемененности грибами Candida spp. (17,2%),
что потребовало дополнительного назначения антимикотиков.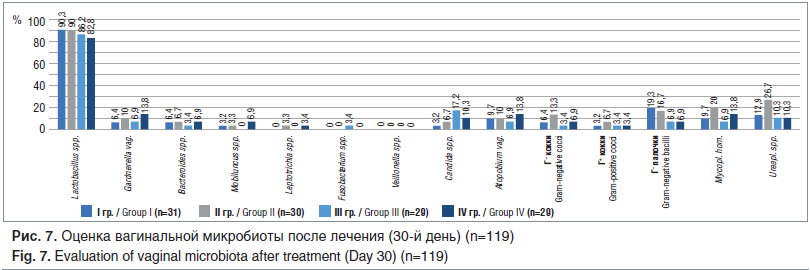
Беременность и роды
Согласно критериям включения в исследовании участвовали только те женщины, которые в течение 6 мес. после терапии смешанного вагинального дисбиоза реализовали свой репродуктивный потенциал в виде наступившей беременности. Проведенное наблюдение за пациентками, прошедшими преконцепционную подготовку, показало, что признаки вагинальных дисбиотических изменений во время беременности в I группе наблюдались у 12,9% женщин, во II — у 20,0%, в III — у 13,8% и в IV — у 17,2%. Ультразвуковые маркеры внутриутробного инфицирования были зарегистрированы у 9,7% беременных I группы, у 16,7% — II, у 17,2% — III и у 20,7% — IV группы. Признаки внутриутробного инфицирования отмечены у 6,4% новорожденных I группы, у 10,0% — II, у 6,9% — III и у 10,3% — IV группы.
Комплаентность
Системных побочных эффектов при использовании препаратов в ходе исследования не зарегистрировано. Приверженность пациенток терапии оценивали по шкале Мориски — Грин: 4 баллам соответствовали 87,1% пациенток I группы, 66,7% — II, 72,4% — III и 82,8% — IV группы (рис. 8). Наиболее часто встречались нежелательные эффекты: зуд, жжение во время местного применения препарата, вытекание его из влагалища, доставляющее неудобства женщине. При этом благодаря входящему в состав препарата Метромикон-Нео® компоненту Суппоцир АМ, обеспечивающему равномерное распределение препарата по слизистой влагалища, у принимавших его пациенток не зарегистрировано жалоб на вытекание содержимого, что говорит о большем удобстве его использования без помех для активной жизни.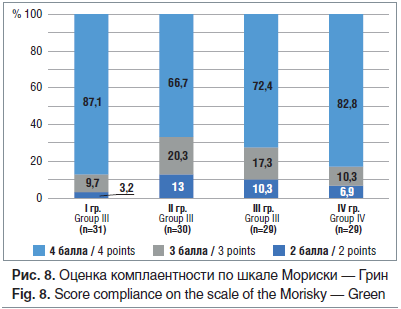
Заключение
Таким образом, в ходе проведенного сравнительного исследования выявлена высокая клиническая и микробиологическая эффективность комплексной терапии всеми местными лекарственными средствами при лечении пациенток с диагнозом «смешанная форма вагинального дисбиоза». Вместе с тем в данном исследовании наибольшая клиническая и микробиологическая эффективность зафиксирована при использовании комбинированного препарата, содержащего метронидазол и миконазол (Метромикон-Нео®). При его приеме отмечена наиболее высокая комплаентность, обусловленная присутствием в его составе компонента с высокими мукоадгезивными свойствами — Суппоцира АМ.
Сведения об авторах:
Боровиков Игорь Олегович — д.м.н., доцент, доцент кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0001-8576-1359;
Куценко Ирина Игоревна — д.м.н., профессор, заведующая кафедрой акушерства, гинекологии и перинатологии, ORCID iD 0000-0003-0938-8286;
Рубинина Эдита Рубеновна — аспирант кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0002-7599-2257;
Батмен Саида Казбековна — к.м.н., доцент кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0002-1790-444X;
Магай Антон Сергеевич — клинический ординатор кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0003-2910-8798.
ФГБОУ ВО КубГМУ Минздрава России, кафедра акушерства, гинекологии и перинатологии. 350063, Россия, г. Краснодар, ул. Седина, д. 4.
Контактная информация: Боровиков Игорь Олегович, e-mail: bio2302@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 30.04.2019.
About the authors:
Igor O. Borovikov — MD, PhD, Assistant Professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0001-8576-1359;
Irina I. Kutsenko — MD, Professor, Head of the Department of Obstetrics and Gynecology, ORCID iD 0000-0003-0938-8286;
Edita R. Rubinina — Graduate student, Department of the Obstetrics and Gynecology, ORCID iD 0000-0002-7599-2257;
Saida K. Batman — MD, PhD, Assistant Professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-1790-444X;
Anton S. Magai — Clinical resident of the Department of the Obstetrics and Gynecology, ORCID iD 0000-0003-2910-8798.
Kuban State Medical University, Department of Obstetrics and Gynecology. 4, Sedina str., Krasnodar, 350063, Russian Federation.
Contact information: Igor O. Borovikov, e-mail: bio2302@mail.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 30.04.2019.
Информация с rmj.ru

