Введение
Недавние зарубежные эпидемиологические исследования сообщили о глобальной распространенности неалкогольной жировой болезни печени (НАЖБП), равной 30%. В PubMed и Ovid MEDLINE проводился поиск популяционных исследований о НАЖБП с 1990 по 2019 г. Были оценены 92 исследования (n=9 361 716) и отмечен неуклонный рост частоты данного заболевания, что требует срочных и комплексных стратегий для повышения осведомленности и решения всех аспектов НАЖБП на местном, региональном и глобальном уровнях [1]. В Российской Федерации И.В. Маев и соавт. [2] в 2023 г. в работе с включением 5 исследований (n=96 680) продемонстрировали, что распространенность НАЖБП составила 27,56%. Отмечено, что в исследованиях с набором пациентов, проведенным до 2015 г., обобщенная частота НАЖБП составляет 22,41%, тогда как в работах с набором пациентов после 2015 г. — 35,87%. При анализе исключительно мультицентровых исследований обобщенная распространенность НАЖБП составляет 31,98%. Подобная тенденция отмечалась и в ранее проведенных анализах [3, 4].
Вместе с ростом распространенности исследователи по всему миру обращают внимание на возросшую смертность от осложнений заболевания (цирроз и гепатоцеллюлярная карцинома) равно, как и от заболеваний, отражающих метаболическую активность НАЖБП. Так, недавно были проанализированы данные когортного исследования Ранчо Бернардо (США) [5]. Период участия составил с 1992 по 1996 г. с наблюдением до июля 2019 г. НАЖБП определялась по повышенному индексу жировой дистрофии печени FLI (Fatty Liver Index) у многонационального населения США при отсутствии вторичных причин заболевания печени. Среди пациентов с НАЖБП и без НАЖБП было зарегистрировано 296 и 717 смертей от всех причин, 113 и 263 смерти от сердечно-сосудистых заболеваний, 62 и 112 смертей от рака и 6 и 2 смерти от печеночных осложнений соответственно. Смертность от всех причин при НАЖБП была на 26% выше, чем без НАЖБП. Смертность от сердечно-сосудистых заболеваний при НАЖБП была выше на 33% и от рака — на 55%. Доли, относящиеся к популяции, показали, что 13,9% смертей, 6,2% сердечных смертей и 12,1% смертей от рака были связаны с НАЖБП после корректировки факторов риска (малоподвижный образ жизни, ожирение, артериальная гипертензия (АГ), гиперлипидемия, сахарный диабет). Данные цифры отражают независимое влияние НАЖБП на увеличение смертности.
Убедительные результаты исследований говорят о том, что наиболее неблагоприятным фактором, обусловливающим высокую смертность при НАЖБП, является фиброз печени, развивающийся как компонент естественного течения заболевания в результате длительной липотоксичности и воспаления [6]. Особое значение данный факт приобретает в аспекте современного мультифакторного метаболически-ассоциированного патогенеза заболевания и недавнего пересмотра дефиниций заболевания, перехода от диагноза исключения (НАЖБП) к метаболически-ассоциированной жировой болезни печени (МАЖБП) как варианту стеатотической болезни печени (см. рисунок) [7]. Мы понимаем, что стеатоз печени, стеатогепатит и фиброз являются едиными патогенетическими процессами при воздействии разных факторов (ожирение, сахарный диабет 2 типа (СД2), алкоголь, вирусная инфекция и др.) и что их реализация в каждом конкретном случае будет зависеть от набора и возможного сочетания факторов формирования и прогрессирования заболевания [8].
![Рисунок. Современная классификация стеатотической болезни печени [7 с изменениями] Figure. Current classification of steatotic liver disease [7, with modifications] Рисунок. Современная классификация стеатотической болезни печени [7 с изменениями] Figure. Current classification of steatotic liver disease [7, with modifications]](https://medblog.su/wp-content/uploads/2025/01/Prediktivnaya-model-prognoza-formirovaniya-fibroza-pecheni-u-patsientov-s-metabolicheski-assotsiirovannoj.png)
Трудностью для клинициста в данной ситуации представляется то, что НАЖБП и МАЖБП не имеют типичных симптомов, по которым мы можем заподозрить прогрессирующее течение НАЖБП [9]. В то же время на данном этапе мы обладаем многими инструментами для оценки стадии фиброза, такими как неинвазивные патентованные (ФиброМакс) и непатентованные (FIB-4, ELF, BARD, NFS, APRI) расчетные модели, включающие прямые и непрямые биомаркеры фиброза [10]. Данные модели высоковоспроизводимы, доступны и, по данным крупных сравнительных исследований, сопоставимы с эталонными методами оценки — МРТ-эластографией и эластографией сдвиговой волны [11]. Однако проблему оценки прогноза увеличения стадии фиброза печени и, соответственно, роста неблагоприятных событий, ассоциированных с сопутствующими заболеваниями сердца, сосудов, билиарного тракта, данные модели не решают.
Очевидно, что необходим поиск ключевых клинико-лабораторных предикторов, легких для оценивания и в то же время информативных для определения прогрессирующего течения НАЖБП.
Цель исследования: для снижения риска прогрессирования печеночных осложнений НАЖБП (МАЖБП) разработать клинико-лабораторную прогностическую модель фиброза печени.
Содержание статьи
Материал и методы
Нами проведено открытое сравнительное исследование с участием пациентов в возрасте старше 18 лет с диагнозом НАЖБП (МАЖБП) [12, 13].
Задачи исследования:
-
Оценить фенотипическое разнообразие течения НАЖБП (МАЖБП) в исследуемой группе.
-
В открытом сравнительном исследовании оценить информативность данных расспроса, анамнеза, антропометрического исследования и лабораторных данных по формированию и прогрессированию фиброза печени у лиц с НАЖБП (МАЖБП).
-
Выявить предикторы прогрессирующего течения НАЖБП (МАЖБП).
-
На основании статистически значимых клинических и лабораторных параметров разработать прогностическую модель формирования фиброза печени у пациентов, страдающих НАЖБП (МАЖБП).
Пациенты подписывали информированное согласие. При обследовании мы исключали вирусные поражения печени, болезни накопления, аутоиммунный гепатит и др. Опираясь на измененные дефиниции НАЖБП, а также принимая во внимание, что исследуемая группа пациентов имела метаболически-ассоциированные нарушения (ожирение или избыточная масса тела, СД2, предиабет, критерии метаболического синдрома), мы диагностировали метаболически-ассоциированный вариант стеатотической болезни печени (steatotic liver disease, SLD) [14].
Исследуемая группа пациентов с МАЖБП включала 288 человек (158 (54,9%) мужчин и 130 (45,1%) женщин), средний возраст которых составил 50,9±10,8 года.
Все пациенты были обследованы с использованием стандартных лабораторных и инструментальных методов. Оценивали индекс массы тела (ИМТ), окружность талии (ОТ), объем бедер (ОБ) и отношение ОТ/ОБ. При оценке фиброза печени мы использовали неинвазивные непатентованные расчетные индексы, в частности FIB-4, и транзиентную эластометрию с функцией контролируемого параметра затухания ультразвукового сигнала (CAP). Для достижения цели и выполнения задач исследования сравнительная оценка была проведена в зависимости от наличия фиброза и его стадийности. Для достижения большей статистической мощности пациенты с фиброзом 2 и 3 стадии были объединены в одну группу. Также проводилась оценка наличия неалкогольного стеатогепатита (НАСГ) по результатам биохимического анализа диагностированных синдромов цитолиза и холестаза. Оценка этих случаев проводилась нами и при просмотре амбулаторной карты пациента, т. е. опираясь и на историю болезни.
Обработка результатов исследования и графический анализ данных проводились при помощи программ пакета Microsoft 2010. Статистическая обработка полученных результатов проводилась с использованием программного пакета SPSS (версия 13.0). Статистический анализ выполнен в рамках FWNR-2024-0002. Проверка нормальности распределения проводилась с использованием критерия Колмогорова — Смирнова. В зависимости от характера распределения показатели представлены в виде среднего ± стандартное отклонение или в виде медианы (Me) и межквартильного размаха [Q1–Q3], для категориальных переменных — в виде абсолютных и относительных значений (n (%)). Для сравнения двух независимых выборок использовался непараметрический критерий Манна — Уитни, для сравнения более двух независимых выборок — критерий Краскела — Уоллиса. Для сравнения долей были применены точный двусторонний критерий Фишера и критерий χ2 Пирсона. Ассоциации оценивались с помощью однофакторного и множественного логистического регрессионного анализа, выполненного при следующих условиях: зависимая переменная является дихотомической (наличие/отсутствие фиброза); независимость наблюдений; отсутствие мультиколлинеарности (т. е. ситуаций, когда независимые переменные сильно коррелируют друг с другом (r>0,7)); линейная зависимость между каждой независимой переменной и логарифмом отношения шансов (логарифмические коэффициенты); независимость остатков. Результаты множественного логистического регрессионного анализа были представлены как отношение шансов (ОШ) и 95% доверительный интервал (ДИ) для ОШ. Критический уровень значимости нулевой гипотезы (p) был принят равным 0,05.
Результаты и обсуждение
При выполнении эластометрии благодаря функции CAP у всех пациентов была оценена степень стеатоза, отражающая процент печени, затронутой жировым перерождением, выраженная в процентном отношении к здоровой ткани. Так, 1 степень стеатоза соответствует значениям CAP до 260 дБ/м, что означает, что в данном случае от 11 до 33% печени затронуто стеатозом, и далее по возрастающей [15]. Пациенты с МАЖБП почти в половине случаев демонстрировали начальную степень стеатоза и распределились по степени стеатоза следующим образом: 1 степень стеатоза — 139 (48,2%) пациентов, 2 степень — 62 (21,7%) и 3 степень — 87 (30,1%). При этом значения индекса стеатоза (ST-index) составили 1,643 [1,337–1,948] и находились в диапазоне от минимального значения 0,462 до максимального 3,294, что соответствовало высокой степени стеатоза и липотоксичности.
Показатель FIB-4 соответствовал 0,8 [0,6–1,3], что указывало в целом на отсутствие значимого фиброза печени в группе больных МАЖБП. По данным эластометрии фиброз печени был выявлен в половине случаев: фиброз 1 стадии диагностирован у 111 (38,5%) пациентов, 2–3 стадии — у 63 (21,9%) пациентов.
Выявлено 137 (47,6%) пациентов с МАЖБП и признаками воспаления. Количество выявленных случаев воспаления возрастает у пациентов с фиброзом печени. НАСГ среди пациентов с МАЖБП без фиброза диагностирован у 36 (31,6%) пациентов, с фиброзом 1 стадии — у 59 (53,2%) пациентов, а с фиброзом 2–3 стадии НАСГ страдают 39 (61,9%) пациентов (p<0,0001).
На момент осмотра изменения в биохимическом анализе в виде подъема уровня аланинаминотрансферазы (АЛТ) выявлены у 32 (28,1%) пациентов без фиброза и 75 (43,1%) — с фиброзом, подъем уровня аспартатаминотрансферазы (АСТ) — у 14 (12,3%) без фиброза и 46 (26,4%) с фиброзом. Результаты анализа синдрома холестаза выглядят следующим образом: превышение уровня щелочной фосфатазы (ЩФ) у 18 (30%) и 36 (43,9%), превышение уровня γ-глутамилтранспептидазы (ГГТП) у 41 (36%) и 81 (46,6%) соответственно, причем для показателей АЛТ и АСТ представленные различия были существенными.
В большинстве случаев пациенты обращались за медицинской помощью с жалобами со стороны других систем и органов (костно-мышечной, сердечно-сосудистой) или были направлены смежными специалистами в связи с персистирующими изменениями в биохимическом анализе крови (подъем уровня трансаминаз), что логично, так как патогномоничных жалоб со стороны МАЖБП нет, однако учет жалоб со стороны желудочно-кишечного тракта важен для оценки прогрессирования заболевания. При активном расспросе пациенты отмечали жалобы со стороны правого подреберья и билиарного тракта, а также общие жалобы. Жалобы на боли в правом подреберье давящего характера, ассоциированные с гепатомегалией и выявленной сопутствующей желчнокаменной болезнью (ЖКБ), предъявляли 118 (40,9%) пациентов, на дискомфорт в этой же области — 101 (35,1%) пациент. Также пациенты отмечали отрыжку воздухом после приема пищи в 76 (26,4%) случаях, горечь во рту в 114 (39,6%) случаях, повышенную утомляемость в 88 (30,6%) случаях и общую слабость в 89 (30,9%) случаях соответственно [13]. Частота выявленных жалоб с указанием их субъективной интенсивности в зависимости от стадии фиброза представлена в таблице 1.
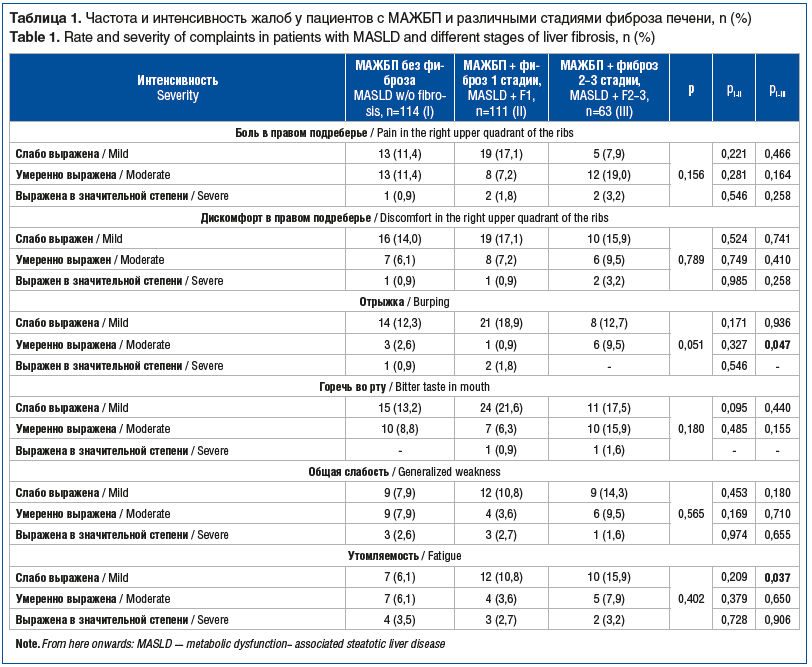
Обращает на себя внимание то, что пациенты с прогрессирующими стадиями фиброза печени статистически значимо чаще отмечали жалобы на отрыжку и утомляемость.
Средняя продолжительность болезни по результатам анализа амбулаторных карт составила 2 года (24 мес.). При этом пациенты с МАЖБП и фиброзом печени закономерно имели статистически значимо длительную историю болезни: 18 [12–48] мес. у пациентов без фиброза и 24 [12–60] мес. при его наличии (p<0,05).
Наиболее часто встречающимися сопутствующими заболеваниями в исследуемой группе оказались: ЖКБ — у 140 (48,6%) пациентов; АГ — у 209 (72,6%) пациентов; нарушения углеводного обмена (СД2 у 47 (16,3%) пациентов и предиабет у 65 (22,6%) пациентов) и липидного обмена (дислипидемия у 212 (73,6%) пациентов), а также хронический метаболический панкреатит без признаков внутри- и внешнесекреторной недостаточности — у 173 (60,1%) пациентов. Примечательно, что распространенность данных нозологий статистически значимо возрастала при увеличении стадии фиброза, что представлено в таблице 2.
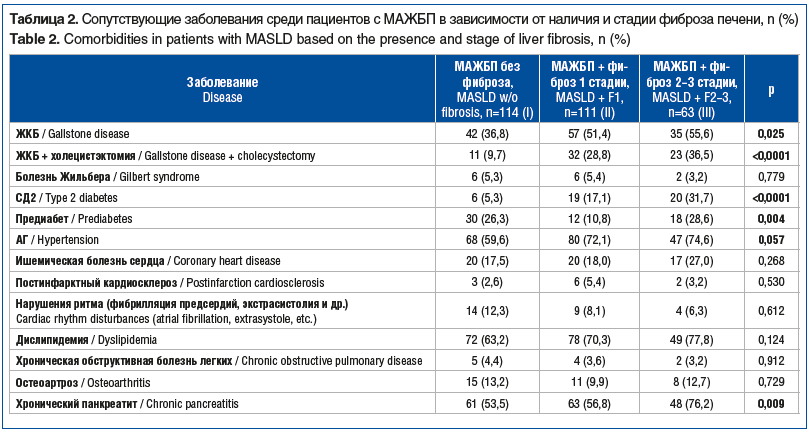
Наша исследуемая группа пациентов с МАЖБП была представлена в большинстве своем лицами с ожирением и избыточной массой тела. Средний ИМТ составил 32,9±4,6 кг/м2 (минимальное значение — 21,7 кг/м2, максимальное значение соответствовало морбидному ожирению и равнялось 49,5 кг/м2). По характеру распределение жировой ткани соответствовало абдоминальному ожирению (ОТ/ОБ 1,1±0,09). Отмечалась статистически значимо большая масса тела и ИМТ у пациентов с фиброзом 1 стадии в сравнении с его отсутствием или, напротив, прогрессией (ИМТ для пациентов без фиброза составил 31,6 [28,7–35,0] кг/м2, для пациентов с фиброзом 1 стадии — 33,6 [30,5–36,4] кг/м2 и для пациентов с фиброзом 2–3 стадии — 32,7 [29,7–36,5] кг/м2 (p<0,001). Тенденцию к возрастанию в зависимости от степени фиброза также имел показатель ОТ, равно как и показатель ОТ/ОБ. При этом значимость увеличивалась по мере выраженности фиброза: медиана ОТ 102,5 [99,7–110] см для пациентов без фиброза, 105 [100–112] см для пациентов с фиброзом 1 стадии и 108 [100–116] см — с фиброзом 2–3 стадии, ОТ/ОБ 1,01 [0,9–1,04], 1,03 [0,95–1,08] и 1,03 [1,01–1,08] соответственно (p<0,001 при сравнении отсутствия фиброза и 1 стадии; p<0,001 при сравнении отсутствия фиброза и 2–3 стадии).
Рутинные показатели общего и биохимического анализа крови представлены в таблице 3.
![Таблица 3. Сравнительный анализ показателей общего и биохимического анализа крови у пациентов с МАЖБП в зави- симости от наличия фиброза и его стадии, Me [Q1–Q3] Table 3. Comparative analysis of CBC and blood biochemistry parameters in patients with MASLD Таблица 3. Сравнительный анализ показателей общего и биохимического анализа крови у пациентов с МАЖБП в зави- симости от наличия фиброза и его стадии, Me [Q1–Q3] Table 3. Comparative analysis of CBC and blood biochemistry parameters in patients with MASLD](https://medblog.su/wp-content/uploads/2025/01/1737363478_224_Prediktivnaya-model-prognoza-formirovaniya-fibroza-pecheni-u-patsientov-s-metabolicheski-assotsiirovannoj.png)
Статистически значимыми для индукции фиброза оказались повышение уровня общего холестерина, триглицеридов и общего билирубина, а также показатели биохимической активности синдрома цитолиза (АЛТ и АСТ) с преобладанием увеличения АЛТ над АСТ. При сравнительной оценке показателей среди пациентов с МАЖБП и разными стадиями фиброза статистическую значимость продемонстрировали показатели глюкозы натощак, АЛТ и общего белка — их повышение ассоциировалось с прогрессированием фиброза. С учетом того, что пациенты ввиду наличия сопутствующей патологии получали специализированную терапию для коррекции липидного спектра и уровня глюкозы, мы провели сравнительную оценку частоты приема соответствующих препаратов в группах сравнения. Статистически значимо чаще отмечался прием метформина с увеличением стадии фиброза (16 (14%) без фиброза и 23 (20,7%) с 1 стадией, 32 (50,8%) с 2–3 стадией, p<0,0001), что соответствует результатам распространенности СД2 и предиабета в соответствующей группе. Коэффициент корреляции (r) между приемом метформина и стадией фиброза — 0,290 (p<0,0001), между приемом статинов и стадией фиброза r=0,074 (p=0,213). В дальнейшем прием статинов и метформина нами был учтен при построении регрессионных моделей.
Все выявленные при сравнительном анализе показатели, имеющие статистически значимое различие среди пациентов с МАЖБП в зависимости от наличия и стадии фиброза печени, были последовательно включены в логистический регрессионный анализ для оценки шанса предиктивного потенциала в отношении фиброза печени. Результаты однофакторной и многофакторной логистических регрессионных моделей с учетом возраста и пола представлены в таблице 4.
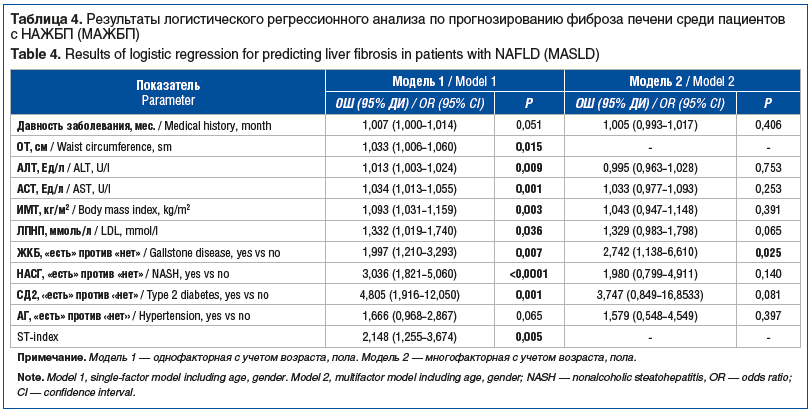
В однофакторной модели практически все показатели, по которым отмечалась статистически значимая разница в группах, продемонстрировали свой предиктивный потенциал. Наибольшее влияние оказывало наличие СД2, которое в 4 раза увеличивало риск развития фиброза, и ST-index, увеличивающий риск в 2,1 раза при увеличении этого индекса на 0,1. Однако в многофакторной модели после оценки кофакторов сохранили свое независимое влияние на риск развития фиброза печени следующие показатели: ЛПНП — в 1,3 раза, наличие ЖКБ — в 2,7 раза и СД2 — в 3,7 раза соответственно. Чувствительность данной модели составила 83,3%, специфичность — 49%, показав общий предиктивный потенциал на данной исследуемой группе 70,9%, что демонстрирует направленность модели на выявление как можно раньше и как можно больше лиц высокого риска по формированию фиброза печени, а значит, и соответствует целям и задачам настоящего исследования. Так как в обе модели логистической регрессии входили количественные показатели, которые требуют четкого понимания границ значений, после которых риск развития и прогрессирования фиброза будет увеличиваться, то мы провели регрессионный анализ с категоризацией данных. В качестве независимых показателей в модель были внесены показатели общего холестерина выше/ниже 5,2 ммоль/л, ОТ больше/меньше 102/88 в зависимости от пола. По результатам анализа выявлено, что среди пациентов с НАЖБП (МАЖБП) статистически значимое независимое влияние (p<0,05) на риск развития фиброза печени оказывают возраст, пол, ОТ, уровень общего холестерина, наличие НАСГ, ЖКБ и СД2. Риск развития фиброза увеличивается на 2% при увеличении возраста на 1 год (ОШ 1,017, 95% ДИ 0,989–1,046), у лиц мужского пола по сравнению с женщинами риск фиброза печени увеличивается в 2 раза (ОШ 2,086, 95% ДИ 1,123–3,872), при ОТ больше 102/88 см — в 2,8 раза (ОШ 2,766, 95% ДИ 1,300–5,887), при уровне общего холестерина выше 5,2 ммоль/л по сравнению с менее чем 5,2 ммоль/л риск увеличивается в 1,9 раза независимо от приема статинов (ОШ 1,867, 95% ДИ 1,073–3,248). Наличие стеатогепатита, оцененного по результатам биохимического анализа, увеличивает риск фиброза в 2,7 раза (ОШ 2,729, 95% ДИ 1,556–4,784), наличие СД2 — в 4,5 раза (ОШ 4,527, 95% ДИ 1,715–11,946) и наличие ЖКБ — в 2 раза (ОШ 2,160, 95% ДИ 1,355–4,033). Данная модель оказалась более чувствительной с сохранением при этом ее общей мощности и специфичности. Чувствительность составила 82,7%, специфичность — 50,9%, общий предиктивный потенциал в данной исследуемой группе — 70,1%.
Известно, что патогномоничных симптомов стеатотической болезни печени, в том числе НАЖБП и МАЖБП, в доцирротической стадии нет. В связи с этим сбор жалоб и анамнеза заболевания и жизни должен быть выполнен в рамках стандартного обследования и диагностики цирроза при соответствующих проявлениях [16]. Пациенты могут демонстрировать ряд синдромокомплексов, таких как диспепсический, астенический и болевой, ассоциированных с гепатомегалией, что, однако, требует исключения сопутствующей патологии желчного пузыря, в частности билиарного тракта. Так, в нашем исследовании пациенты с фиброзом чаще жаловались на отрыжку воздухом после еды и повышенную утомляемость, что, однако, не показало при дальнейшей оценке прогностического потенциала.
С учетом метаболически-ассоциированного генеза заболевания имеет значение информация о сопутствующей патологии, особенно данные об ожирении и СД2, которые по результатам метаанализа около 20 исследований были ассоциированы с более чем двукратным увеличением риска развития тяжелого течения заболевания печени [17]. Действительно, липотоксичность, гиперинсулинемия и инсулинорезистентность среди других факторов являются ведущими по индукции воспаления [18]. По результатам нашего исследования практически все пациенты страдали избытком массы тела или ожирением. СД2 оказался в ряду наиболее распространенных патологий среди пациентов с фиброзом 2 и 3 стадии, а в регрессионной модели продемонстрировал положительный предиктивный потенциал по выявлению прогрессирования фиброза. По результатам нашего исследования СД2 более чем в 4 раза увеличивал риск появления фиброза печени и его прогрессирования.
Согласно определению Всемирной гастроэнтерологической организации и Международной федерации хирургии ожирения и метаболических заболеваний (International Federation for the Surgery of Obesity and Metabolic Disorders, IFSO) ожирение — это заболевание, характеризующееся накоплением подкожного и/или висцерального жира в такой степени, что это может привести к органной дисфункции и другим формам патологии. Согласно европейским рекомендациям по ведению пациентов с ожирением, если при скрининге выявлен ИМТ 25–30 кг/м2, то необходимо провести оценку ОТ и стеатоза печени. Если скрининг выявил ожирение (ИМТ>30 кг/м2) или избыточную массу тела плюс увеличение ОТ, следует провести оценку заболеваний, связанных с ожирением, включая выявление резистентности к инсулину и слабовыраженного воспаления [19]. То есть, кроме оценки ИМТ и массы тела, также важно оценить и метаболический статус пациента, т. е. уровень метаболического здоровья, опираясь на диагностику абдоминального типа распределения жировой ткани. Наше исследование, согласуясь с современной концепцией, показало, что увеличение ОТ оказывает независимое негативное влияние на прогрессирование заболевания и вошло в регрессионную модель как показатель, обладающий положительным предиктивным потенциалом.
Полученную тесную взаимосвязь ОТ и фиброза можно объяснить гиперпродукцией и нарушением соотношения гормонов и индукторов воспаления и/или фиброгенеза в висцеральной жировой ткани [20]. Прежде всего неблагоприятные события ассоциированы с формированием гиперлептинемии и лептинорезистентности, гипоадипонектинемии, что мы подчеркивали в своих предыдущих исследованиях пациентов с НАЖБП [13, 21].
Вместе с тем имеются неоспоримые эпидемиологические данные о высоком риске прогрессирования НАЖБП у пациентов с нормальной массой тела. Например, в анализе 10 когортных исследований с участием 109 151 пациента с НАЖБП выявлено, что у данных пациентов при нормальной массе тела и при ожирении имелись сопоставимые риски смертности от всех причин (отношение рисков (ОР) 1,09, 95% ДИ 0,66–1,90), от сердечно-сосудистой патологии (ОР 1,12, 95% ДИ 0,66–1,90) и от осложнений со стороны печени, включая декомпенсированный цирроз и гепатоцеллюлярную карциному (ОР 0,81, 95% ДИ 0,50–1,30) [22]. Однако риск смертности, ассоциированный с постепенной утратой функций печени ввиду развития фиброза и цирроза, был выше у пациентов с НАЖБП и нормальной массой тела, чем с ожирением (ОР 1,88, 95% ДИ 1,02–3,45). Полученные данные легли в основу разработки Американской ассоциацией гастроэнтерологов клинических рекомендаций по ведению пациентов с НАЖБП и нормальной массой тела (среди худых пациентов), где подчеркивается важность регулярного обследования данной категории лиц на наличие сопутствующих заболеваний, таких как СД2, дислипидемия и АГ, и проведения оценки фиброза печени с использованием существующих неинвазивных методик, чтобы выявить лиц с прогрессирующим фиброзом или циррозом печени [22]. Таким образом, развитие стеатоза печени у пациента без ожирения не может быть расценено как «благоприятное событие», а использование концепции МАЖБП с оценкой метаболических нарушений представляется подходящим.
Представляет интерес сочетание ЖКБ и МАЖБП. С одной стороны, нас не удивляет нарушение желчепродукции и состава желчи при заболеваниях печени, особенно на фоне гипертриглицеридемии и гипер- и дислипидемии, так как ЖК являются конечным продуктом метаболизма холестерина в гепатоците и их биосинтез — один из важных путей выведения холестерина. С другой стороны, ЖК воздействуют на сигнальные пути, в том числе на фарнезоидный X-рецептор (FXR), экспрессируемый в кишечнике в процессе энтерогепатической циркуляции. FXR, в свою очередь, действует как датчик повышенного уровня ЖК и инициирует гомеостатические реакции для контроля их уровня, а также модулирует другие метаболические процессы, такие как глюконеогенез и липогенез [23]. Данный процесс иллюстрирует тесное взаимодействие кишечника и печени — энтерогепатоцентризм, концепция которого была разработана группой российских ученых под руководством Л.Б. Лазебника [24]. В модели энтерогепатоцентризма печень рассматривается как центральный орган, обеспечивающий стабильную работу всех звеньев метаболического гомеостаза. ЖК в данной модели являются функциональным слоем кишечного барьера и выступают в роли «клининговой системы», предотвращая рост патогенных микроорганизмов и развитие системного воспаления и одновременно обладая метаболической активностью. Помимо уже упомянутых механизмов влияния на метаболизм глюкозы и липидов, также установлено влияние ЖК на обмен тиреоидных гормонов и дифференцировку адипоцитов. Так, TGR5, мембранный рецептор ЖК, был обнаружен в бурой жировой ткани. Оказалось, что в преадипоцитах ЖК могут не только изменять метаболизм, но и способствовать их дифференцировке в зрелые жировые клетки. А литохолевая и таурохолевая кислоты являются наиболее мощными активаторами дейодиназы-2 в бурой жировой ткани — фермента, локализующегося в эндоплазматическом ретикулуме около ядра и ответственного за превращение Т4 в более активный Т3 [25].
Вышеописанные патогенетические механизмы объясняют более частое развитие ЖКБ среди пациентов, страдающих НАЖБП, и прогрессирующее течение заболевания печени при наличии патологии желчного пузыря и после его хирургического удаления. Результаты исследований демонстрируют двунаправленную взаимосвязь данных заболеваний [26]. Проспективное когортное исследование с участием пациентов с НАЖБП (n=15 000) с использованием данных Third National Health and Nutrition Examination Survey (NHANES III) и с периодом наблюдения около 23,2 года продемонстрировало, что ЖКБ и холецистэктомия были независимо связаны с НАЖБП (ОШ 1,75, 95% ДИ 1,43–2,15 для ЖКБ; ОШ 2,77, 95% ДИ 2,01–3,83 для холецистэктомии по сравнению с отсутствием ЖКБ). Также ЖКБ ассоциировалась с более высоким риском смертности от всех причин среди пациентов с НАЖБП (ОР 1,19, 95% ДИ 1,05–1,37), и в частности с повышением смертности от сердечно-сосудистых заболеваний (ОР 1,36, 95% ДИ 1,05–1,77) [27]. В нашем исследовании мы также получили результаты, свидетельствующие о высокой распространенности ЖКБ среди пациентов, страдающих МАЖБП (36,8% в целом по группе и более 55% среди пациентов с фиброзом 2 стадии и выше), и ее влиянии как предиктора развития и прогрессирования фиброза, увеличивающего данный риск в 2 раза. Настоящие данные согласуются и с ранее полученными сведениями об ассоциации ЖКБ и холецистэктомии при НАЖБП с более неблагоприятным течением заболевания и о высоком кардиоваскулярном риске среди пациентов данной подгруппы [28].
Относительно лабораторных показателей активности НАЖБП установлено, что цитолиз описывается у 50–90% больных НАСГ, а активность АЛТ часто бывает выше, нежели активность АСТ. Реже обнаруживаются признаки синдрома холестаза. Однако степень гипертрансаминаземии не коррелирует с выраженностью стеатоза и фиброза печени. По результатам некоторых исследований, уровень АЛТ, наряду с другими метаболическими факторами, является показателем инсулинорезистентности, что предполагает возможность использования этого показателя в качестве дополнительного маркера у пациентов с данным отклонением. Пониженный уровень АЛТ в сыворотке крови в сочетании с высоким ИМТ может свидетельствовать о вероятном наличии тяжелого фиброза при НАСГ. Отсутствие изменений лабораторных показателей, характеризующих функциональное состояние печени (АЛТ, АСТ, ЩФ, ГГТ), не исключает наличия воспалительно-деструктивного процесса и фиброза [29]. Ввиду отсутствия универсального биомаркера воспаления в печеночной ткани «золотым стандартом» оценки воспаления при стеатотической болезни печени является биопсия [30]. Вместе с тем биопсию печени нельзя признать методом рутинной оценки изменений или динамического наблюдения. Поэтому сохраняется актуальность использования маркеров цитолиза и холестаза в моделях определения стадии фиброза и прогностических индексов. В нашей модели мы предположили наибольшую значимость не количественной оценки показателей в сравнении с нормой, а подъема уровня маркеров в биохимическом анализе, независимо от времени обследования и проводимой терапии.
Важным и интересным результатом для нас было обнаружение прогностической значимости повышения уровня липопротеинов низкой плотности и общего холестерина для оценки риска прогрессирования фиброза печени при МАЖБП, учитывая тот факт, что треть пациентов исследуемой группы по показаниям принимали статины, а следовательно, речь идет о недостижении целевых значений и важности модификации терапии данной категории пациентов. В европейских рекомендациях по ведению пациентов с циррозом печени статины включены для профилактики прогрессирования цирротических изменений [31]. Многие исследования были посвящены безопасности использования статинов при НАЖБП, и на сегодняшний день их выводы сходятся в том, что при адекватном применении гиполипидемической терапии удается добиться нормализации липидного профиля без токсичности [32]. Вместе с тем важность достижения целевых значений уровня холестерина и липопротеинов в лечении дислипидемии обусловлена и снижением риска развития фатальных и нефатальных сердечно-сосудистых заболеваний среди пациентов с НАЖБП (МАЖБП), увеличение количества которых, в свою очередь, ассоциировано с выраженностью фиброза печени [33, 34]. Полученные данные вторят и действующим рекомендациям по коррекции нарушений липидного обмена, подчеркивающим необходимость двух- и трехкомпонентной терапии, включая статины, эзетемиб и препараты, воздействующие на пропротеинконвертазу субтилизин-кексинового типа 9 (PCSK9) [35].
Заключение
По результатам проведенного исследования, диагностически значимыми клинико-лабораторными признаками прогрессирующего течения МАЖБП были жалобы на отрыжку воздухом, длительный анамнез заболевания, сопутствующие заболевания ЖКБ, СД2 и АГ, абдоминальное ожирение, признаки биохимической активности заболевания (цитолиз) и нарушений углеводного обмена, а также дислипидемия и гипертриглицеридемия. Результаты регрессионного анализа показали, что среди пациентов с НАЖБП (МАЖБП) статистически значимое независимое влияние на риск развития фиброза печени оказывают возраст, пол, ОТ, уровень общего холестерина, наличие НАСГ, ЖКБ и СД2. Разработанная модель расчета индивидуального риска прогрессирования заболевания на основе вышеперечисленных показателей с чувствительностью 82,7% и специфичностью 50,9% помогает выявить лиц с высоким риском увеличения стадии фиброза печени.
СВЕДЕНИЯ ОБ АВТОРАХ:
Кролевец Татьяна Сергеевна — к.м.н., доцент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-7452-7230.
Ливзан Мария Анатольевна — д.м.н., профессор, член-корреспондент РАН, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017.
Сыровенко Мария Ильинична — аспирант кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-6300-367X.
Щербакова Лилия Валерьевна — заслуженный ветеран СО РАН, старший научный сотрудник НИИТПМ — филиала ИЦиГ СО РАН; 630089, Россия, г. Новосибирск, ул. Бориса Богаткова, д. 175/1; ORCID iD 0000-0001-9270-9188.
Контактная информация: Кролевец Татьяна Сергеевна, e-mail: mts-8-90@mail.ru.
Источник финансирования: работа подготовлена в рамках гранта Российского научного фонда № 22-75-00014 (соглашение № 22-75-00014 от 27 июля 2022 г.), https://rscf.ru/project/22-75-00014/.
Конфликт интересов отсутствует.
Статья поступила 08.04.2024.
Поступила после рецензирования 06.05.2024.
Принята в печать 31.05.2024.
ABOUT THE AUTHORS:
Tatyana S. Krolevets — C. Sc. (Med.), associate professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-7452-7230.
Maria A. Livzan — Dr. Sc. (Med.), Professor, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Faculty Therapy and Gastroenterology, rector, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Maria I. Syrovenko — postgraduate student of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-6300-367X.
Liliya V. Shcherbakova — Honored Veteran of the Siberian Department of the RAS, senior researcher, Research Institute of Therapy and Preventive Medicine — Branch of the Institute of Cytology and Genetics of the Siberian Branch of the RAS; 175/1, Boris Bogatkov str., Novosibirsk, 630089, Russian Federation. ORCID iD 0000-0001-9270-9188.
Contact information: Tatyana S. Krolevets, e-mail: mts-8-90@mail.ru.
Financial Disclosure: work was prepared under the Russian Science Foundation grant No. 22-75-00014 (agreement No. 22-75-00014 dated July 27, 2022), https://rscf.ru/project/22-75-00014/.
There is no conflict of interest.
Received 08.04.2024.
Revised 06.05.2024.
Accepted 31.05.2024.
Информация с rmj.ru






