Введение
Проблема послеоперационных инфекционно-воспалительных осложнений является одной из центральных во всех областях хирургии. Общеизвестна закономерность: чем тяжелее пациент и больше объем вмешательства, тем выше вероятность и хуже прогноз послеоперационных осложнений. Онкохирургия, с этой точки зрения, находится в особо невыгодном положении. Высокая частота обширных и сочетанных органоуносящих операций сочетается с иммунодефицитом практически у всех больных, страдающих злокачественными новообразованиями. Неоадъювантная химиотерапия (НАХТ), во многих случаях позволяющая уменьшить размеры опухоли и сделать ее операбельной, закономерно усиливает исходный иммунодефицит [1, 2].
Доказано, что НАХТ приводит к значительному снижению количества лимфоцитов CD4+, CD8+ и NK-клеток, создавая состояние глубокой иммуносупрессии [3, 4]. Это подтверждается клиническими наблюдениями о повышении частоты инфекционных осложнений у пациентов, получавших НАХТ [5]. В связи с этим частота самых тяжелых послеоперационных инфекционно-воспалительных осложнений (пневмонии, сепсиса, перитонита) в этой области хирургии высока.
По данным S. Fan et al. [6] и M. Chughtai et al. [7], совокупная частота послеоперационной пневмонии после гастрэктомии по поводу рака желудка составляет 10,2%. Данные метаанализа и крупных когортных исследований в торакальной онкохирургии показывают, что после лобэктомии и пневмонэктомии по поводу рака легкого частота послеоперационной пневмонии составляет в среднем 5–15% [8]. Наиболее частым осложнением панкреатодуоденэктомии является панкреатическая фистула, в то время как послеоперационная пневмония остается значимой проблемой при этих вмешательствах, увеличивающей сроки госпитализации и смертность. Частота ее развития составляет от 2 до 8% [9]. Это довольно значительные величины, так как в общей (неонкологической) хирургии частота подобного рода осложнений в 1,5 раза меньше [7]. Многочисленные исследования подтверждают существенные различия в профиле безопасности хирургических вмешательств между пациентами с онкологическими и неонкологическими заболеваниями. Согласно имеющимся данным у последней категории больных отмечается статистически значимое снижение частоты развития послеоперационных пневмоний. Указанная закономерность находит отражение в современных прогностических алгоритмах, разрабатываемых для различных направлений хирургии. В частности, в работе X. Jin et al. [10] представлена номограмма для оценки вероятности легочных осложнений после микрохирургических вмешательств по поводу церебральных опухолей. Схожий методический подход реализован в ретроспективном исследовании D. Xie et al. [11], где разрабатывалась предиктивная модель для оценки риска пневмоний после спинальных операций.
Помимо респираторных осложнений, исследователи отметили положительную динамику по другому значимому показателю — 90-дневной летальности. При доброкачественной природе заболевания отмечалась устойчивая тенденция к ее снижению, что дополнительно подтверждает различия в течении послеоперационного периода у сравниваемых групп пациентов [12].
Совершенствование хирургических методик и сопроводительной терапии не дало существенного уменьшения частоты послеоперационных осложнений у онкологических пациентов. Во многом это связано с параллельной тенденцией к расширению показаний к противоопухолевому лечению, особенно хирургическому. Важной особенностью пациентов онкологического профиля является склонность к затяжному течению воспалительных процессов, часто с низкой активностью, что связано с комплексом факторов, включая иммунное истощение [13], формирование биопленок [14] и нутритивный дефицит [15]. На практике эта склонность нередко трансформируется в очень сложную, почти нерешаемую проблему.
Современная фармакология предлагает несколько принципиально разных подходов к решению проблемы сверхрезистентности возбудителя, среди которых совершенствование защиты препарата от ферментативной инактивации, создание более активных представителей в рамках одной фармакологической группы. Однако существуют и нестандартные решения, которые заслуживают самого пристального внимания.
В 2024 г. зарегистрирован новый препарат отечественного производства — фтортиазинон, в основе фармакологического эффекта которого лежит подавление вирулентности возбудителей (способности вызывать патологический процесс), однако напрямую он не вмешивается в жизненный цикл бактерий, то есть не является ни бактерицидным препаратом, ни бактериостатиком. Мишенью считается консервативный фактор вирулентности большого круга грамотрицательных патогенных бактерий — система секреции III типа (ген T3SS, Type three secretion system), которая отсутствует у представителей нормальной микрофлоры [16]. Отсюда следует избирательность эффекта относительно патогенных штаммов. Определение конкретной мишени — вышеупомянутого гена T3SS требует проведения полимеразной цепной реакции (ПЦР), что в условиях рутинной клинической практики может быть ограничено. Поэтому в большинстве случаев обоснованием для назначения фтортиазинона служит эмпирический подход, основанный на данных о локальной эпидемиологии и высокой распространенности T3SS-позитивных возбудителей в структуре нозокомиальных инфекций.
Опыт клинического применения данного антивирулентного препарата в настоящее время в значительной степени ограничен данными регистрационных исследований, однако появляющиеся научные публикации позволяют детализировать потенциальные ниши его применения и механизмы действия, что находит отражение в ряде последних исследований. Работа В.Б. Белобородова и соавт. [17] свидетельствует об эффективности цефепима в комбинации с антивирулентным препаратом при осложненных инфекциях мочеполовых путей. Показано достоверное превосходство комбинации указанных препаратов как по показателю клинического излечения, так и по уровню микробиологической эрадикации. Но выводы не могут распространяться на пациентов онкологического профиля. Это связано не только с малым размером выборки в исходном исследовании, но и с принципиальными отличиями в иммунном статусе и спектре возбудителей.
Перспективы применения фтортиазинона могут распространяться на инфекции дыхательных путей, о чем свидетельствуют данные о его способности подавлять биопленкообразование у Klebsiella pneumoniae и эффективности в экспериментальной модели пневмонии [18]. Критически важным нюансом этих данных является то, что активность была подтверждена в профилактическом режиме. В связи с этим для оценки реального клинического потенциала препарата требуется установить его эффективность в рамках терапевтической схемы на фоне развившейся инфекции, а также изучить возможности комбинирования с классической антибактериальной терапией (АБТ).
Данный антивирулентный препарат, наряду с терапией бактериофагами и моноклональными антителами, относится к категории нетрадиционных противомикробных агентов, что подтверждается его упоминанием в обзоре L.T. Romanos et al. [19] в контексте клинических исследований против Pseudomonas aeruginosa. Это позволяет позиционировать стратегию комбинирования фтортиазинона с карбапенемами как актуальную и соответствующую общемировому направлению поиска новых решений в антимикробной терапии. Работа А. Slonov et al. [20] значительно углубляет представления о механизме действия. Помимо известного ингибирования T3SS, препарат нарушает сборку и функцию жгутиков, что приводит к подавлению подвижности у грамотрицательных бактерий. Поскольку жгутиковая активность необходима для первичной адгезии, хемотаксиса и формирования биопленки (например, у P. aeruginosa и Escherichia coli), можно заключить, что фтортиазинон обладает поливалентным антивирулентным профилем, одновременно блокируя несколько независимых патогенных механизмов. В свете этих данных первостепенной задачей становится перевод полученных результатов в плоскость in vivo для оценки реального терапевтического вклада подавления подвижности в комплексной эффективности препарата.
Несмотря на подтвержденный в исследовании на здоровых добровольцах благоприятный профиль безопасности и предсказуемую фармакокинетику фтортиазинона, обобщение этих данных применительно к послеоперационным онкологическим пациентам сопряжено со значительными ограничениями [21]. Ключевой проблемой является принципиальное отличие изучаемой популяции: у тяжелых онкологических больных могут наблюдаться синдром системной воспалительной реакции, гипоальбуминемия, нарушение функции желудочно-кишечного тракта и изменения объема распределения жидкости. Эти патофизиологические состояния способны кардинально изменить фармакокинетику препарата — его всасывание, распределение и элиминацию и, как следствие, повысить риск развития нежелательных явлений по сравнению с таковым у здоровых добровольцев.
Таким образом, подтверждение благоприятного профиля безопасности фтортиазинона в данной конкретной группе риска требует проведения целенаправленных исследований.
Цель исследования: оценить предварительную эффективность и безопасность комбинации карбапенема (меропенема) с новым антивирулентным препаратом фтортиазинон для лечения тяжелых послеоперационных инфекционно-воспалительных осложнений, вызванных карбапенем-резистентными грамотрицательными возбудителями, у пациентов онкологического профиля.
Содержание статьи
Материал и методы
На момент написания статьи в исследование вошло 30 пациентов, которым в условиях МНИОИ им. П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России проведено хирургическое лечение в 2024–2025 гг.
Критерии включения:
состояние после хирургического лечения злокачественного новообразования (вне зависимости от успешности операции, наличия хирургических осложнений и выполнения повторных вмешательств);
инфекционно-воспалительные осложнения, возникшие в раннем послеоперационном периоде (имеющие причинно-следственную связь с вмешательством): пневмония (в том числе деструктивная) или перитонит, или антрабдоминальный инфильтрат (абс-цесс), или экссудативный плеврит (эмпиема плевры), или медиастинит;
выделение из биоматериала (в том числе в составе микст-инфекции) карбапенем-резистентных штаммов K. pneumoniae (продуценты β-лактамаз KPC, NDM, OXA-48), P. aeruginosa (продуценты металло-β-лактамаз (карбапенемаз) VIM, IMP), Acinetobacter baumannii (продуценты OXA-карбапенемаз OXA-23, OXA-40) методом ПЦР.
Критерии исключения:
аллергия на карбапенемы, фтортиазинон;
хроническая болезнь почек (ХБП) V ст. (скорость клубочковой фильтрации <15 мл/мин/1,73 м2)[1];
печеночная недостаточность;
терминальная стадия онкологического заболевания (IV клиническая группа, ожидаемая выживаемость <7 дней);
инфекционно-воспалительные процессы, вызванные K. pneumoniae (продуценты KPC, NDM, OXA-48), P. aeruginosa (VIM, IMP), A. baumannii (OXA-23, OXA-40), не имеющие причинно-следственной связи с перенесенным оперативным вмешательством (например, фебрильная нейтропения);
инфекционно-воспалительные процессы других локализаций (остеомиелит, менингит, абсцесс мозга и т. д.);
выделение из биоматериала других грамотрицательных возбудителей, продемонстрировавших приобретенную устойчивость к карбапенемам, — E. coli, Enterobacteriaceae spp., Klebsiella oxytoca, Burkholderia cepacia и т. д. (природная устойчивость к карбапенемам любых других микроорганизмов (например, Bacteroides spp., Enterococcus spp.), а также приобретенная устойчивость к карбапенемам грамположительных возбудителей (например, MRSA) критерием исключения не является);
выделение из биоматериала K. pneumoniae, P. aeruginosa, A. baumannii без определения факторов устойчивости к карбапенемам методом ПЦР, в том числе при клинической неэффективности карбапенемов в режиме монотерапии или в составе комбинированной (многокомпонентной) противомикробной терапии;
пациенты на искусственной вентиляции легких.
В послеоперационном периоде пациенты, у которых были выявлены карбапенем-резистентные возбудители, составили основную группу (n=10). Пациенты получали наряду с карбапенемами (1000 мг в/в капельно 3 р/сут) в качестве компонента противомикробной терапии фтортиазинон (600 мг per os 2 р/сут). В группу вошли 7 мужчин, 3 женщины с верифицированным онкологическим заболеванием III–IV стадии, средний возраст — 65,4±8,8 года. По характеру оперативных вмешательств: 4 (40%) больным была выполнена одномоментная резекция и пластика пищевода (по Ivor-Lewis и ее модификации), 3 (30%) пациентам — гастрэктомия / проксимальная резекция желудка, 3 (30%) пациентам — панкреатодуоденальная резекция / гемигастропанкреатодуоденальная резекция. В связи с ранней несостоятельностью анастомозов 3 (30%) из 10 пациентов потребовалось выполнение релапаротомии/реторакотомии.
Контрольную группу составили 20 пациентов (12 мужчин, 8 женщин, средний возраст — 66±9,5 года), ретроспективно отобранных по принципу «случай — контроль», сопоставимых по характеру онкологического процесса, оперативного вмешательства, срокам возникновения и тяжести послеоперационных инфекционно-воспалительных осложнений, вызванных карбапенем-резистентными возбудителями, соответствующих критериям включения/исключения. Все пациенты получали комбинированную АБТ на основе антисинегнойных карбапенемов, преимущественно биапенем в комбинации с амикацином или ванкомицином в средних терапевтических дозах.
Пациентам обеих групп при отсутствии позитивной динамики в течение 3 сут (нарастание лейкоцитоза, уровней маркеров воспаления, появление или прогрессирование полиорганной недостаточности) схему отменяли с последующим назначением АБТ других фармакологических групп.
Оценка результатов терапии осуществлялась в два этапа: по динамике активности инфекционно-воспалительного процесса и по исходу. Первоначальная эффективность терапии оценивалась по динамике уровня C-реактивного белка (СРБ) в течение 3 сут с момента назначения терапии. Дополнительными маркерами служили: уровень прокальцитонина, уровень лейкоцитов в периферической крови (WBC), а также общеклинические показатели (температура тела, сатурация, частота сердечных сокращений, артериальное давление, диурез и т. д.). Оценка тяжести состояния пациентов проводилась с использованием шкал SOFA и APACHE II. У пациентов с перитонитом дополнительно применялся Мангеймский индекс перитонита[2].
Основной показатель эффективности — краткосрочная (30-дневная) выживаемость пациентов с вышеуказанными послеоперационными осложнениями, обусловленными сверхрезистентными возбудителями.
Статистическая обработка данных проводилась с использованием пакетов прикладных программ Microsoft Excel и Statistica 8.0 (StatSoft Inc.). Характер распределения количественных признаков оценивали с помощью критерия Шапиро — Уилка. Поскольку данные не подчинялись нормальному распределению, для сравнения групп применяли непараметрические критерии. Качественные данные представлены в виде абсолютных значений и процентов (n; %).
Результаты исследования
Послеоперационный период у всех пациентов основной группы осложнился развитием нозокомиальных инфекционных осложнений, подтвержденных клинико-лабораторными и инструментальными методами: пневмония (у 9 пациентов), перитонит (у 3 пациентов), медиастинит и эмпиема плевры (у 2 пациентов), сепсис (септическое состояние) (у 3 пациентов). Средний балл по шкале SOFA на старте терапии составил 5,1±2,8, по шкале APACHEII — 11,6±4,7. Мангеймский индекс перитонита составил 27,1±12,4 балла — средний риск по группе.
В контрольной группе нозокомиальная пневмония развилась у 12 (60%), сепсис диагностирован у 8 (40%) пациентов. Средние показатели тяжести состояния на старте терапии составили: SOFA — 4,6±1,7, APACHE II — 11,1±3,0, Мангеймский индекс перитонита — 24,4±11,9.
Микробиология
У пациентов основной группы наиболее часто выделялись K. pneumoniae (60%) и A. baumannii (40%). Методом ПЦР верифицированы гены карбапенемаз, среди которых доминировали blaOXA-48-like и blaNDM у K. pneumoniae и blaOXA-23-like у A. baumannii (табл. 1). Другие полирезистентные грамотрицательные возбудители отмечались реже и входили в состав микст-инфекций. Поэтому сумма частот встречаемости всех возбудителей превышает 100%.
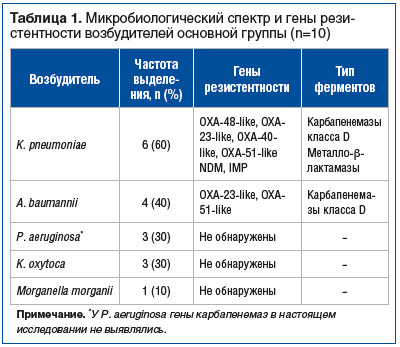
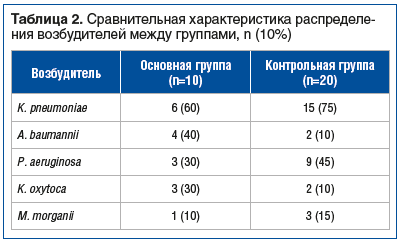
В контрольной группе доминирующими возбудителями были K. pneumoniae (75%) и P. aeruginosa (45%), что соответствовало микробиологическому профилю основной группы. Указанные возбудители in vitro клинически демонстрировали устойчивость к меропенему и имипенем/циластатину. Эти пациенты получали комбинированную противомикробную терапию на основе биапенема (см. Материал и методы). Распределение возбудителей между группами представлено в таблице 2.
Динамика активности
Эффективность терапии оценивалась через 3 сут. Отсутствие ответа на терапию констатировалось при сохранении или прогрессировании следующих критериев: персистенция лейкоцитоза (WBC >10×109/л), отсутствие значимого снижения уровня СРБ (<50% от исходного уровня) и уровня прокальцитонина (<80% от пикового значения), увеличение балльной оценки по шкале SOFA на ≥1 пункт, отсутствие положительной рентгенологической динамики (по данным рентгенографии или компьютерной томографии органов грудной клетки) или прогрессирование инфильтративных изменений в легких, сохранение фебрильной температуры тела (>38°C), а также необходимость проведения повторных санационных оперативных вмешательств.
В основной группе (n=10) отсутствие клинического эффекта было зарегистрировано у 2 (20,0%) пациентов, в контрольной (n=20) — у 7 (35,0%). В случаях отсутствия эффекта от эмпирического режима проводилась смена АБТ. В контрольной группе наиболее часто назначались комбинации с амикацином (30,0%) и ванкомицином (25,0%). Их эффективность не являлась предметом настоящего анализа.
Выживаемость
Краткосрочная (30-дневная) выживаемость на фоне комбинированной терапии в основной группе составила 90% (9/10). Единственный летальный исход был у пациента с распространенным медиастинитом, эмпиемой плевры и двусторонней пневмонией, развившимися на фоне несостоятельности эзофагогастроанастомоза после расширенной операции на пищеводе. На момент начала терапии пациент имел по шкалам SOFA и APACHE II 11 и 21 балл соответственно, что свидетельствовало о выраженной полиорганной дисфункции.
Краткосрочная (30-дневная) выживаемость в контрольной группе составила 80% (16 из 20), что достоверно ниже, чем в основной группе (p<0,05). Все летальные исходы (4 из 20 (20%)) были ассоциированы с неэффективностью массивной АБТ сепсиса, медиастинита, распространенного перитонита, обусловленных сверхрезистентными возбудителями.
Изолированная пневмония (без сепсиса) имела существенно лучший прогноз. Все включенные в анализ пациенты в основной группе выжили (8 из 8).
Обсуждение
Полученные результаты (несмотря на то, что они первичные у данной группы пациентов) оказались весьма неоднозначными и дискутабельными. Для начала нужно подчеркнуть, что все проанализированные в ходе работы клинические ситуации были обусловлены карбапенем-резистентными (de facto с тотальной или субтотальной резистентностью) грамотрицательными возбудителями. Лекарственная терапия этих процессов затруднена не только ограниченным выбором потенциально эффективных препаратов, но и отсутствием общепринятого консенсуса о лечебной тактике в подобных ситуациях. Ввиду бесспорных показаний к АБТ таким пациентам такая терапия (и чаще комбинированная) назначена должна быть, причем даже если возбудитель демонстрирует устойчивость не только к выбранному резервному препарату, но и вообще ко всем препаратам, присутствующим в антибиотикограмме. Очевидно, такую схему терапии адекватной назвать сложно. Однако и воздержаться от нее нельзя, так как это — неоказание помощи.
Несмотря на лабораторно подтвержденную карбапенем-резистентность, терапия, основанная на карбапенемах, демонстрирует отнюдь не нулевую эффективность. С чем это связано, не вполне понятно. Тяжелым пациентам АБ-препараты редко назначаются по одному, чаще в комбинациях [22]. Появляется возможность заявить, что суть — именно в благоприятной комбинации. Тем более что эффективность комбинаций in vitro не оценивается. Главный аргумент против такой трактовки — плохая воспроизводимость этих условно «удачных» сочетаний. Общепризнанной является фактически лишь одна комбинация — карбапенем + амикацин [22]. Нередко успех приносят комбинации на основе полимиксинов. Однако последние токсичны и вообще с трудом комбинируются с чем бы то ни было. Здесь, очевидно, все решает именно активность полимиксина [23], тем более что общепризнанных комбинаций на их основе нет.
В реальной практике при выявлении возбудителя с тотальной резистентностью иногда приходится видеть крайне экзотические сочетания АБ-препаратов, даже трех или четырех одновременно, иногда с хорошим клиническим результатом. Но повторить успех, как правило, не удается, что неизменно списывается на крайнюю тяжесть пациента, уникальность его клинической ситуации и т. д. [24, 25]. Другая возможная трактовка состоит в особенностях самого сверхрезистентного возбудителя, который может приобрести сниженную относительно «диких» штаммов вирулентность. Таким образом, даже в условиях неадекватной терапии (препаратами, к которым возбудитель in vitro устойчив) инфекционно-воспалительный процесс приобретает склонность к затяжному течению с низкой активностью.
Если следовать этому предположению, то при назначении ингибитора вирулентности можно ожидать, что вирулентность снизится, если не до нуля, то хотя бы значимо. Настолько, чтобы возбудитель не смог запустить необходимый для его жизненного цикла патологический процесс. Проведенное исследование в целом подтверждает эту логическую последовательность. Назначенный против возбудителей с тотальной или субтотальной лекарственной резистентностью фтортиазинон привел к увеличению выживаемости пациентов с послеоперационными инфекционно-воспалительными осложнениями в 2 раза. При этом случаи, когда препарат с самого начала оказался неэффективен, то есть возбудитель продемонстрировал резистентность (очевидно, приобретенную), пока отсутствуют. Сделав еще один шаг в этой логической цепочке, можно предположить, что эффективность фтортиазинона должна расти с ростом резистентности возбудителя к «классическим» АБ-средствам. Однако гипотеза о снижении вирулентности при сверхвысокой лекарственной устойчивости пока не подтверждается микробиологическими исследованиями.
Заявленный эффект фтортиазинона, не обладающего прямым бактерицидным или бактериостатическим действием, основанный на ингибировании T3SS [17], позволяет предполагать, что его эффективность не зависит от уровня антибиотикорезистентности. И результаты нашего исследования подтверждают эту концепцию: добавление фтортиазинона к карбапенему при инфекциях, вызванных карбапенем-резистентными штаммами, ассоциировалось с улучшением клинических исходов, включая 30-дневную выживаемость.
Почти аналогичный вывод дает анализ фармакологических свойств препарата [16]. Для чего может потребоваться дорогостоящий АБ-препарат, который не является ни бактерицидным, ни бактериостатиком, который невозможно (по крайней мере, исходя из нынешних знаний о нем) назначать в режиме монотерапии? Ответ возможен только один: для ситуаций, когда «классические» АБ-средства по какой-то причине неэффективны, то есть при тотальной или субтотальной лекарственной резистентности возбудителя.
Отдельно возникает вопрос: для чего в схеме терапии нужен карбапенем, если возбудитель к нему устойчив? Вопреки очевидному предположению, фтортиазинон (в отличие от ингибиторов β-лактамаз) не сделает устойчивого возбудителя чувствительным. Жизненный цикл любого возбудителя предполагает взаимодействие с макроорганизмом, что внешне выглядит как патологический процесс. Фтортиазинон вмешивается в это взаимодействие, что возбудителя, разумеется, угнетает. Все препараты β-лактамной структуры нарушают синтез компонентов клеточной стенки. Потому к ним потенциально чувствительны все микроорганизмы, имеющие клеточную стенку. Вопрос только дозировок, иногда неприемлемо высоких. Таким образом, в качестве бактерицидного компонента назначить можно вообще любой β-лактам. Но использование препарата, специально разработанного против госпитальной флоры, представляется более логичным. Вместо меропенема можно (в реальной клинической практике даже желательно) взять биапенем или азтреонам. Они нередко оказываются в состоянии подавить меропенем-резистентного возбудителя даже в режиме монотерапии. Однако для научного исследования это качество отрицательное, так как будет мешать интерпретации результатов. Назначение меропенема в схеме с фтортиазиноном против карбапенем-устойчивого возбудителя — это стратегический ход, основанный на глубоком понимании бактериальной физиологии и механизмов резистентности. Не прямое бактерицидное действие на бактерии карбапенема, а подавление системы защиты бактерии (эффлюкс-насосов) с помощью ее же собственного оружия (β-лактамаз), что позволяет основному антивирулентному препарату работать эффективно. Это яркий пример рационального дизайна комбинированной антимикробной терапии.
Заключение
Проведенное исследование продемонстрировало, что комбинация антивирулентного препарата фтортиазинона с карбапенемом является перспективным терапевтическим подходом для лечения тяжелых послеоперационных инфекционно-воспалительных осложнений, вызванных карбапенем-резистентными грамотрицательными возбудителями, у пациентов онкологического профиля. Предварительные результаты свидетельствуют о более высокой 30-дневной выживаемости (90% против 80%) и меньшей доле отсутствия клинического эффекта через 72 ч (20% против 35%) в группе, получавшей антивирулентный препарат, по сравнению с контрольной группой на стандартной комбинированной терапии.
Таким образом, включение антивирулентного препарата в схемы комбинированной АБТ открывает новые возможности для борьбы с инфекциями, обусловленными полирезистентной госпитальной микрофлорой, в абдоминальной и торакальной онкохирургии. Для подтверждения этих результатов и определения оптимальных алгоритмов применения необходимы дальнейшие исследования на более крупных выборках.
Список литературы Вы можете найти на сайте http://www.rmj.ru
[1] Клинические рекомендации. Хроническая болезнь почек (ХБП). 2024. (Электронный ресурс.) URL: https://rusnephrology.org/wp-content/uploads/2024/06/КР_ХБП_от_10.06.2024.pdf (дата обращения: 06.10.2025).
[2] Медицинские калькуляторы и компьютерные программы. (Электронный ресурс.) URL: https://medsoftpro.ru/ (дата обращения: 19.07.2025).
Информация с rmj.ru