Содержание статьи
Введение
Ревматоидный артрит (РА) — системное, иммунологически опосредованное заболевание (встречается у 0,5–1% населения в целом) неизвестной этиологии, характеризующееся синовитом множественных периферических суставов, хронической болью, эрозивными процессами в костной ткани и прогрессирующим течением. Помимо поражения суставов и хронического воспаления, РА наиболее часто ассоциируется с повышенным сердечно-сосудистым риском и субклинической почечной недостаточностью [1–4].
Согласно рекомендациям KDIGO (Kidney Disease: Improving Global) и Ассоциации нефрологов России показатели скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2 соответствуют снижению, а показатели СКФ от 89 мл/мин/1,73 м2 до 60 мл/мин/1,73 м2 — незначительному снижению глобальной функции почек [5–7].
Для расчета СКФ могут быть использованы простые способы с определением клиренса креатинина (формулы Кокрофта — Голта, MDRD, CKD-EPI) [8]. Формула CKD-EPI, показавшая лучшее соотношение с данными референтных методов определения СКФ, рекомендуется в настоящее время к использованию в широкой клинической практике. Данный показатель может быть рассчитан автоматически с помощью интернет-калькуляторов. Оценочные уравнения для определения расчетной СКФ (рСКФ) представляют собой уравнения регрессии, которые оценивают СКФ на основе плазменных уровней эндогенных маркеров фильтрации, а также демографических и клинических переменных в качестве наблюдаемых суррогатов для неизмеренных детерминант, не связанных с СКФ, что по определению обеспечивает более точную оценку истинной СКФ [9].
Точная оценка СКФ — важный аспект клинической помощи больным ревматологического профиля [10, 11].
Использование уравнения CKD-EPI на основе креатинина может вести к переоценке СКФ, маскируя, таким образом, почечную недостаточность у пациентов с РА. Неточность уравнений рСКФ обычно выше при более высоких значениях СКФ, чем при более низких, учитывая различные источники ошибок, и особенно заметна в популяциях с хронической болезнью почек (ХБП) [9]. В связи с этим в настоящее время наиболее точным инструментом при определении рСКФ для стратификации риска в целом признан цистатин C [12]. Для оценки функции почек по формуле CKD-EPI показатели данного маркера можно использовать как изолированно, так и в сочетании с креатинином. Однако у обоих методов имеются недостатки, значимые для РА: особенности диеты и мышечная масса влияют на уровень креатинина, тогда как на уровни цистатина C могут оказывать влияние высокие дозы глюкокортикостероидов (ГКС), хроническое воспаление и, возможно, ожирение. Обновленные клинические руководства не содержат четких рекомендаций для ситуаций с подозрением на недостаточную точность рСКФ при выборе предпочтительной формулы или использовании показаний клиренса маркера экзогенной фильтрации, поэтому многие вопросы нуждаются в доработке.
Цель исследования: выбор оптимального метода определения СКФ для оценки тяжести нарушений функции почек у больных РА в зависимости от клинико-лабораторных вариантов течения заболевания.
Материал и методы
Открытое поперечное одноцентровое исследование проведено с участием 96 пациентов с достоверным диагнозом РА, проходивших обследование на базе клинико-диагностического отделения ФГБНУ «НИИ КиЭР им. А.Б. Зборовского». Критерии включения: верифицированный диагноз РА, возраст >18 и ≤75 лет, подписанное информированное согласие. Критерии исключения: острые и/или хронические неревматические воспалительные заболевания в стадии обострения, признаки структурных изменений в почках (по результатам визуализирующих или морфологических методов исследования), резко сниженная функция почек (<30 мл/мин/1,73 м2), острые инфекционные, онкологические заболевания, аллергические реакции, печеночная недостаточность, сахарный диабет 1 типа, психические нарушения, указания в анамнезе на наркоманию и алкоголизм.
Диагноз РА устанавливали, руководствуясь диагностическими критериями Американской ревматологической ассоциации (ACR) 1987 г. и классификацией ACR/EULAR 2010 г. Активность РА оценивали с помощью индекса DAS28. В выборке преобладали пациенты с умеренной активностью (3,2
Оценку функции почек проводили исключительно на основании показателя рСКФ, полученного с помощью калькулятора на сайте Национального почечного фонда (National Kidney Foundation) США (https://www.kidney.org/professionals/kdoqi/gfr_calculator) по формулам CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration): расчетному уравнению СКФ CKD-EPI на основе креатинина сыворотки крови от 2009 г. (рСКФкр); расчетному уравнению СКФ CKD-EPI на основе креатинина и цистатина С
Образцы крови больных РА собирали с 8:00 до 10:00, центрифугировали и полученную сыворотку хранили при температуре -42 °C не более 6 мес. Цистатин С
При проведении сравнительных расчетов СКФ по сывороточному креатинину, цистатину С или комбинации обоих показателей уравнение CKD-EPI 2009 г. на основе креатинина (рСКФкр) использовалось в качестве эталона. На основании измерений рСКФкр пациенты с РА были разделены на четыре группы: I — высокая/оптимальная функция почек (>90 мл/мин/1,73 м2); II — незначительное снижение функции почек (89–60 мл/мин/1,73 м2); III — умеренно сниженная функция почек (45–59 мл/мин/1,73 м2) и IV — существенно сниженная функция почек (<45 мл/мин/1,73 м2).
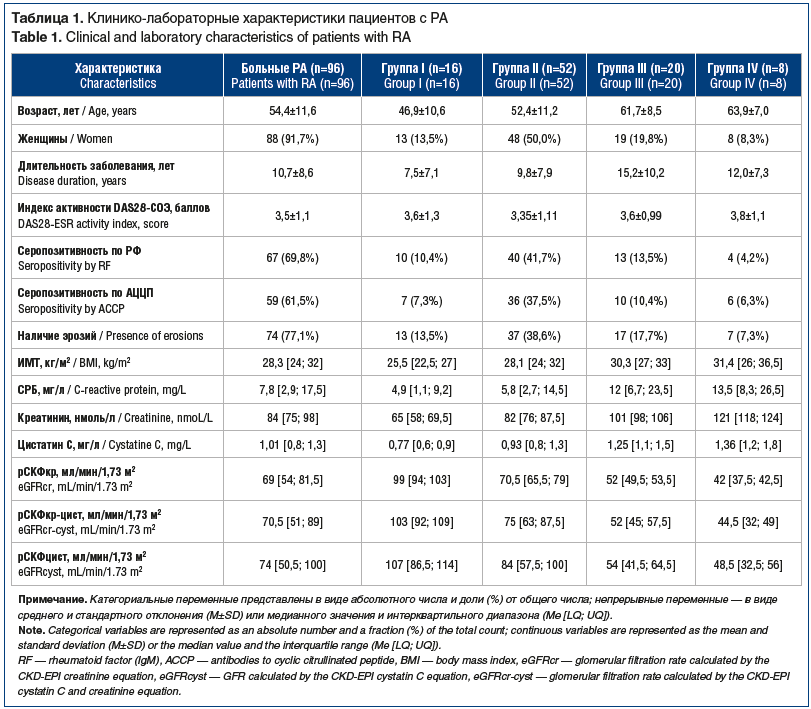
Руководствуясь отечественными и международными рекомендациями, сочетание повышенного уровня артериального давления (АД) (≥130/85 мм рт. ст.), повышения уровня триглицеридов (≥1,7 ммоль/л) и нарушений углеводного обмена (повышенный уровень глюкозы плазмы натощак ≥6,1 ммоль/л) на фоне центрального ожирения (объем талии >94 см у мужчин и >80 см у женщин) расценивали как основание для включения в группу больных РА с признаками метаболического синдрома (МС). В оценку стандартных физикальных параметров наряду с опросом, сбором анамнеза, изучением медицинской документации, оценкой общего состояния, измерением АД на обеих руках также входило определение индекса массы тела (ИМТ) по методу Кетле (ИМТ = масса тела (кг) / рост (м2)). Рост измеряли с помощью ростомера с точностью до 0,5 см, массу тела — с помощью цифровых весов с точностью до 0,1 кг. Окружность бедер измеряли по самой широкой части ягодиц, а окружность талии (ОТ) — в средней точке между гребнем подвздошной кости и реберным краем (с точностью до 0,5 см) (табл. 1).
Статистическую обработку проводили с использованием программного пакета Statistica 10.0 (StatSoft Inс., США) с предварительной оценкой вида распределения в соответствующих выборках. Описательные данные представлены в виде среднего значения (M) со стандартным отклонением (SD) или в виде медианы (Ме) с межквартильным размахом [LQ; UQ] в зависимости от вида распределения показателей. При проведении сравнения в независимых группах использовали методы дисперсионного анализа: при нормальном распределении признаков — дисперсионный анализ ANOVA, при распределении, отличающемся от нормального, — анализ Крускала — Уоллиса. Для оценки связи между количественными признаками (в соответствии с нормальностью распределения) были использованы коэффициенты корреляции (r) Пирсона и Спирмена. Связь между клиническими и лабораторными переменными и показателями почечной функции была оценена с использованием методов регрессионного анализа. Статистически значимыми считали различия при р<0,05.
В общей выборке (n=96) показатели креатинина и цистатина С в сыворотке крови больных РА составили 84 [74,6; 98] мкмоль/л и 1,01 [0,8; 1,33] мг/л соответственно. Цистатин С (разброс значений от 0,62 мг/л до 2,41 мг/л) положительно коррелировал с показателями активности РА по индексу DAS28 (r=0,52, р=0,006), с СОЭ (r=0,4, р=0,041), уровнем СРБ (r=0,48, р=0,012) и креатинина сыворотки крови (r=0,55, р=0,003). Повышенные значения цистатина С у больных РА ассоциировались с высокой активностью заболевания (p<0,001), степенью выраженности МС (p<0,001) и непродолжительным (менее 3 мес.) приемом ГКС (p=0,04).
Средняя рСКФкр, представленная как эталонная в данном исследовании, составила 70,0±18,7 мл/мин/1,73 м2. Признаки гиперфильтрации согласно рСКФкр
Сравнение показателей рСКФ, определенной различными методами в общей группе больных РА, продемонстрировало достоверные различия при использовании выбранных методик (χ2=9,91, p=0,007). Межгрупповые различия (по степени снижения рСКФ) также были статистически значимыми для всех вариантов расчета СКФ (рСКФкр,
Использование рСКФцист показало, что только 12 из 29 человек группы I соответствовали оптимальной (>90 мл/мин/1,73 м2) рСКФкр (р=0,031), а 17 пациентов попали в группу с незначительно сниженной (60–89 мл/мин/1,73 м2) рСКФкр. Аналогичная, но менее выраженная ситуация (12 из 22 человек и 10 пациентов соответственно, р=0,02) наблюдалась и при использовании рСКФкр-цист. Во II группе больных РА (с умеренным снижением рСКФкр) при определении рСКФцист 19 человек соответствовали выбранным критериям, а 8 пациентов попали в группы III и IV с более выраженным снижением функции почек (2 пациента вошли в группу I) (р=0,011). Достоверные различия в данной группе отмечены также и при сравнении пропорций по рСКФкр и по рСКФкр-цист (р=0,044). Таким образом, вероятное занижение фильтрационной функции почек согласно рСКФкр (по сравнению с альтернативным использованием рСКФкр-цист или
Методами регрессионного анализа было установлено, что наиболее выраженная зависимость (с поправкой на возраст) определялась между рСКФ по формулам с использованием цистатина (рСКФкр-цист и рСКФцист) и показателями, характеризующими активность воспалительного ревматоидного процесса и выраженность метаболических изменений (наличие МС). Так, рассчитанная регрессия удовлетворительно описывала связь между рСКФкр-цист и СРБ (F=20,8, р<0,001), ИМТ (F=14,6, р<0,001); между рСКФцист и СРБ (F=26,4, р<0,001), СОЭ (F=7,73, р=0,007), индексом DAS28 (F=28,5, р<0,001), ИМТ (F=12,4, р<0,001) и ОТ (F=8,39, р=0,005). Для рСКФкр логистический регрессионный анализ из всех представленных выше показателей продемонстрировал достоверную связь только с СРБ (F=6,4, р=0,013), но выявил также зависимость от уровня гемоглобина (F=4,91, р=0,029), демонстрируя определенным образом важность типа уравнения, используемого для расчета рСКФ у больных РА. При включении в анализ всех переменных, характеризующих воспалительный процесс у больных РА, единственным значимым предиктором рСКФ был СРБ (β=-0,28 — для рСКФкр, β=-0,34 — для рСКФкр-цист, β=-0,33 — для рСКФцис; р<0,001).
Концентрации цистатина C были значительно выше в группе больных РА с MС (n=37), чем в группе без MС (n=59) (U-критерий Манна — Уитни, p<0,001), а также у пациентов с более высокой активностью заболевания (F=8,87, р=0,001). С учетом выявленных закономерностей были сформированы две группы больных РА с различной активностью по DAS28: группа с минимальной/низкой активностью (DAS28≤3,2) — 55 человек и группа с умеренной/высокой активностью (DAS28>3,2) — 41 человек.
Двухфакторный дисперсионный анализ по сравнению
Дальнейшее рассмотрение данных факторов (МС и активность заболевания) показало, что наличие метаболических нарушений не оказывало влияния на рСКФкр-цист
При построении регрессионной модели взаимосвязи рСКФкр, активности заболевания и МС достоверных показателей выявлено не было (р=0,71).
Распространенность ХБП у пациентов с РА выше, чем в общей популяции, и причины данного явления имеют многофакторный характер [3, 13]. Для диагностики функциональных нарушений со стороны почек при различных клинических ситуациях принято ориентироваться на показатели рСКФ на основе маркеров эндогенной фильтрации (в основном креатинина и цистатина), которые широко используются в клинической практике вместо стандартного измерения истинной СКФ на основе экзогенных маркеров. Так, для определения рСКФ диагностическую эффективность продемонстрировали и получили лучшую оценку методы на основе цистатина С у больных сахарным диабетом [14], циррозом печени [15], хронической обструктивной болезнью легких [16], кардиальной патологией [17–19], но для характеристики ассоциации факторов риска ХБП с истинной СКФ лучшим вариантом остается рСКФкр [20].
Различия в результатах определения рСКФ при использовании различных уравнений на основе одних и тех же маркеров фильтрации отражают не только различия в самих переменных, включенных в уравнения, в формах и коэффициентах переменных, но и различия между маркерами фильтрации в механизмах, не относящихся к СКФ. Даже при отсутствии систематической ошибки точность уравнений, использующих только один маркер фильтрации (креатинин или цистатин С), оказывается в ряде случаев недостаточной. По утверждению A.S. Levey et al. [9], использование нескольких маркеров фильтрации способно повысить точность за счет уменьшения ошибок из-за вариации детерминант каждого маркера, не относящихся к СКФ.
Наше исследование продемонстрировало, что использование уравнения CKD-EPI на основе креатинина ведет к переоценке рСКФ почти у 20% больных РА. Данное обстоятельство не может не настораживать, так как ранее было показано, что гиперфильтрация по показателю рСКФкр является состоянием высокого риска ХБП [21], тогда как гиперфильтрация согласно рСКФцист представляет собой состояние низкого риска [20]. Кроме того, мы выявили значимое влияние низкого уровня гемоглобина на рСКФкр. Обычно анемия наблюдается при снижении клиренса креатинина до 40–60 мл/мин, но может возникать и на более ранних стадиях заболевания [22], закономерно осложняя почечную дисфункцию при РА.
В целом проблема показателя рСКФкр состоит в том, что его необходимо оптимизировать либо для здоровых лиц (мышечная масса выше средней), либо для популяций с ХБП (мышечная масса ниже средней) [23, 24], а при РА мы часто наблюдаем у пациентов как ожирение, так и саркопению [25].
В свою очередь, более низкая рСКФ, полученная с использованием формул на основе цистатина С, в отличие от рСКФкр, по данным нашего исследования, имела связь с множественными факторами риска ХБП по не связанным с почечной дисфункцией параметрам: более высокий ИМТ, артериальная гипертензия, более высокий уровень триглицеридов и более высокий уровень СРБ как показатель активности воспалительного процесса. Наши результаты в данной части исследования отличаются от результатов, полученных M. Couderc et al. [11], но согласуются с результатами тех работ, в которых отмечается связь цистатина С с воспалением, ожирением и другими метаболическими нарушениями при РА [20, 26]. Проблема рСКФцист заключается, по-видимому, в завышенном ожидании интерпретации цистатина С как маркера СКФ, хотя цистатин С,
И хотя комбинированное уравнение на основе креатинина и цистатина C считается более информативным, чем уравнения, основанные только на одном из этих маркеров [12, 27, 28], можно ожидать, что рСКФкр-цист будет представлять собой в большинстве случаев просто среднее значение между рСКФкр и рСКФцист [24]. Однако у пациентов с РА, находящихся на стационарном лечении, применение данной формулы наиболее оправдано, так как позволяет в равной мере учесть влияние воспалительных и метаболических нарушений на СКФ. Внедрение в клиническую практику биоимпедансометрии, к чему призывают А.В Смирнов и соавт. [29], сможет помочь в более точной оценке величины жировой массы тела и, соответственно, окажет влияние на определение величины СКФ в группах пациентов с массой тела, выходящей за рамки референсных значений.
Следует отметить несколько ограничений данного исследования. Во-первых, это было одноцентровое поперечное исследование, поэтому результаты не обязательно поддаются обобщению. Во-вторых, в качестве эталонного метода использовали рСКФкр и не был проведен сравнительный анализ с истинной СКФ (например, почечный клиренс инулина, 125I-иоталамата или 99mTc-диэтилентриаминпентауксусной кислоты). В-третьих, не все известные факторы риска ХБП были оценены: в частности, проигнорированы отдельные факторы, которые могли вызвать изменения функции почек (использование нестероидных противовоспалительных препаратов) или повлиять на уровни цистатина С независимо от рСКФ (использование ГКС).
Дальнейшая проверка существующих и, возможно, разработка новых (с использованием нескольких маркеров эндогенной фильтрации) уравнений оценки СКФ окажется наиболее полезной в клинической практике при исследовании в разных популяциях для лучшего понимания детерминант не связанных с СКФ маркеров эндогенной фильтрации [9]. На настоящий момент общая диагностическая эффективность уравнения CKD-EPI креатинин-цистатин С может рассматриваться как оптимальная (в сравнении с другими расчетными формулами CKD-EPI) у пациентов с РА вне зависимости от активности заболевания и наличия признаков МС, а также может быть востребована для подтверждения результатов рСКФкр >60 мл/мин/1,73 м2. До тех пор, пока для больных РА не будет разработано более точное уравнение для оценки рСКФ, чем те, которые основаны на определении СКФ по креатинину и/или цистатину, мы рекомендуем использовать уравнение креатинин-цистатин C CKD-EPI для ранней диагностики и в процессе лечения дисфункции почек у больных РА независимо от вариантов клинического течения заболевания.
Сведения об авторах:
Александров Владислав Андреевич — младший научный сотрудник ФГБНУ «НИИ КиЭР имени А.Б. Зборовского»; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 76; ORCID iD 0000-0002-0686-4067.
Александров Андрей Вячеславович — д.м.н., доцент, заведующий лабораторией ФГБНУ «НИИ КиЭР имени А.Б. Зборовского»; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 76; ORCID iD 0000-0002-0686-4067.
Зборовская Ирина Александровна — д.м.н., профессор, директор ФГБНУ «НИИ КиЭР имени А.Б. Зборовского»; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 76; ORCID iD 0000-0003-3898-7667.
Александрова Нинель Владимировна — к.м.н., старший научный сотрудник ФГБНУ «НИИ КиЭР имени А.Б. Зборовского»; 400138, Россия, г. Волгоград, ул. им. Землячки, д. 76; ORCID iD 0000-0002-0686-4067.
Контактная информация: Александров Андрей Вячеславович, e-mail: imlab@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 14.06.2021.
Поступила после рецензирования 07.07.2021.
Принята в печать 30.07.2021.
About the authors:
Vladislav A. Alexandrov — Junior Researcher, Research Institute of Clinical and Experimental Rheumatology named after A.B. Zborovsky; 76, Zemlyachki str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0002-0686-4067.
Andrey V. Alexandrov — Dr. Sc. (Med.), Associate Professor, Head of the Laboratory, Research Institute of Clinical and Experimental Rheumatology named after A.B. Zborovsky; 76, Zemlyachki str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0002-0686-4067.
Irina A. Zborovskaya — Dr. Sc. (Med.), Professor, Director of the Research Institute of Clinical and Experimental Rheumatology named after A.B. Zborovsky; 76, Zemlyachki str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0003-3898-7667.
Ninel V. Alexandrova — C. Sc. (Med.), Senior Researcher, Research Institute of Clinical and Experimental Rheumatology named after A.B. Zborovsky; 76, Zemlyachki str., Volgograd, 400138, Russian Federation; ORCID iD 0000-0002-0686-4067.
Contact information: Andrey V. Alexandrov, e-mail: imlab@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 14.06.2021.
Revised 07.07.2021.
Accepted 07.07.2021.
сыворотки крови от 2012 г. (рСКФкр-цист); расчетному уравнению СКФ CKD-EPI на основе цистатина C сыворотки крови от 2012 г. (рСКФцист).
измеряли методом твердофазного иммуноферментного анализа (диагностическая тест-система «Цистатин С-ИФА-БЕСТ», «Вектор-Бест», Россия) с использованием калибровочных образцов, стандартизованных в соответствии с ERM certified Reference Material ERM-DA471/IFCC. Учет результатов исследования проводили на иммунологическом анализаторе «Multiskan» (Финляндия). Сывороточные концентрации креатинина, общего белка, глюкозы, триглицеридов определяли стандартными биохимическими методами, С-реактивного белка (СРБ) — иммунотурбидиметрическим методом (норма ≤3 мг/л) на полуавтоматическом биохимическом анализаторе «Screen Master» (Hospitex Diagnostics) с использованием диагностических наборов производства фирмы «Вектор-Бест» (Россия). Скорость оседания эритроцитов (СОЭ по Вестергрену) определяли на приборе «VES-Matic 10» (DIESSE, Италия).
Результаты исследования
(>90 мл/мин/1,73 м2) отмечены у 16 (10,1%) пациентов с РА, незначительное снижение функции почек (60–89 мл/мин/1,73 м2) — у 52 (32,9%), умеренное/выраженное снижение (<59 мл/мин/1,73 м2) — у 28 (17,8%). Снижение рСКФкр по представленным группам было в различной степени связано с увеличением возраста пациентов (r=0,46, р=0,003), длительности заболевания (r=0,24, р=0,017), кумулятивной дозой гормональных препаратов (r=0,66, р=0,007), более низким ростом (r=0,35, р=0,001), наличием коморбидной патологии (р=0,01) (гипертоническая болезнь, заболевания щитовидной железы и легких).
рСКФкр-цист, рСКФцист; H-test и Median-test, p<0,001). Как свидетельствовали данные рСКФкр, у подавляющего числа пациентов с РА (83,3%) имелось снижение СКФ различной степени выраженности (незначительное снижение регистрировали в 54,2% случаев) (табл. 2).

рСКФцист) можно наблюдать у 11–18% больных РА в группе I (высокая/оптимальная функция почек) и примерно у 10% больных РА в группе II (незначительное снижение функции почек). Достоверных различий при использовании трех расчетных формул CKD-EPI у больных РА с умеренным/существенным снижением СКФ обнаружено не было (p>0,05).
рСКФцист в группах больных РА с различной активностью заболевания в зависимости от наличия признаков МС продемонстрировал значимое влияние воспалительных (р<0,001) и метаболических (р=0,006) нарушений на рСКФцист. Расчетная СКФцист у пациентов с высокой активностью заболевания и наличием МС (n=28) была достоверно ниже, чем в группе больных с низкой активностью РА независимо от наличия МС (без МС — n=32, с МС — n=9; Tukey HSD-test, p<0,001 в обоих случаях) и в группе больных РА с высокой активностью и отсутствием МС (n=27, р=0,007). Коэффициент детерминации представленной модели: R2=0,34 (р<0,001).
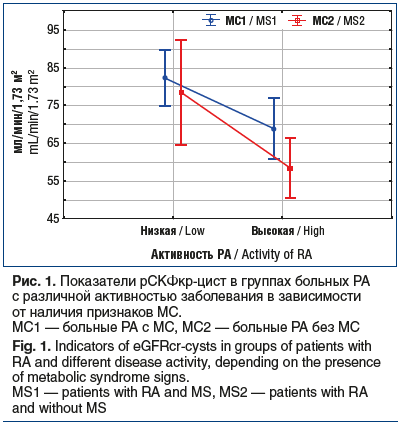
в группах больных с различной активностью РА (р=0,068) (рис. 1). Достоверное снижение рСКФкр-цист наблюдалось только у пациентов с высокой активностью РА при
наличии МС по сравнению с группой больных РА без МС и с низкой активностью заболевания (Tukey HSD-test, p=0,003). Представленная модель хотя и оставалась статистически значимой (р<0,001), но была в состоянии описать менее 20% выявленной зависимости (R2=0,18).
Обсуждение
по мнению A.D. Rule et al. [20], можно интерпретировать как лучший маркер для стратификации риска и лечения ХБП, чем для определения СКФ [20]. Воспаление играет существенную роль в развитии ХБП, поэтому контроль воспаления может обеспечить дополнительные преимущества для предотвращения патологии почек при РА.
Так, ранее было отмечено, что применение больными РА потенциально нефротоксичного метотрексата проявляло себя в качестве защитного фактора, а не фактора риска развития ХБП [1].
Заключение
.
Информация с rmj.ru