Введение
Дисплазия шейки матки — это заболевание, характеризующееся нарушением пролиферации клеток и развитием ядерной атипии на фоне длительной персистенции вируса папилломы человека (ВПЧ) [1, 2]. Во время беременности частота первичного выявления дисплазии шейки матки составляет 13 случаев на 10 000 женщин. Риск прогрессирования тяжелой дисплазии до микроинвазивного рака во время беременности крайне низкий и не превышает 1,1–3,6% [2, 3]. Дисплазия и рак шейки матки являются вирус-ассоциированными заболеваниями. Среди этиопатогенетических факторов, участвующих в развитии данного заболевания, выделяют не только онкогенные ВПЧ, но также иммунологические факторы [3].
Известно, что входными воротами инфекции, вызванной ВПЧ, являются кожа и слизистые оболочки. Вирионы контактируют в первую очередь с рецепторами, локализующимися на эпителиоцитах и кератиноцитах. В последние годы активно изучается роль различных факторов мукозального иммунитета и разрабатываются возможности модулирования их активности [3].
Поскольку в большинстве случаев дисплазия шейки матки ассоциирована с вирусной инфекцией, применение препаратов с иммуномодулирующей и противовирусной активностью в ряде случаев может быть эффективным [3, 4].
Цель исследования: изучение отдаленных результатов экзогенной цитокинотерапии у беременных женщин с дисплазией шейки матки.
Материал и методы
В проспективное исследование включено 50 пациенток с дисплазией шейки матки, рандомизированных в 2 группы. Пациентки 1-й группы (n=30) получали терапию препаратом Суперлимф 25 ЕД с вагинальным введением свечей, пациентки 2-й группы (n=20) — с ректальным введением. Продолжительность терапии в обеих группах составила 20 дней. Было прослежено течение беременности, родов и состояние новорожденных у всех пациенток, включенных в исследование.
Активным веществом препарата Суперлимф является белково-пептидный комплекс свиных лейкоцитов, представляющий собой универсальный стимулятор иммунной системы с активностью фактора, угнетающего миграцию макрофагов, интерлейкина-1, интерлейкина-6, фактора некроза опухоли, трансформирующего фактора роста, секретируемых лейкоцитами периферической крови свиньи. Препарат зарегистрирован как иммуномодулятор, обладает противовирусным и противомикробным действием, стимулирует функциональную активность клеток фагоцитарного ряда, активирует фагоцитоз, выработку цитокинов, индуцирует противоопухолевую цитотоксичность макрофагов, регулирует миграцию клеток в очаг воспаления и увеличивает активность естественных киллеров, обладает антиоксидантной активностью, снижает развитие воспалительных реакций, стимулирует регенерацию и эпителизацию раневых дефектов. Препарат разрешен к применению во время беременности [5].
Критерии включения в исследование: наличие гистологически подтвержденной дисплазии шейки матки, отсутствие специфического и неспецифического вагинита, физиологическое течение беременности, информированное согласие на участие в исследовании и отсутствие повышенной чувствительности к белкам свиного происхождения.
Всем пациенткам проводилось цитологическое исследование мазков с шейки матки (при включении в исследование, через 22 дня после начала терапии и через 6 нед. после родов), а также выполнялась кольпоскопия и кольпоскопическая биопсия шейки матки на этапе включения в исследование и через 6 нед. после родов.
Цитологическое исследование проводилось методом жидкостной цитологии NovаPrep. Забор материала с экто- и эндоцервикса проводился с использованием урогенитального зонда типа f (цервикс браш). Гистологическое исследование проводилось на базе отделения патоморфологии ГБУЗ ГКБ № 40 ДЗМ. В условиях малой операционной шейка матки обнажалась при помощи зеркал Куско, проводилась обработка раствором мирамистина с последующей местной анестезией шейки матки 2% раствором лидокаина гидрохлорида (2 мл). Под кольпоскопическим контролем при помощи петлевого электрода радиохирургическим методом (аппарат «Сургитрон») проводилась биопсия шейки матки с наиболее измененных участков эктоцервикса, размер биоптата составлял в диаметре от 6 до 9 мм. Образец полученной ткани фиксировали в 10% растворе нейтрального забуференного формалина и доставляли в патоморфологическую лабораторию. Интерпретация полученных данных проводилась согласно унифицированной гистопатологической номенклатуре Bethesda.
Расширенная кольпоскопия проводилась на бинокулярном микроскопе (KN-2200 series) с использованием 3% раствора уксусной кислоты и раствора Люголя. Полученные результаты интерпретировались согласно Международной кольпоскопической классификации 2011 г. [6].
Статистическая обработка выполнялась с применением программ SPSS 23.0, Statistica for Windows 10. Для описания количественных данных, имеющих нормальное распределение, использованы среднее арифметическое (М) и стандартное отклонение (SD), которые представлялись в формате М±SD. Для качественных признаков составлялись четырехпольные таблицы сопряженности, значимость различий частот оценивалась с помощью критерия с поправкой Йейтса. Статистически значимыми принимались различия при р≤0,05. Для множественного сравнения групп использовалась поправка Бонферрони.
Результаты исследования
Возраст пациенток 1-й группы составил 25–40 лет (в среднем 31,6±1,7 года), 2-й группы — 22–36 лет (в среднем 29,8±1,4 года). На момент включения в исследование в 1-й группе 5 (16,7%) пациенток находились на I триместре (11–12 нед.), 14 (46,7%) — на II (20–28 нед.) и 11 (36,7%) — на III триместре (29–33 нед.). Во 2-й группе на момент включения в исследование 4 (20%) пациентки были на сроке 10–12 нед., 10 (50%) — на сроке 16–28 нед. и 6 (30%) — на сроке 29–34 нед.
Среди экстрагенитальных заболеваний у пациенток 1-й и 2-й групп преобладала патология органов желудочно-кишечного тракта (46,6% и 25% соответственно), наиболее часто выявлялся хронический гастродуоденит (33,3% и 20%). Частота встречаемости заболеваний органов мочевыделительной (13,3% и 10%) и дыхательной (23,3% и 15%) систем в группах достоверно не отличалась.
Наиболее распространенными гинекологическими заболеваниями были эктопия шейки матки (83,3% и 80% соответственно в 1-й и во 2-й группах), кандидозный вагинит (66,7% и 65%), бактериальный вагиноз (40% и 35%) и дисменорея (10% и 10%).
В обеих группах преобладали повторнобеременные повторнородящие (21 (70%) и 12 (60%) соответственно), при этом у 16,7% и 10% из них в анамнезе были артифициальные аборты. Настоящая беременность у всех обследованных наступила спонтанно, особенности ее течения представлены в таблице 1.
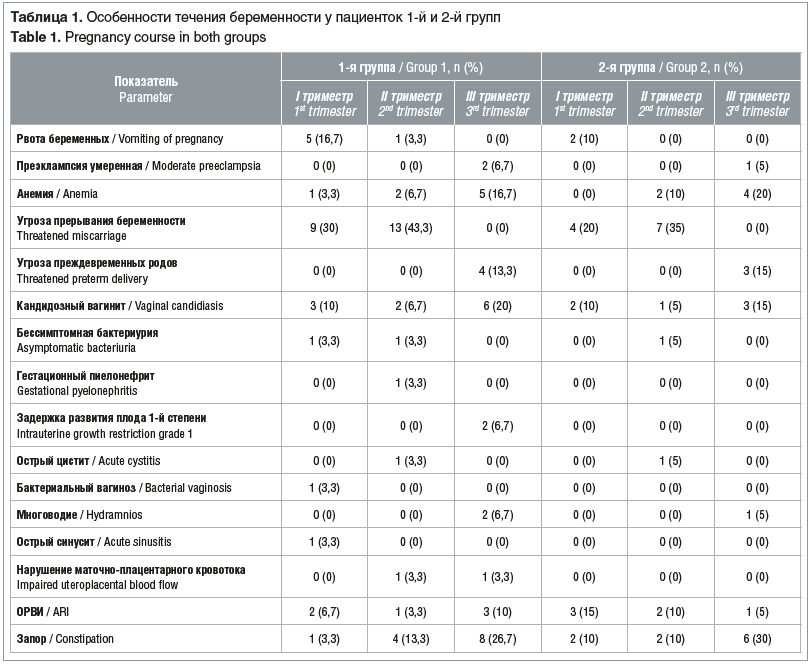
Среди осложнений у пациенток 1-й группы в I триместре преобладали рвота беременных легкой степени и угроза прерывания беременности, которые не потребовали госпитализации. Проявления угрозы прерывания беременности были купированы применением препаратов микронизированного прогестерона и препаратов магния. У каждой 3-й беременной развивался кандидозный вагинит. Значимым и наиболее распространенным осложнением II триместра была угроза прерывания беременности. Из этих пациенток 6 (46%) были госпитализированы для проведения внутривенной токолитической и гормональной терапии. Наиболее частым осложнением III триместра стал толстокишечный стаз, диагностированный в каждом 4-м случае. Умеренная преэклампсия диагностирована на сроках после 33–34 нед. и протекала с артериальным давлением до 140/90 мм рт. ст. и следовой протеинурией.
У пациенток 2-й группы (см. табл. 1) в I триместре беременность чаще всего осложнялась рвотой и кандидозным вагинитом, а также острой респираторной вирусной инфекцией (ОРВИ) с повышением температуры тела до 38 °С, а угроза прерывания беременности манифестировала у 20% женщин. Терапия, направленная на пролонгирование беременности, проводилась с применением микронизированного прогестерона и спазмолитических препаратов. Во II триместре наиболее частыми осложнениями стали толстокишечный стаз, ОРВИ и угроза прерывания беременности. В III триместре угроза преждевременных родов, потребовавшая госпитализации в стационар, диагностирована в 15% случаев. Анемический синдром развивался в каждом 5-м наблюдении.
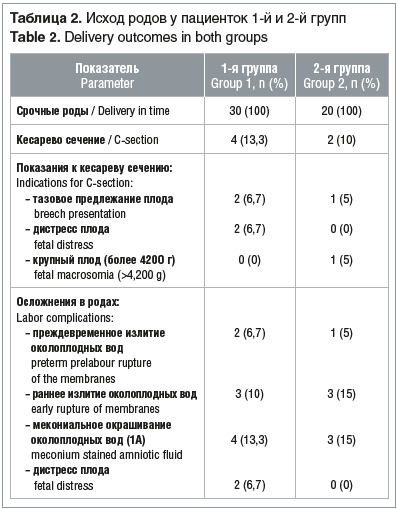
Роды произошли своевременно у всех пациенток обеих групп. Гестационный срок на момент родов составил: в 1-й группе 38,1±1,2 нед., во 2-й группе 38,4±1,1 нед. В таблице 2 представлены исходы родов у пациенток обеих групп.
Масса новорожденных у пациенток 1-й группы составила 2720–4308 г (3641±394 г), во 2-й группе — 2970–4200 г (3441±324 г). У новорожденных ни в одном случае не было выявлено синдрома дыхательных расстройств и церебральной депрессии. При наблюдении в течение года не выявлено задержки речевого развития, а результаты тестирования по системе BSID-III, проведенного в 12 мес. жизни, находились в интервале от 9 до 11 баллов у всех детей, что соответствует норме.
При цитологическом исследовании (на момент включения и через 48 ч после окончания 20-дневного курса терапии) было обнаружено, что у беременных 1-й группы плоскоклеточное интраэпителиальное поражение низкой степени злокачественности (LSIL) выявлено в трети случаев, а плоскоклеточное интраэпителиальное поражение высокой степени (HSIL) — в 43,3% случаев, у 6,7% женщин выявлялась атипия многослойного плоского эпителия, не позволяющая исключить тяжелое поражение (ASC-H), и у 10% — зафиксированы клетки плоского эпителия с атипией неясного значения (ASCUS). Во 2-й группе LSIL было подтверждено в 25%, HSIL — в 45% случаев, ASC-H — в 10% и ASCUS — в 20% случаев. После окончания курса терапии при цитологическом исследовании из 50 образцов ни в одном случае не было отмечено прогрессирования заболевания.
У пациенток 1-й группы в 5 (16,7%) случаях были зафиксированы положительные изменения результатов, проявляющиеся в нормализации цитологической картины в 3,3% случаев, регрессе с HSIL до LSIL в 6,7%, с LSIL до ASCUS в 3,3% и с HSIL до ASC-H в 3,3% случаев. Во 2-й группе после 20 дней ректального введения препарата в 15% случаев произошли изменения цитологической картины: у 1 (5%) пациентки отмечена нормализация показателей до NILM (внутриэпителиальных злокачественных изменений не выявлено), еще у 1 (5%) пациентки выявлено уменьшение выраженности изменений с HSIL до LSIL и еще у 1 (5%) — регресс с LSIL до ASCUS.
Через 6 нед. после родов по данным цитологического исследования у 40% пациенток обеих групп была выявлена нормальная цитологическая картина с заключением: NILM.
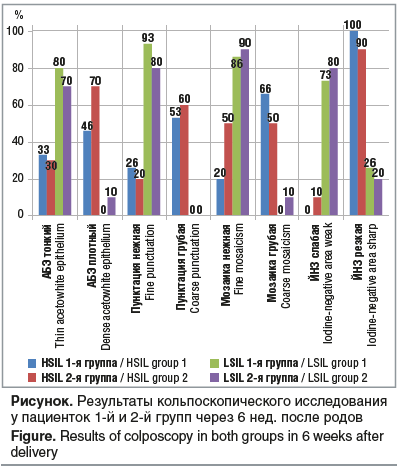
При проведении расширенной кольпоскопии оценивались локализация и площадь поражения, выраженность признаков атипической кольпоскопической картины с градацией ее на 1-ю и 2-ю степень. У всех пациенток 1-й группы была выявлена зона трансформации 1-го типа, что позволяло интерпретировать кольпоскопическое исследование как удовлетворительное. В 100% случаев у беременных с умеренной дисплазией были признаки аномальной кольпоскопической картины: в 86,4% случаев — 1-й степени и в 13,3% — 2-й степени. У беременных со слабовыраженной дисплазией в 93,3% выявлена атипическая кольпоскопическая картина 1-й степени и в 6,7% случаев — 2-й степени. У пациенток с HSIL по сравнению с пациентками с LSIL при кольпоскопии значимо чаще выявлялись грубая мозаика, пунктация и грубый ацетобелый эпителий (АБЭ) (p<0,001).
Во 2-й группе изменения кольпоскопической картины встречались у всех пациенток вне зависимости от степени тяжести дисплазии. У беременных с HSIL значимо чаще выявлялись: плотный АБЭ с ровными и четкими краями, грубые пунктация и мозаика, открытые железы с грубым ободком и резко контрастная йод-негативная зона (ЙНЗ) (p<0,001). При LSIL характерным признаком было наличие тонкого АБЭ с нечеткими и неровными границами, нежной пунктации и мозаики, открытых желез без грубого ободка и слабого неравномерного прокрашивания при нанесении раствора Люголя. Сравнительный анализ остальных показателей значимых различий не выявил.
При сравнении между группами через 6 нед. после родов не было выявлено значимых различий в частоте встречаемости патологических признаков (см. рисунок).
При гистологическом исследовании у 50% пациенток обеих групп диагностирована слабовыраженная дисплазия шейки матки. Умеренная дисплазия была представлена: CIN II у 36,7% и 40% пациенток 1-й и 2-й групп и CIN III у 13,3% и 10% соответственно (различия недостоверны). У 80% и 85% пациенток соответственно присутствовали косвенные признаки вирусной инфекции, проявляющиеся койлоцитозом. Сочетание слабовыраженных и умеренных изменений в 1 изучаемом образце биоптата шейки матки встречалось у 10% и 15% пациенток соответственно. Эти случаи в дальнейшем были включены в состав умеренной дисплазии.
Через 6 нед. после родов у 30 пациенток обеих групп по результатам цитологического исследования были выявлены изменения: у 17 (56,7%) — HSIL, у 13 (43,3%) — LSIL. В связи с выявленными изменениями проведены кольпоскопия и прицельная биопсия шейки матки. По результатам гистологического исследования в 1 (3,3%) случае была диагностирована carcinoma in situ (пациентка 1-й группы с исходным HSIL), у 16 (53,3%) пациенток с цитологическим HSIL гистологически подтвержден диагноз умеренной дисплазии CIN II–III и в дальнейшем выполнена конизация шейки матки с выскабливанием цервикального канала. Из 13 пациенток с цитологическим LSIL у 10 была выявлена слабовыраженная дисплазия (LSIL, CIN I), у 3 (23%) отмечены явления цервицита и койлоцитоза.
Обсуждение
Диагноз дисплазии шейки матки устанавливается на основании гистологического исследования, однако показанием к его проведению служит аномальный результат цитологического исследования. Согласно клиническому протоколу и приказу Минздрава России № 1130н [7] цитологическое исследование мазков с шейки матки рекомендовано проводить в I триместре беременности, если такое исследование не проводилось до наступления беременности или отсутствуют его данные.
Цитологическое исследование является скрининговым методом, позволяющим выделить пациенток для дальнейшего обследования. Подтверждающим методом служит кольпоскопическая биопсия шейки матки. Выскабливание цервикального канала во время беременности не проводится, так как это ассоциировано с увеличением риска прерывания беременности. Ограничений по сроку гестации при выполнении цитологического исследования, кольпоскопии и биопсии шейки матки нет.
Проведенное нами наблюдение продемонстрировало высокую чувствительность цитологического исследования, выполненного методом жидкостной цитологии. Совпадение цитологического и гистологического результатов было полным, в ряде случаев в одном биоптате с шейки матки обнаруживались признаки слабовыраженной и умеренной дисплазии. Проведение биопсии не было ассоциировано с развитием угрозы прерывания беременности.
Роды произошли своевременно у всех пациенток вне зависимости от тяжести дисплазии шейки матки. Средние показатели массы новорожденных и оценка по шкале Апгар не имели значимых различий между группами. Не было зафиксировано ни одного случая рождения ребенка в состоянии асфиксии или с оценкой по шкале Апгар ниже 7 баллов на 1-й минуте и 8 баллов на 5-й минуте. Интересные результаты были получены при катамнестическом анализе. Для объективной оценки показателей раннего развития ребенка использовалась шкала Бейли (BSID-III) в пяти областях: когнитивной, языковой, моторной, социально-эмоциональной и адаптивной. Социально-эмоциональная шкала BSID-III является адаптацией диаграммы социально-эмоционального роста Гринспена: скрининговая анкета для младенцев и детей младшего возраста. При наблюдении в течение года не было выявлено задержки речевого развития, а результаты тестирования, проведенного в 12 мес. жизни, показали результаты от 9 до 11 баллов у всех детей, что соответствует норме.
Через 6 нед. после родов у 40% пациенток обеих групп была выявлена нормальная цитологическая картина с заключением: NILM. У 60% пациенток выявлены цитологические изменения, в связи с этим была проведена кольпоскопия и прицельная биопсия шейки матки. По результатам гистологического исследования в 1 случае была диагностирована carcinoma in situ, у 53,3% пациенток с цитологическим HSIL гистологически подтвердился диагноз умеренной дисплазии CIN II–III и в дальнейшем выполнена конизация шейки матки. Среди 13 пациенток с цитологическим LSIL у 76,9% выявлена слабовыраженная дисплазия (LSIL, CIN I), у 23% диагноз дисплазии был снят.
Заключение
Проведенное исследование продемонстрировало, что после окончания цитокинотерапии формируется тенденция к улучшению цитологических показателей вне зависимости от способа введения лекарственного препарата. Через 6 нед. после родов нормализация цитологической картины выявлена в 40% случаев в обеих группах, улучшение цитологических показателей отмечено у 43,3% пациенток 1-й и 2-й групп. Ни в одном случае не было отмечено ухудшения в состоянии многослойного плоского эпителия шейки матки и цилиндрического эпителия цервикального канала.
Расширенная кольпоскопия, проведенная беременным с дисплазией шейки матки, подтвердила, что вне зависимости от тяжести поражения имеются изменения многослойного плоского эпителия, позволяющие определить очаг поражения для проведения в последующем прицельной биопсии шейки матки.
Сведения об авторах:
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Боровкова Екатерина Игоревна — д.м.н., доцент, профессор кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-7140-262X.
Романовская Валентина Валерьевна — к.м.н., ассистент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997,
Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-0413-5431.
Степанянц Ирина Викторовна — врач акушер-гинеколог родильного дома ГБУЗ «ГКБ № 40 ДЗМ»; 129301, Россия, г. Москва, ул. Таймырская, д. 6.
Контактная информация: Степанянц Ирина Викторовна, e-mail: apoplexia@rambler.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 10.02.2022.
Поступила после рецензирования 10.03.2022.
Принята в печать 04.04.2022.
About the authors:
Yuliya E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-7830-2290.
Ekaterina I. Borovkova — Dr. Sc. (Med.), Associate Professor, professor of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0001-7140-262X.
Valentiva V. Romanovskaya — C. Sc. (Med.), assistant of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-0413-5431.
Irina V. Stepanyants — obstetrician & gynecologist, Maternity Hospital of the City Clinical Hospital No. 40; 6, Taimyrskaya str., Moscow, 129336, Russian Federation.
Contact information: Irina V. Stepanyants, e-mail: apoplexia@rambler.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 10.02.2022.
Revised 10.03.2022.
Accepted 04.04.2022.
.
Информация с rmj.ru