Отдаленные результаты эндохирургического лечения параэзофагеальных грыж пищеводного отверстия диафрагмы
М.В. Тимербулатов1, Е.И. Сендерович1, Е.Е. Гришина1, Б.М. Гарифуллин2, Э.Ф. Гимаев2, Н.М. Казаков2, Р.К. Ибрагимов1
1 Башкирский государственный медицинский университет, Россия, 450008, Уфа, ул. Ленина, 3
2 Городская клиническая больница № 21, Россия, 450071, Уфа, Лесной проезд, 3
- Тимербулатов Махмуд Вилевич — д.м.н., профессор, заведующий кафедрой факультетской хирургии с курсом колопроктологии ФГБОУ ВО БГМУ Минздрава России, orcid.org/0000-0002-6664-1308.
- Сендерович Ефим Иосифович — к.м.н., доцент кафедры факультетской хирургии с курсом колопроктологии ФГБОУ ВО БГМУ Минздрава России.
- Гришина Елена Евгеньевна — к.м.н., ассистент кафедры факультетской хирургии с курсом колопроктологии ФГБОУ ВО БГМУ Минздрава России, тел.: 89273130662, e-mail: alyonagrishina662(а)mail.ru.
- Гарифуллин Булат Мидхатович – к.м.н., врач-хирург ГБУЗ РБ ГКБ № 21.
- Гимаев Эдуард Фоатович – врач-хирург ГБУЗ РБ ГКБ № 21.
- Казаков Никита Михайлович – врач-хирург ГБУЗ РБ ГКБ № 21.
- Ибрагимов Руслан Кабирович – к.м.н., доцент кафедры факультетской хирургии с курсом колопроктологии ФГБОУ ВО БГМУ Минздрава России.
Контакты: Гришина Елена Евгеньевна, e-mail: alyonagrishina662(а)mail.ru.
Ключевые слова: грыжа пищеводного отверстия, фундопликация, лапароскопия, сетка, глотания расстройства
Для цитирования: Тимербулатов М.В., Сендерович Е.И., Гришина Е.Е., Гарифуллин Б.М., Гимаев Э.Ф., Казаков Н.М., и др. Отдаленные результаты эндохирургического лечения параэзофагеальных грыж пищеводного отверстия диафрагмы. Креативная хирургия и онкология. 2017;7(4):4-10. DOI:10.24060/2076-3093-2017-7-4-4-10.
Введение. Существует мнение, что использование сетчатого импланта для пластики ножек диафрагмы существенно сокращает количество рецидивов грыж пищеводного отверстия диафрагмы, особенно при параэзофагеальных грыжах. Принимая во внимание многочисленные осложнения, связанные с размещением сетчатого импланта в области пищеводно-желудочного перехода, показания к протезирующей пластике диафрагмы, по-видимому, являются ограниченными. Вопрос о форме, размере, материале и способе фиксации импланта также остается открытым. По мере накопления хирургического опыта в последние годы увеличивается количество пациентов, которые не получили ожидаемого эффекта от оперативного лечения параэзофагеальных грыж, в этой связи представляется актуальным исследование отдаленных результатов лечения и выяснение причин неудач.
Материалы и методы. В клинике факультетской хирургии БГМУ на базе 1 хирургического отделения ГБУЗ РБ ГКБ №21 в 2012-2017 гг. выполнено 22 лапароскопические операции больным с параэзофагеальными грыжами (основная группа). Группу сравнения составили 87 пациентов, оперированных по поводу скользящих грыж пищеводного отверстия диафрагмы без использования сетчатого импланта. Отдаленные результаты лапароскопического хирургического лечения параэзофагеальных грыж изучены в сроки от 6 до 60 месяцев после операции.
Результаты. У 9 (53%) пациентов из основной группы и у 54 (62%) пациентов из группы контроля имели место проблемы с глотанием в раннем послеоперационном периоде. Не выявлено различий в частоте ранней послеоперационной дисфагии между группами (р=0,1345). В сроки от 6 месяцев до 5 лет после операции 13 (12%) пациентов жаловались на дисфагию различной степени тяжести. При сравнении частоты возникновения дисфагии в основной и контрольной группах получено статистически значимое различие в пользу контрольной группы: 6 пациентов (27%) против 6 пациентов (7%), р=0,027. При сравнении рентгенологических рецидивов грыж пищеводного отверстия диафрагмы выявлено явное преимущество в пользу основной группы: ни одного рентгенологического рецидива против 5 (6%) в группе контроля.
Выводы. Лапароскопическое хирургическое лечение параэзофагеальных диафрагмальных грыж III и IV типов с использованием сетчатого импланта является эффективным и безопасным методом в сроки до 5 лет после операции, однако технические детали операции остаются предметом обсуждения.
Введение
В настоящее время не вызывает сомнения, что оптимальным способом коррекции грыжевого дефекта при скользящих грыжах пищеводного отверстия диафрагмы (ГПОД) является сшивание ножек диафрагмы позади пищевода с формированием из предварительно мобилизованного дна желудка манжеты по типу Ниссен [1]. Хирургическое лечение параэзофагеальных грыж сопровождается значительно большим, по сравнению со скользящими грыжами, количеством рецидивов. Вызывает трудности выделение грыжевого мешка, задней стенкой которого, как правило, является проксимальная часть желудка [2]. Немаловажной задачей остается закрытие внушительного по размерам дефекта диафрагмы, большая часть которого находится кпереди от пищевода. Пластика местными тканями чревата разволокнением ножек диафрагмы и несостоятельностью наложенных швов [1,3]. Существуют многочисленные работы, описывающие значительно меньший процент рецидива ГПОД на фоне применения сетчатых имплантов [2,3,4,5]. С другой стороны, протезирующая пластика грозит многочисленными осложнениями, связанными с размещением сетчатого импланта вокруг пищевода, в том числе и увеличением количества пациентов со стойкой послеоперационной дисфагией [6,7,8].
Таким образом, до настоящего времени нет единой точки зрения на то, какой именно метод коррекции параэзофагеальных грыж является предпочтительным. Протезирующая пластика позволяет сократить количество рецидивов, но чревата многочисленными послеоперационными осложнениями, поэтому показания к ее применению остаются ограниченными, а размер, форма, состав и способ размещения сетчатого импланта в области пищеводного отверстия диафрагмы по-прежнему являются темой для дискуссии.
Цель исследования
Изучение отдаленных результатов эндохирургического лечения параэзофагеальных грыж пищеводного отверстия диафрагмы с использованием сетчатого импланта для пластики пищеводного отверстия диафрагмы.
Материалы и методы
В клинике факультетской хирургии БГМУ на базе 1 хирургического отделения ГБУЗ РБ ГКБ №21 в 2012-2017 гг. выполнено 22 лапароскопические операции больным с параэзофагеальными ГПОД. Среди пациентов были 18 женщин и 4 мужчины, средний возраст составил 61 год, вес в среднем 67,5 кг. Двое пациентов поступили в отделение в экстренном порядке с симптомами острой кишечной непроходимости, у одного из них во время лапароскопии выявлено ущемление содержимого грыжевого мешка.
Остальные пациенты оперированы по поводу параэзофагеальной грыжи в плановом порядке. Группу сравнения составили 87 пациентов, оперированных по поводу скользящих ГПОД без использования сетчатого импланта для пластики диафрагмы. Критериями включения служили лапароскопическая циркулярная фундопликация, крурорафия. Критериями исключения были конверсия и парциальная фундопликация.
Отдаленные результаты лапароскопического хирургического лечения ГПОД изучены в сроки от 6 до 60 месяцев после операции. Пациенты приглашались в клинику, где проводилось исследование жалоб путем заполнения анкеты, предназначенной для выявления симптомов, связанных с желудочно-пищеводным рефлюксом и перенесенной операцией.
Также выполнены полипозиционное рентгеноконтрастное исследование пищеводно-желудочного перехода, исследование моторики пищевода (система 8-ми канальной водноперфузионной манометрии Гастроскан – Д, Россия, Фрязино) в сроки от 6 до 60 месяцев после оперативного лечения.
Описательную статистику для качественных показателей вычисляли как количество и процент пациентов для каждого значения показателя. Соответствие вида распределения закону нормального распределения проводилось с помощью критериев Колмогорова-Смирнова и Шапиро-Уилка. Для выявления различий между методами лапароскопической фундопликации по частоте возникновения дисфагии использовали точный тест Фишера. Для сравнения медиан давления нижнего пищеводного сфинктера (НПС), медиан процента релаксации НПС в ответ на глоток, медиан остаточного давления НПС после релаксации в основной и контрольной группах использовали тест Манна-Уитни. Статистические гипотезы рассматривались как двусторонние с уровнем значимости 0,05. Группы сопоставимы по полу, возрасту, демографическим показателям. Обработка данных произведена с использованием программы Stat Soft Statistica 10,0.
Результаты
Основными жалобами пациентов в основной группе были боль в грудной клетке – 65%, боль в эпигастрии – 47%, изжога – 41%, тошнота – 18%, рвота – 24%, регургитация – 12%, дисфагия – 12%, бессимптомное течение – 12%. В контрольной группе превалировали жалобы на изжогу – 98%.
В структуре параэзофагеальных грыж в основной группе 64% — грыжи II типа, когда пищеводно-желудочный переход фиксирован, дно желудка, иногда и весь желудок, смещаются в полость средостения, 18% — III типа, когда пищеводно-желудочный переход смещается вместе с желудком в полость средостения, 14% — IV типа, когда в грыжевом мешке кроме желудка находятся другие органы [6].
У 18 (82%) пациентов основной группы и у 81 (93%) пациента при эндоскопическом исследовании до оперативного лечения были выявлены признаки эзофагита I и II степеней, у 6 (7%) пациентов контрольной группы имел место эзофагит III и IV степеней согласно классификации Savary-Miller.
Технические детали операции. У пациентов основной группы во всех случаях тракционными движениями книзу грыжевой мешок полностью выделен из полости заднего средостения при помощи гармонического ультразвукового скальпеля. На этом этапе важно с особой осторожностью производить мобилизацию задней стенки мешка, которая, как правило, представлена задней стенкой дна желудка (рис. 1). Из этих соображений выделение грыжевого мешка целесообразно начинать с передней полуокружности.
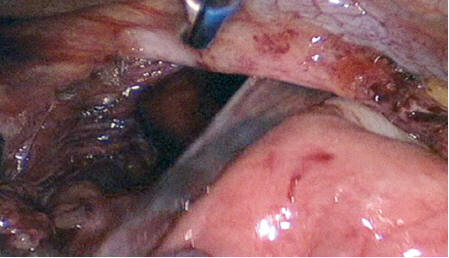
Рис. 1. Этап выделения грыжевого мешка из полости средостения
Мобилизованы ножки диафрагмы и пищевод c идентификацией и сохранением стволов правого и левого блуждающих нервов. После высокого пересечения пищеводно-диафрагмальной мембраны в полости заднего средостения длина абдоминального отдела пищевода во всех случаях оказалась достаточной. Позади пищевода наложены Z-образные швы на ножки диафрагмы нитью Тикрон 2,0. Швы на ножках укрыты полипропиленовым сетчатым имплантом U-образной формы с антиадгезивным покрытием, который фиксирован к диафрагме с помощью герниостеплера (рис. 2).
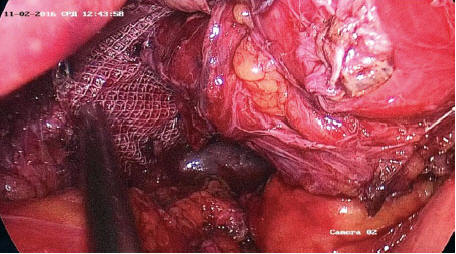
Рис. 2. Размещение сетчатого импланта позади пищевода и фиксация герниостеплером
Короткие желудочные сосуды в области проксимальной части дна желудка пересечены с помощью ультразвукового скальпеля. На передней стенке пищевода сформирована симметричная манжета из передней и задней стенок желудка, фиксированная 3 узловыми швами без фиксации к пищеводу. Длина манжеты не превышала 2 см.
В группе контроля выполнена лапароскопическая задняя крурорафия и фундопликация с пересечением коротких желудочных сосудов. Манжета длиной не более 2,5 см сформирована на передней стенке пищевода без фиксации к пищеводу.
Среднее время операции составило 120±27,5 мин. Среди интраоперационных осложнений чаще всего случался пневмоторакс (5 пациентов) как следствие выделения грыжевого мешка и обширной диссекции пищеводно-диафрагмальной мембраны в полости средостения. Кровотечения из ткани печени имели место при использовании веерообразного ретрактора для отведения левой доли печени (3 пациента). Конверсия произведена дважды в основной группе в связи со сложностями при выделении грыжевого мешка из полости заднего средостения на этапе освоения методики.
У 9 (53%) пациентов основной группы и у 54 (62%) пациентов группы контроля имели место проблемы с глотанием в раннем послеоперационном периоде, которые, по-видимому, связаны с воспалением и отеком тканей. Дисфагия либо проходила самостоятельно на 2-3 сутки, либо купировалась на фоне введения небольших доз дексаметазона. Не выявлено различий в частоте ранней послеоперационной дисфагии между группами (р=0,1345).
В сроки от 6 месяцев до 5 лет после операции 13 (12%) пациентов жаловались на дисфагию различной степени тяжести. При сравнении частоты возникновения дисфагии в основной и контрольной группах получено статистически значимое различие в пользу контрольной группы: 6 пациентов (27%) против 6 пациентов (7%), р=0,027. Но надо заметить, что большинство пациентов с дисфагией из группы с протезирующей пластикой диафрагмы имели легкую дисфагию на твердую пищу и не нуждались в реконструктивной операции. У 2 пациентов из контрольной группы выявлена дисфагия III и IV степеней, выполнена рефундопликация (рис. 3).
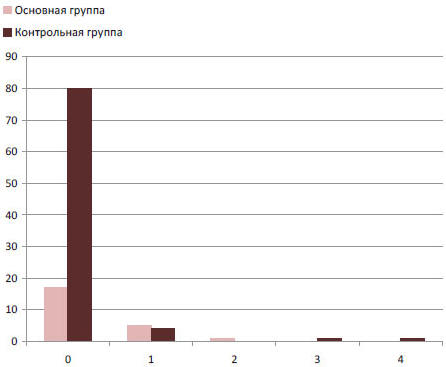
Рис. 3. Стойкая послеоперационная дисфагия в основной и контрольной группах: 0-нет дисфагии; 1-легкая дисфагия на твердую пищу; 2-выраженная дисфагия на твердую пищу; 3-легкая дисфагия на жидкую пищу; 4- выраженная дисфагия на жидкую пищу
Ни один пациент из основной группы не жаловался на изжогу в отдаленном послеоперационном периоде. При сравнении рентгенологических рецидивов ГПОД выявлено явное преимущество в пользу основной группы: ни одного рентгенологического рецидива против 5 (6%) в группе контроля. У 3 пациентов основной группы обнаружено умеренное расширение контуров пищевода с замедлением эвакуации контрастного вещества.
Манометрия пищевода в отдаленном послеоперационном периоде выявила статистически значимо более высокое давление нижнего пищеводного сфинктера (НПС) и более высокое остаточное давление, соответственно, более низкий процент релаксации НПС у пациентов с протезирующей пластикой диафрагмы (р=0,00001) (рис. 4).
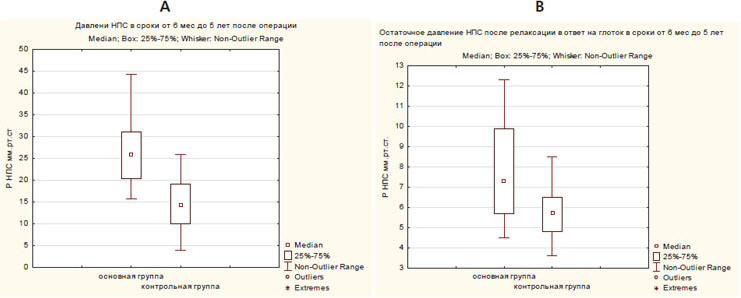
Рис. 4. Давления НПС (А) и остаточное давление НПС после релаксации в ответ на глоток (В) в отдаленном послеоперационном периоде в основной и контрольной группах
Обсуждение
В последние 10 лет значительно увеличилось количество лапароскопических операций, направленных на устранение параэзофагеальных грыж [8].
Летальность при лапароскопическом хирургическом лечении параэзофагеальных грыж III и IV степеней на сегодняшний день составляет менее 0,5%, при том, что пациенты чаще всего имеют преклонный возраст и сопутствующую соматическую патологию [8].
Помимо рецидива грыжи стойкая послеоперационная дисфагия является самым распространенным осложнением оперативного лечения ГПОД, частота которого составляет по данным различных авторов от 3 до 30 % [9].
По данным некоторых авторов использование сетчатого импланта для пластики пищеводного отверстия диафрагмы увеличивает риск развития стойкой дисфагии в отдаленном послеоперационном периоде [9].
Также большинство ведущих специалистов в области антирефлюксной хирургии сходятся во мнении, что при большом размере пищеводного отверстия диафрагмы необходимо выполнять протезирующую пластику с целью минимизации риска рецидива [10]. По данным литературы рецидивы параэзофагеальных грыж при выполнении крурорафии для ликвидации грыжевых ворот без имплантации сетчатого протеза составляют 42% [2].
Тем не менее не разработаны четкие критерии для классификации параэзофагеальных грыж в зависимости от площади поверхности пищеводного отверстия диафрагмы (ПППОД). В.В. Грубник предлагает грыжи с ПППОД<10 см2 называть малыми грыжами и выполнять единственно крурорафию; при ПППОД от 10 до 20 см2 грыжи считать большими и выполнять крурорафию в сочетании с протезирующей пластикой сетчатым имплантом; при ПППОД более 20 см2 грыжи называть гигантскими, выполнять пластику сетчатым имплантом без натяжения [4].
В нашем исследовании использование сетчатого протеза действительно привело к значительно большему количеству пациентов со стойкой послеоперационной дисфагией, но, принимая во внимание, что во всех случаях имела место легкая дисфагия на твердую пищу, существенно не изменившая качество жизни пациентов, такой результат можно считать приемлемым. Значительно большее количество рецидивов ГПОД в группе пациентов без использования сетчатого импланта позволяет считать оправданным выполнение протезирующей пластики диафрагмы при параэзофагеальных ГПОД с целью минимизации несостоятельности швов на ножках диафрагмы, при наличии натяжения, при сопоставлении, при значительных размерах грыжевого дефекта.
Существует достаточное количество исследований, доказывающих, что любая антирефлюксная операция, дополненная крурорафией, статистически значимо повышает давления НПС, по сравнению с величиной давления НПС до операции. В нашем исследовании использование сетчатого импланта для пластики диафрагмы способствовало значительно более высокому давлению НПС, по сравнению с пациентами, у которых выполнена только крурорафия.
Эти данные находятся в логическом соответствии с публикациями некоторых авторов об отсутствии влияния длины фундопликационной манжеты на тонус НПС [11,12], а также работами, доказывающими, что основной компонент, формирующий тонус НПС, составляет сокращение ножек диафрагмы [13].
Дискуссионным является вопрос о необходимости формирования фундопликационной манжеты у пациентов с параэзофагеальной грыжей при отсутствии симптомов рефлюкса до операции. Учитывая мнение зарубежных авторов, заверяющих, что манипуляции в области пищеводно-желудочного перехода могут послужить причиной манифестации желудочно-пищеводного рефлюкса, во всех случаях нами выполнена фундопликация по Ниссену с мобилизацией дна желудка [2].
Заключение
Лапароскопическое хирургическое лечение параэзофагеальных диафрагмальных грыж III и IV типов с использованием сетчатого импланта является эффективным и безопасным методом в сроки до 5 лет после операции, однако технические детали операции остаются предметом обсуждения.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Информация о спонсорстве. Данная работа не финансировалась.
Список литературы/References
- Dallemagne B., Perretta S. Twenty years of laparoscopic fundoplication for GERD. World J Surg. 2011;35(7):1428-35. DOI: 10.1007/s00268-011-1050-6.
- Lebenthal A., Waterford S.D., Fisichella P.M Treatment and controversies in paraesophageal hernia repair. Front Surg. 2015;2:13. DOI: 10.3389/ fsurg.2015.00013.
- Sasse K.C, Warner D.L., Ackerman E., Brandt J. Hiatal hernia repair with novel biological graft reinforcement. JSLS. 2016;20(2):e2016.00016. DOI: 10.4293/JSLS.2016.00016.
- Грубник В.В., Малиновский А.В. Лапароскопическая пластика грыж пищеводного отверстия диафрагмы: новая классификация, основанная на отдаленных результатах. Эндоскопическая хирургия. 2014;20(1):9-15. [Grubnik V.V., Malinovskiĭ A.V. Laparoscopic plasty of hiatal hernias: new classification based on long-term results. Endoskopicheskaya khirurgiya=Endoscopic surgery. 2014;20(1):9-15 (in Russ.)].
- Muller-Stich B.P., Senft J.D., Lasitschka F., Shevchenko M., Billeter A.T., Bruckner T., et al. Polypropylene, polyester or polytetrafluoroethylene is there an ideal material for mesh augmentation at the esophageal hiatus? Results from an experimental study in a porcine model. Hernia. 2014;18(6):873-81. DOI: 10.1007/s10029-014-1305-x.
- Stavros A., Koch O., Antoniou G.A., Pointner R., Granderath F.A. Mesh-reinforced hiatal hernia repair: a review on the effect on postoperative dysphagia and recurrence. Langenbecks Arch Surg. 2012;397(1):19-27. DOI: 10.1007/s00423-011-0829-0.
- Тимербулатов М.В., Сендерович Е.И., Санников Е.Н. Опыт лапароскопического хирургического лечения параэзофагеальных грыж пищеводного отверстия диафрагмы. Пермский медицинский журнал. 2014;31(5):22-29. [Timerbulatov M.V., Senderovich E.I., Sannikov E.N. Experience of laparoscopic surgical treatment of paraesophageal hiatal hernias. Perm Medical Journal. 2014;31(5):22-29 (in Russ.)].
- Makris K.I., Cassera M.A., Kastenmeier A.S., Dunst C.M., Swanstrom L.L. Postoperative dysphagia is not predictive of long-term failure after laparoscopic antireflux surgery. Surg Endosc. 2012;26(2):451-7. DOI: 10.1007/s00464-011-1898-4.
- Mickevičius A., Endzinas Z Ž., Kiudelis M., Jonaitis L., Kupčinskas L., Pundzius J., et al. Influence of wrap length on the effectiveness of Nissen and Toupet fundoplications: 5-year results of prospective, randomized study. Surg Endosc. 2013;27(3):986-91. DOI: 10.1007/s00464-012-2550-7.
- Niebisch S., Peters J.H. Update on fundoplication for the treatment of GERD. Curr Gastroenterol Rep. 2012;14(3):189-96. DOI: 10.1007/ s11894-012-0256-6.
- Тимербулатов М.В., Сендерович У.И., Гришина Е.Е., Гарифуллин Б.М., Сахабутдинов А.М., Рахимов Р.Р. Давление нижнего пищеводного сфинктера как прогностический критерий результата антирефлюксной операции. Эндоскопическая хирургия. 2015;21(6):21-29. [Timerbulatov M.V., Senderovich E.I., Grishina E.E., Garifullin B.M., Sakhabutdinov A.M., Rakhimov R.R. Pressure of the lower esophageal sphincter as a prognostic test result of antireflux surgery. Endoskopicheskaya khirurgiya=Endoscopic surgery. 2015;21(6):21-29 (in Russ.)].
- Panda A., Bhalla A.S., Sharma R., Arora A., Gupta A.K. «Straddling across boundaries»- thoracoabdominal lesions: spectrum and pattern approach. Curr Probl Diagn Radiol. 2015;44(2):122-43. DOI: 10.1067/j.cpradiol.2014.11.005.
- Pallati P.K., Shaligram A., Shostrom V.K., Oleynikov D., McBride C.L., Goede M.R. Improvement in gastroesophageal reflux disease symptoms after various bariatric procedures: review of the Bariatric Outcomes Longitudinal Database. Surg Obes Relat Dis. 2014;10(3):502-7. DOI: 10.1016/j.soard.2013.07.018.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru