Особенности течения вторичной легочной гипертензии у ребенка с экстремально низкой массой тела при рождении
Содержание статьи
Актуальность
Легочная артериальная гипертензия (ЛАГ) — это гетерогенное, часто многофакторное состояние, которое может быть как самостоятельной, изолированной патологией, так и осложнением большого спектра заболеваний, включая врожденные пороки сердца, бронхолегочную дисплазию (БЛД), бронхиальную астму, генетические и хромосомные болезни, заболевания соединительной ткани и другую патологию. По различным оценкам, распространенность ЛАГ в детском возрасте редкая, примерно 2–16 случаев на 1 млн детского населения. Однако в некоторых группах риска эта патология встречается во много раз чаще [1, 2]. Значительная часть, более 30% случаев, ЛАГ связана с патологией органов дыхания, в т. ч. с БЛД [3, 4]. Следует признать, что распространенность легочной гипертензии часто недооценивают. Обычно она расценивается как продолжительный динамический процесс, который может проявиться только на поздних стадиях хронического бронхолегочного заболевания. Начальная стадия ЛАГ протекает с небольшим, часто интермиттирующим увеличением давления в легочной артерии, которое не требует значительного усиления работы правого желудочка и, как правило, не имеет ранних клинических проявлений [5, 6]. Поэтому диагностика ЛАГ в начальной стадии зависит от многих факторов, включая возраст пациента, тяжесть сопутствующей патологии, тип поражения сердца и, в первую очередь, от информированности специалистов об этой патологии, встречающейся в самом раннем детском возрасте.
У детей первых месяцев жизни ведущее место отводится вторичной легочной гипертензии [7]. Наиболее выраженные изменения легочной гемодинамики у младенцев, как правило, имеются при БЛД, хроническом бронхиолите и другой хронической обструктивной патологии легких [8–10].
У пациентов с БЛД легочная гипертензия может быть связана с перемежающейся хронической гипоксией, гиперкапнией, повреждением ткани легкого и воздухоносных путей, диастолической дисфункцией, задержкой роста сосудов и стенозом легочных вен [11]. Одной из основных причин является артериальная гипоксемия вследствие гиповентиляции. Давление в легочной артерии зависит от изменений легочного кровотока из-за повреждения эндотелия легочных сосудов. Дисфункция эндотелия этих сосудов приводит к нарушению синтеза простагландинов и простациклина, а также к выраженному повышению продукции тромбоксана и эндотелина-1 на фоне существенного уменьшения образования оксида азота. Эти нарушения способствуют дополнительной вазоконстрикции, увеличению легочного сосудистого сопротивления, и ЛАГ принимает хронический характер [12].
Как описали еще в прошлом веке W.J. Northway et al. (1967), БЛД может возникать после длительной искусственной вентиляции легких (ИВЛ) и кислородотерапии преимущественно у недоношенных новорожденных. Однако за последние годы на фоне успехов и достижений перинатологии проблема выхаживания недоношенных детей, особенно рожденных с экстремально низкой массой тела (ЭНМТ), стала еще более актуальной в силу высокой летальности в неонатальном периоде. В этом периоде у детей с низкой массой тела при рождении риск летальности усугублен развитием таких заболеваний, как сепсис, врожденные инфекции, пневмонии и БЛД, распространенность которой значительно варьирует, по данным различных источников, и составляет до 30% среди детей, получавших ИВЛ, особенно длительную [13]. Частота развития БЛД у новорожденных имеет обратную корреляцию с массой тела при рождении и зависит от сроков и режимов проведения ИВЛ и кислородотерапии. Хочется подчеркнуть, что у детей с ЭНМТ тяжесть изменений сердечно-сосудистой системы и БЛД, а также прогрессирование ретинопатии, как правило, являются звеньями одной цепи, в основе которой лежит глубокая морфофункциональная незрелость органов и систем [14, 15].
В современных условиях, несмотря на оптимизацию сроков ИВЛ, рациональное использование сурфактанта, сохраняется высокий риск летальности, обусловленный, в частности, прогрессирующей легочной гипертензией. Наряду с этим встречаются случаи ЛАГ, при которых можно достичь менее тяжелого течения заболевания и при своевременной корригирующей терапии получить исход в виде значительного улучшения или даже выздоровления. По-прежнему ощущается нехватка данных по индивидуальному подходу и оптимальному ведению детей с легочной гипертензией [1, 16]. Все это обусловливает актуальность проблемы ранней диагностики и адекватного лечения детей с ЛАГ на фоне БЛД и врожденных пороков сердца.
Клиническое наблюдение
С целью акцентирования внимания на этой проблеме педиатров, детских кардиологов и пульмонологов приводим интересный клинический случай течения ЛАГ на фоне сочетания БЛД и врожденного порока сердца у ребенка с ЭНМТ при рождении.
Ребенок А. женского пола, от 1-й беременности, протекавшей с угрозой прерывания в первой и второй половине, рожден от 1-х преждевременных родов на 26-й нед. гестации, путем операции «кесарево сечение», с массой 870 г и длиной 34 см, с оценкой по шкале Апгар 4/6 баллов.
С первых часов жизни у девочки отмечалось тяжелое состояние с проявлением синдрома дыхательных расстройств. Проводились реанимационные мероприятия с применением ИВЛ, кислородотерапии, заместительная терапия сурфактантом, режим кувеза. На 2-е сут жизни выявлен гемодинамически значимый открытый артериальный проток (ОАП), применен ибупрофен внутривенно 3 дозы по обычной схеме, без положительного эффекта. В динамике проявления сердечной недостаточности нарастали. В связи с этим ребенок получал сердечные гликозиды, дофаминомиметики, β-адреномиметики (допамин, дигоксин, добутамин). На этой терапии состояние несколько стабилизировалось, хотя оставалось тяжелым. Отмечалась стойкая дыхательная недостаточность III степени, с 3-х сут отмечены анемия (Hb 102 г/л), гематурия, аускультативно в легких выслушивались мелкопузырчатые хрипы и крепитация с обеих сторон. На 8-е сут жизни выявлены рентгенологические изменения в виде двустороннего снижения пневматизации за счет нежных инфильтративных затенений в обоих легких с усилением бронхососудистого рисунка за счет интерстициального компонента (рис. 1), лейкоцитоз (21,0×109/л), имелась отрицательная динамика в анализах крови на 1-й нед. жизни (нарастание лейкоцитоза, СОЭ, снижение гемоглобина).
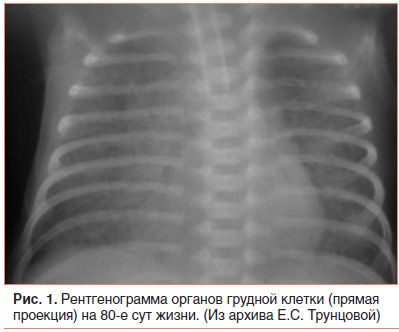
Был выставлен диагноз: Неонатальная пневмония, двусторонняя, очаговая, тяжелой степени тяжести, стадия инфильтрации. ДН III степени. Микробиологический посев из зева и эндотрахеального аспирата выявил Klebsiella pneumoniae. Кроме того, у ребенка с отягощенным акушерским анамнезом, артериитом и флебитом пупочных сосудов, анемией, пневмонией регистрировались признаки SIRS (тромбоцитопения, нарушение терморегуляции, воспалительные изменения в крови), которые предполагали ведение его как угрожаемого по неонатальному сепсису. В связи с множеством заболеваний девочка получала комплексную терапию (в т. ч. антибактериальную) и продолжала длительно находиться на ИВЛ (FiO2 0,45; f 40 в 1 мин; piр. 19 мм в. ст.; SaO2 90–92%). Периодически предпринимались попытки снизить параметры ИВЛ, однако из-за стойкой гиперкапнии (pCO2 55 мм рт. ст.) и гипоксии (рО2 24 мм рт. ст.), ацидоза, по данным кислотно-щелочного состава крови (лактат 1,1 ммоль/л; сНСО3 38,2 ммоль/л; ВЕ 12,3 ммоль/л), низких показателей сатурации кислорода экстубировать ребенка не удавалось.
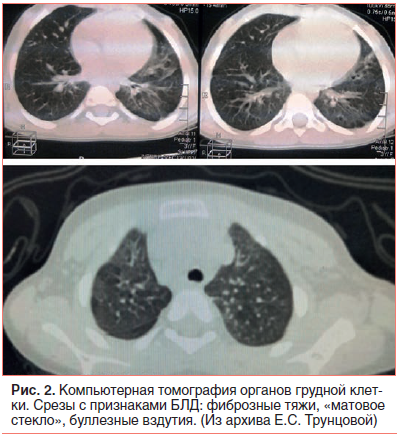
С 28-го дня жизни в соответствии с комплексом критериев [14] был выставлен диагноз: Бронхолегочная дисплазия недоношенных, новая форма, тяжелой степени. Основным моментом для постановки диагноза стала потребность в кислороде концентрацией более 21% на 28-е сут жизни, кислородозависимость в 36 нед. постконцептуального возраста свидетельствовала о тяжелом течении БЛД. На компьютерной томограмме были выявлены основные признаки БЛД — фиброзные тяжи, «матовое стекло», буллезные вздутия (рис. 2). По поводу заболевания ребенок получал терапию ингаляционным глюкокортикостероидом (ИГКС) будесонидом в дозе 1,0 мг/сут, муко- и бронхолитическую терапию через небулайзер (амброксол, фенотерол, ипратропия бромид).
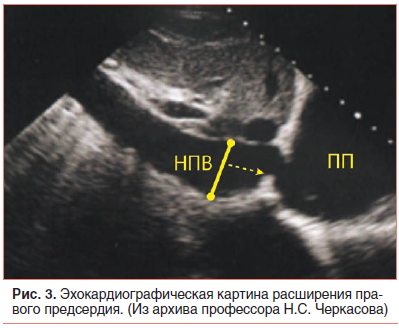
В возрасте 2,5 мес. жизни подтвержден диагноз: Врожденный порок сердца (ВПС): ОАП. На ЭХО-КГ: ОАП 3,5 мм со сбросом крови в легочную артерию с градиентом 4 мм рт. ст., аневризма межпредсердной перегородки (АМПП) и открытое овальное окно 3,5 мм со сбросом крови справа налево, высокая ЛАГ 89 мм рт. ст. с расширением правого предсердия (ПП) (рис. 3).
На ЭКГ выявлялись признаки перегрузки ПП. Рентгенографически: признаки расширения правых отделов сердца. В гемограмме: анемия Hb 90 г/л, Эр 3,88 × 1012/л, ЦП 0,9, лейкоцитарная формула без признаков воспаления. Глюкоза крови составляла 5,0 ммоль/л, креатинин 51,5 ммоль/л, АЛТ 0,5 мкмоль/л, АСТ 0,94 мкмоль/л. В возрасте 3,5 мес. в Федеральном центре сердечно-сосудистой хирургии (Астрахань) проведена операция по поводу ОАП (лигирование). Ранний послеоперационный период прошел без осложнений.
По поводу выявленной патологии ВПС + ЛАГ ребенок получал комплексную терапию, включающую кислородотерапию, диуретики (спиронолактон под контролем креатинина и калия), силденафил (в дозе 3,5 мг × 4 р./сут), дигоксин в поддерживающей дозе (10 мг/кг/сут), добутамин (1,5 мкг/кг/мин). Состояние ребенка стабилизировалось, одышка уменьшилась, улучшился аппетит, и девочка начала прибавлять в массе тела от 350 г и более за неделю.
Выставлен диагноз: Глубокая недоношенность (26 нед. гестации). БЛД недоношенных, новая форма, тяжелой степени тяжести, дыхательная недостаточность II степени. ВПС: ОАП, сердечная недостаточность IIА стадии, ФК II, малая аномалия развития сердца: открытое овальное окно. Последствия гипоксического поражения ЦНС, синдром угнетения. Ранняя анемия недоношенных средней степени тяжести. Ретинопатия сетчатки обоих глаз III стадии, активная фаза.
Далее на фоне лечения и положительной клинико-лабораторной динамики (прирост весоростовых показателей, отсутствие воспалительных изменений в гемограмме, отрицательные показатели СРБ и ПКТ, отсутствие патологических отклонений остальных биохимических показателей, улучшение показателя SaО2: 94–95%) на 65-й день жизни ребенок был экстубирован и переведен на самостоятельное дыхание. Ингаляционная терапия по поводу тяжелой БЛД ИГКС (будесонидом) была продолжена в прежнем объеме.
На фоне стабилизации состояния в возрасте 5 мес. проведено оперативное лечение ретинопатии недоношенных (в Санкт-Петербургском государственном педиатрическом медицинском университете Минздрава России, отделении патологии новорожденных и детей грудного возраста). После операции в динамике у ребенка сохранялась стойкая дыхательная недостаточность (ЧДД 42–44, при беспокойстве до 85 в минуту; SаО2 90–94%), с которой связана продолжительная кислородная поддержка, общая продолжительность получения воздушно-кислородной смеси составила около 6 мес.
Амбулаторно ребенок наблюдался у педиатра, пульмонолога, кардиолога с диагнозом: Бронхолегочная дисплазия недоношенных, новая форма, тяжелой степени тяжести, осложненная вторичной высокой легочной гипертензией (89 мм рт. ст.). Состояние после коррекции ВПС (лигирование ОАП, АМПП, открытое овальное окно, эктопическая хорда в полости левого желудочка). Парез левой голосовой связки. Последствия гипоксического поражения ЦНС. Задержка физического и моторного развития. Ретинопатия сетчатки обоих глаз III стадии, активная фаза (оперативное лечение: транспупиллярная лазеркоагуляция сетчатки). Анемия недоношенных средней степени. Белково-энергетическая недостаточность III степени.
На протяжении первого года жизни ребенок имел крайне низкое физическое развитие, дисгармоничное за счет дефицита массы (в 1 год масса 6,0 кг и длина тела 58 см) -6,2SD и -3,2SD по росту и массе соответственно [17]. Обращали на себя внимание повышенная слабость, утомляемость, сухой кашель в течение дня, периодически стридорозное дыхание, одышка в покое смешанного характера от 65 дыхательных движений в минуту в покое, ремиссии и до 82 в минуту в периоды обострения БЛД. Сатурация кислородом в периферической крови при пульсоксиметрии составляла 90–95%. За период наблюдения наиболее тяжелое ухудшение состояния отмечалось дважды в возрасте 6 мес. и 8 мес., что было связано с респираторными инфекциями.
Девочка получала базисную терапию БЛД препаратом будесонид в дозе 1,0 мг/сут с момента установления диагноза непрерывно в течение 6 мес., затем 0,5 мг 1 р./сут в течение 6 мес. В период обострения заболевания доза ИГКС увеличивалась до 2,0 мг/сут, для купирования одышки применялся ипратропия бромид в дозе 0,075 мг (до 6 капель).
При амбулаторном лечении по поводу легочной гипертензии был продолжен курс силденафила в дозе 4 мг/кг/сут × 4 р./сут в течение 2 нед., затем 1 мг/кг/сут в течение 6 мес., спиронолактон 2 мг/кг × 2 р./сут.
За время наблюдения в течение 1 года систолическое давление в легочной артерии (СДЛА) имело положительную динамику. На ЭКГ регистрировался синусовый ритм, миграция водителя ритма, электрическая ось сердца резко отклонена вправо, â=+150°, ЧСС 120–150 в минуту, PQ 0,1. На ЭХО-КГ отмечается: состояние после лигирования ОАП, проток закрыт герметично, пограничные размеры правых камер сердца (правый желудочек 1,77 см; ПП 1,76 см). Глобальная сократимость левого желудочка не нарушена. Фракция выброса SF 60%. Эктопическая хорда в полости левого желудочка. Митральная регургитация 0–I степени. Трикуспидальная регургитация I степени. Легочная артерия 1,46 см, СДЛА 46 мм рт. ст. Перикард без особенностей. Максимальный градиент давления на Ао 8,1 мм рт. ст. Сатурация О2 94%.
На фоне лечения отмечена положительная динамика СДЛА с 89 до 46 мм рт. ст., клинические признаки ЛАГ значительно уменьшились, сохраняются признаки БЛД и последствия гипоксического поражения ЦНС, задержки физического и психомоторного развития, перенесенной коррекции ВПС.
Заключение
Таким образом, данный клинический случай демонстрирует развитие легочной гипертензии на фоне БЛД и врожденного порока сердца у ребенка с экстремально низкой массой тела. Авторы пытались акцентировать внимание педиатров, детских кардиологов и пульмонологов на проблеме ЛАГ, которая расценивалась как вторичная, ассоциированная с двумя основными тяжело протекающими заболеваниями. На фоне комплексного адекватного лечения БЛД, своевременной коррекции ВПС (ОАП) и терапии ЛАГ (силденафилом) к концу первого года жизни наступила положительная динамика в течении БЛД, врожденного порока сердца, в физическом развитии ребенка, и ЛАГ приобрела стабильное течение с тенденцией к дальнейшему снижению СДЛА.
Информация с rmj.ru





