Введение
Хронический атрофический гастрит (ХАГ) известен как состояние с повышенным онкогенным потенциалом [1]. Успешное лечение предраковых состояний слизистой оболочки желудка представляется перспективным направлением, нацеленным на снижение заболеваемости раком желудка и, как следствие, снижение инвалидизации и смертности [2]. Сегодня в международном сообществе отсутствуют общепризнанные подходы к терапии ХАГ, кроме эрадикации Helicobacter pylori, которая обусловливает регресс воспалительных изменений, а в ряде случаев и атрофии [1, 3]. Терапия же атрофического аутоиммунного гастрита (АИГ) пока представляет собой малоизученную область.
Ребамипид считается универсальным эпителиопротектором, более того, в когортном популяционном исследовании среди лиц, прошедших эндоскопическую подслизистую резекцию желудка по поводу ранних новообразований с 2011 по 2014 г., выявлено снижение риска рака желудка в группе терапии высокими дозами ребамипида (≥9000 мг) по сравнению с низкими дозами (<9000 мг) (отношение рисков 0,858, 95% доверительный интервал (ДИ) 0,739–0,995; p=0,043) [4]. В литературе описан ряд исследований, представляющих опыт применения годичной терапии ребамипидом при ХАГ, одно из которых было проведено в Японии: среди пациентов с H. pylori-ассоциированным ХАГ наблюдалось снижение воспаления в области малой кривизны тела желудка в группе ребамипида, а также отмечалась положительная динамика серологических маркеров воспаления и атрофии [5].
В другом плацебо-контролируемом исследовании в основной группе у пациентов, не инфицированных H. pylori, через год терапии наблюдалось статистически значимое снижение выраженности атрофии (p=0,028) и кишечной метаплазии (p=0,02) в антральном отделе [6]. Длительное лечение ребамипидом продемонстрировало хороший профиль безопасности, с редкими побочными эффектами (запор, кожные проявления, диспепсические симптомы) [6, 7].
Ранее нами были представлены промежуточные данные 6-месячной терапии ребамипидом у пациентов с ХАГ [8]. В настоящей статье мы демонстрируем окончательные результаты 12-месячного исследования эффективности препарата.
Цель исследования: оценить эффективность применения ребамипида в течение 12 мес. у пациентов с ХАГ.
Содержание статьи
Материал и методы
Рандомизированное одноцентровое проспективное исследование «ОПЛОТ» проведено в ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России с участием 178 пациентов (средний возраст 57 (48–65) лет). По этиологии были выделены три группы: пациенты с АИГ, постэрадикационным ХАГ, ХАГ смешанной этиологии (постэрадикационный + АИГ). Средние сроки после эрадикации составили 8 (2–12) мес. Критерии включения/невключения пациентов в исследование указаны в работе [8]. Для подтверждения этиологии гастрита определяли содержание IgG к H. pylori, антител к париетальным клеткам и внутреннему фактору Касла, наличие антигена H. pylori в кале. Оценку уровня антител к париетальным клеткам (норма — менее 1:40) и антител к внутреннему фактору Касла (норма — менее 6 Ед/мл) в сыворотке крови проводили методом иммуноферментного анализа (ИФА).
В каждой группе были выделены основная и контрольная подгруппы. Пациенты основных подгрупп получали ребамипид (Ребагит®, ПРО.МЕД.ЦС Прага АО) в дозе 300 мг/сут в течение 12 мес., контрольных — только симптоматическую терапию. Исходно, через 6 и 12 мес. оценивали уровни пепсиногена-I (П-I), пепсиногена-II (П-II), гастрина-17, соотношение П-I/П-II в крови, динамику стадии атрофии и степени воспаления по OLGA. Для определения указанных лабораторных показателей использовали образцы крови после ночного голодания, которые собирали в вакуумные пробирки для получения плазмы с K2ЭДТА. После центрифугирования плазму отбирали в пробирки объемом 1,0 мл и замораживали при температуре -20 °C до момента анализа. Лабораторные исследования проводили методом ИФА с использованием реагентов GastroPanel (Biohit, Финляндия).
Для статистического анализа использовали программу StatTech v. 3.0.9 (ООО «Статтех», Россия). Для оценки динамики морфологических данных (стадии и степени атрофии) был рассчитан критерий Уилкоксона. Межгрупповые различия определяли с помощью критерия χ2 Пирсона. Более подробно статистические методы указаны в ранее опубликованной работе [8].
Результаты исследования
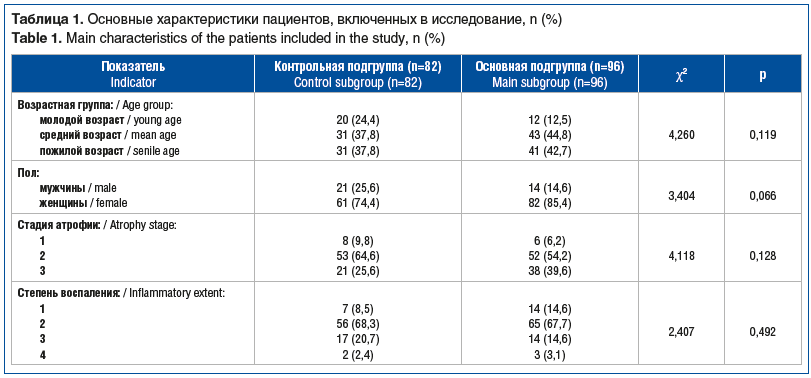
Пациенты основной и контрольной подгрупп были сопоставимы по полу, возрасту, стадиям атрофии и степени воспаления (табл. 1).
Через 12 мес. наблюдения у пациентов с АИГ в контрольной (р=0,006) и основной (р<0,001) подгруппах выявлено статистически значимое повышение уровня П-I (табл. 2). Установлена тенденция к снижению уровня П-II в обеих исследуемых подгруппах (в контрольной — р=0,974 и в основной — р=0,216), статистически значимых межгрупповых различий не выявлено (р=0,424). Определялся статистически значимый рост соотношения П-I/П-II c 1,38 [0,96; 2,62] до 2,00 [1,60; 3,10] (р<0,001) у лиц, принимавших ребамипид в течение 12 мес., межгрупповые различия были статистически значимыми (р<0,001). В подгруппе без терапии выявлено снижение П-I/П-II (р=0,002). Статистически значимых изменений по уровню гастрина-17 при АИГ не установлено.
![Таблица 2. Изменения неинвазивных показателей атрофии и воспаления при АИГ, Me [Q1; Q3] Table 2. Changes in noninvasive indicators of atrophy and inflammation in AAG, Me [Q1; Q3] Таблица 2. Изменения неинвазивных показателей атрофии и воспаления при АИГ, Me [Q1; Q3] Table 2. Changes in noninvasive indicators of atrophy and inflammation in AAG, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/08/1754926949_889_Effektivnost-rebamipida-pri-hronicheskom-atroficheskom-gastrite-rezultaty-issledovaniya-OPLOT.png)
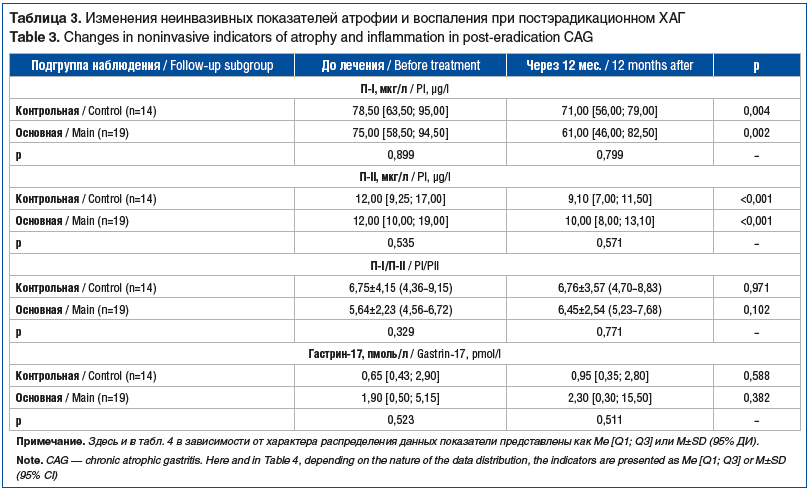
Через 12 мес. среди пациентов с постэрадикационным ХАГ в основной и контрольной подгруппах установлено статистически значимое снижение уровня П-I (с 75,00 [58,50; 94,50] до 61,00 [46,00; 82,50] мкг/л (p=0,002) и с 78,50 [63,50; 95,00] до 71,00 [56,00; 79,00] мкг/л (р=0,004) соответственно) и П-II (12,00 [10,00; 19,00] до 10,00 [8,00; 13,10] мкг/л (р<0,001) и с 12,00 [9,25; 17,00] до 9,10 [7,00; 11,50] мкг/л (р<0,001) соответственно) (табл. 3) без статистически значимых межгрупповых отличий. В подгруппе ребамипида отмечалась тенденция к увеличению соотношения П-I/П-II (p=0,102), при стабильном показателе в контрольной подгруппе (p=0,971), без статистически значимых межгрупповых отличий (р=0,771).
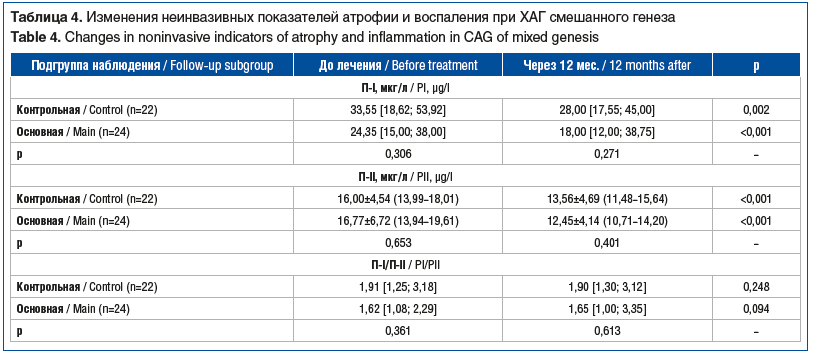
Среди лиц с ХАГ смешанного генеза выявлено статистически значимое снижение уровня П-I: с 24,35 [15,00; 38,00] до 18,00 [12,00; 38,75] мкг/л в основной подгруппе (р<0,001), с 33,55 [18,62; 53,92] до 28,00 [17,55; 45,00] мкг/л — в контрольной (р=0,002) и П-II (р<0,001 в обеих подгруппах), без статистически значимых межгрупповых различий (р=0,271) (табл. 4). Статистически значимых различий по соотношению П-I/П-II не обнаружено. Изменений уровня гастрина-17 в зависимости от проводимой терапии не наблюдалось.
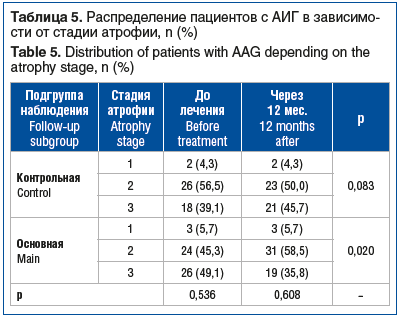
Анализ динамики атрофии в группе ХАГ аутоиммунной этиологии показал тенденцию к регрессу атрофии в подгруппе ребамипида (р=0,02), но межгрупповых различий выявлено не было (р=0,608) (табл. 5).
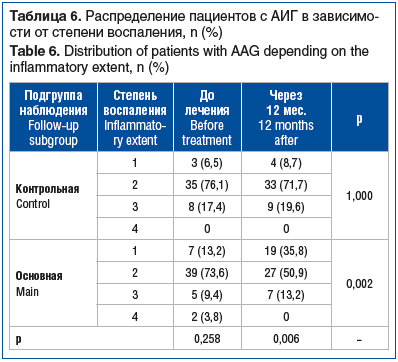
В подгруппе терапии ребамипидом констатировали снижение выраженности воспаления (р=0,002), различия между подгруппами были статистически значимы (р=0,006) (табл. 6).
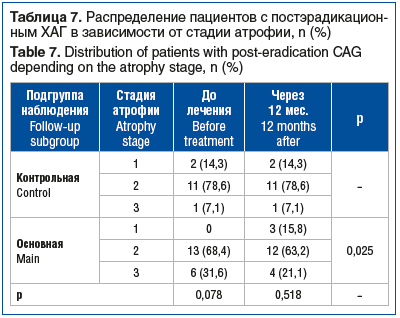
В группе постэрадикационного ХАГ при морфологическом исследовании снижение выраженности атрофии (р=0,025) было выявлено только в подгруппе ребамипида (табл. 7).
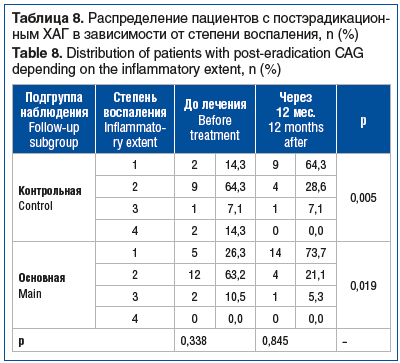
Согласно результатам гистологических заключений пациентов с постэрадикационным ХАГ через 12 мес. наблюдения в обеих подгруппах (основная и контрольная) установлено статистически значимое снижение степени воспаления (p=0,005 и р=0,019 соответственно); при этом статистически значимых различий между подгруппами не получено (табл. 8).
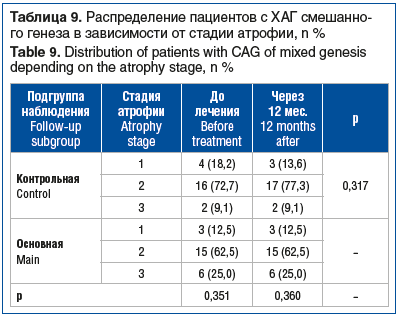
Динамики по стадиям атрофии в подгруппе ребамипида при ХАГ смешанного генеза выявлено не было (р=0,360) (табл. 9).
При этом выявлено статистически значимое снижение выраженности воспаления в обеих подгруппах (p=0,002 и р=0,005 соответственно) в отсутствие статистически значимых межгрупповых различий (табл. 10).

В ходе работы при оценке лабораторных данных лейкопении, гранулоцитопении, повышения содержания маркеров цитолиза выявлено не было. Из нежелательных явлений отмечались уртикарные высыпания в первый день приема препарата у одного пациента, который по данной причине в последующем вышел из исследования. Пациент выбыл через 1 день после включения, без возможности отследить динамику показателей и учесть ее при расчетах.
Обсуждение
Окончательные результаты исследования «ОПЛОТ» отчасти перекликаются с теми данными, которые были получены при анализе динамики серологических показателей на этапе 6 мес. наблюдения [8]. В отличие от первого этапа, при АИГ через 12 мес. выявлена не только положительная динамика соотношения пепсиногенов, но и П-I, в то время как тенденция к снижению уровня П-II как маркера воспаления отмечалась в обеих контрольных точках. Через 12 мес., помимо показателей функциональной серологии, было выявлено улучшение морфологических данных у пациентов с АИГ в подгруппе ребамипида. Подобный анализ среди пациентов с ХАГ данной этиологии ранее в литературе описан не был.
При постэрадикационном ХАГ как на этапе 6 мес., так и по окончании наблюдения выявлена положительная динамика серологических маркеров атрофии и воспаления, что совпадает с результатами работы, проведенной ранее [5]. В отличие от японских коллег [5] мы не выявили статистически значимых изменений по уровню гастрина-17. При морфологическом исследовании биоптатов подтверждалось снижение выраженности воспаления и атрофии у пациентов в обеих подгруппах, поэтому актуальным направлением для дальнейших исследований является определение уровня серологических маркеров атрофии и воспаления более чем через год после лечения H. pylori и сравнение скорости регресса воспаления в зависимости от наличия терапии ребамипидом. В отличие от исследований, проведенных ранее [5, 6], нами проводилась комплексная оценка морфологических изменений по системе OLGA. Более того, в работе, выполненной в Южной Корее [6], отсутствуют упоминания о признаках АИГ у пациентов без H. pylori, что усложняет сравнение; а также в работе коллег не оценивалась динамика серологических показателей атрофии и воспаления.
У пациентов с ХАГ смешанной этиологии была выявлена положительная динамика по выраженности воспаления вне зависимости от стратегии ведения пациента. Одним из факторов, который мог повлиять на конечный результат оценки, могла быть недавно проведенная эрадикационная терапия, которая могла повлиять на показатели в исследуемых подгруппах. Описаний данной группы пациентов в литературе нам не встретилось.
В настоящем исследовании, как и в работах зарубежных коллег [6, 7], продемонстрирован хороший профиль безопасности препарата, при этом установлена его эффективность в отношении улучшения как серологических, так и морфологических показателей у пациентов с ХАГ различной этиологии по данным 12-месячного наблюдения.
В целом важным отличием нашей работы от проведенных ранее является то, что участниками исследования стали пациенты с АИГ и ХАГ смешанного генеза. Важным преимуществом нашей работы является оценка динамики серологических маркеров атрофии и воспаления на 6-м и 12-м месяцах терапии, а также подтверждение морфологических изменений по итогам 12-месячного наблюдения.
Заключение
Использование ребамипида на протяжении 12 мес. способствует улучшению показателей серологических маркеров атрофии и уменьшению выраженности воспалительного процесса у пациентов с АИГ. У пациентов с постэрадикационным ХАГ наблюдаются признаки уменьшения воспаления и регресса атрофии, что подтверждается как серологическими, так и морфологическими данными, при этом значимых различий между подгруппами не выявлено. У пациентов с ХАГ смешанного генеза, независимо от применения ребамипида, отмечается снижение воспаления по серологическим и гистологическим данным, однако признаки регресса атрофии отсутствуют.
Прием ребамипида в течение 12 мес. показал безопасность, сходную с таковой при приеме в течение короткого курса.
СВЕДЕНИЯ ОБ АВТОРАХ:
Бакулин Игорь Геннадьевич — д.м.н., профессор, заведующий кафедрой пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-6151-2021
Сушилова Анастасия Геннадьевна — аспирант кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-7277-5046
Жарков Александр Вячеславович — к.м.н., ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; председатель комитета по здравоохранению Ленинградской области; 191124, Россия, г. Санкт-Петербург, ул. Лафонская, д. 6, лит. А;ORCID iD 0000-0001-9600-6649-0928
Контактная информация: Бакулин Игорь Геннадьевич, e-mail: igbakulin@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 06.05.2025.
Поступила после рецензирования 02.06.2025.
Принята в печать 27.06.2025.
ABOUT THE AUTHORS:
Igor G. Bakulin — Dr. Sc. (Med.), Professor, Head of the Department of Propaedeutics of Internal Medicine, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41,
Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-6151-2021
Anastasia G. Sushilova — postgraduate student at the Department of Propaedeutics of Internal Medicine, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-7277-5046
Alexander V. Zharkov — C. Sc. (Med.), Assistant Professor of the Department of Propaedeutics of Internal Medicine, Gastroenterology and Nutrition named after S.M. Ryss, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Chairman of the Leningrad Region Health Committee; 6 letter A, Lafonskaya str., St. Petersburg, 191124, Russian Federation; ORCID iD 0000-0001-9600-6649-0928
Contact information: Igor G. Bakulin, e-mail: igbakulin@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 06.05.2025.
Revised 02.06.2025.
Accepted 27.06.2025.
Информация с rmj.ru






