Особенности течения, лечения и прогноза острого коронарного синдрома без подъема сегмента ST у пациентов с железодефицитной анемией
А. Л. Вёрткин, доктор медицинских наук, профессор
А. С. Скотников, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
По современным представлениям, основой лечения острого коронарного синдрома без подъема сегмента ST на ЭКГ (ОКСБПST) является воздействие на внутрисосудистое тромбообразование с помощью антитромботических лекарственных средств (рекомендации Всероссийского научного общества кардиологов, ВНОК, 2007; American College of Cardiology & American Heart Association, ACC/AHA, 2007). Комбинированное применение антиагрегантов и антикоагулянтов стало повседневной практикой при данной патологии. В то же время у ряда пациентов с ОКСБПST, в том числе у пожилых, у женщин, при наличии хронической почечной недостаточности, повышен риск развития геморрагических осложнений (рекомендации Европейского общества кардиологов, European Society of Cardiology, ESC, 2007). Кроме того, к указанным факторам риска, по данным шкалы CRUSADE, относят также тахикардию, систолическое артериальное давление ниже 110 мм рт. ст. и диастолическое — выше 80 мм рт. ст., застойную сердечную недостаточность, сахарный диабет 2-го типа, указания на предшествующие заболевания сосудов, а также низкие показатели гематокрита и клиренса эндогенного креатинина [1].
При возникновении стресса, в том числе и при остром коронарном синдроме (ОКС), в роли пускового фактора развития кровотечения, как правило, выступает внезапное ухудшение или прогрессирующее падение систолической функции сердца [2]. Возникающая при этом ишемия слизистой оболочки гастродуоденальной области, снижая ее факторы защиты, вызывает относительную гиперацидность желудка [3], на фоне которой развиваются острые эрозивно-язвенные повреждения (ЭЯП) слизистой оболочки верхних отделов желудочно-кишечного тракта (ЖКТ) с последующим желудочно-кишечным кровотечением [4, 5]. Согласно данным ряда крупных исследований (GUSTO, 1997; ASSENT-3, 2004; CAPRIE, 1996; OASIS-5, 2005), желудочно-кишечные кровотечения (ЖКК) и развивающаяся при этом железодефицитная постгеморрагическая анемия в 5 раз повышают летальность у пациентов с ОКСБПST в течение первых 30 дней и в 1,5 раза — в последующие 5 месяцев [6].
Согласно исследованиям N. Meneveau и F. Schiele (2008), железодефицитная анемия встречается у 27% пациентов с ОКСБПST, развивается в исходе ЖКК на фоне выраженной сопутствующей патологии и обуславливает 4-кратное увеличение летальности указанной категории больных [7]. По данным О. В. Зайратьянца (2008) и А. Л. Верткина (2010), эти кровотечения выявляются при аутопсии у 21% умерших от различных форм ишемической болезни сердца, в том числе у 10% больных с первичным и у 54% — с повторным инфарктом миокарда. Вопрос о необходимости назначения и выбора антикоагулянтов в этой ситуации до сих пор остается предметом литературных дискуссий [8].
Так, в исследовании FRAX.I.S. (1999) и в наблюдениях S. Anand и K. Malmberg (2000) [9], а также K. P. Alexander (2005) [10] отмечено увеличение частоты ЖКК на фоне антикоагулянтной терапии.
По мнению других авторов, ЖКК или высокий риск их возникновения в половине случаев обуславливают назначение неадекватных доз антикоагулянтов [11]. В то же время S. Husted и L. Wallentin (2002) считают, что в этих условиях можно назначать более низкие дозы низкомолекулярного гепарина (НМГ), что позволяет предотвращать рецидивы заболевания в ближайшие 1–1,5 месяца и не вызывает ЖКК [12]. Таким образом, проблема назначения антикоагулянтов больным ОКСБПST на фоне железодефицитной анемии и высокого риска ЖКК остается актуальной.
Окончательно не решен вопрос о соотношении пользы и риска этой терапии, о предпочтении при выборе групп, режимов дозирования и сроков применения антитромботической терапии. Основной целью данного исследования было определить тактику ведения больных ОКСБПST с железодефицитной анемией и высоким риском развития желудочно-кишечного кровотечения. Авторы ставили перед собой задачу изучить частоту встречаемости железодефицитной анемии и структуру осложнений у пациентов с ОКСБПST. Кроме того, планировалось оценить зависимость развития геморрагических осложнений от проводимой в стационаре антитромботической терапии у больных ОКСБПST и выявить эффективность и безопасность НМГ у пациентов с ОКСБПST с железодефицитной анемией и высоким риском развития ЖКК.
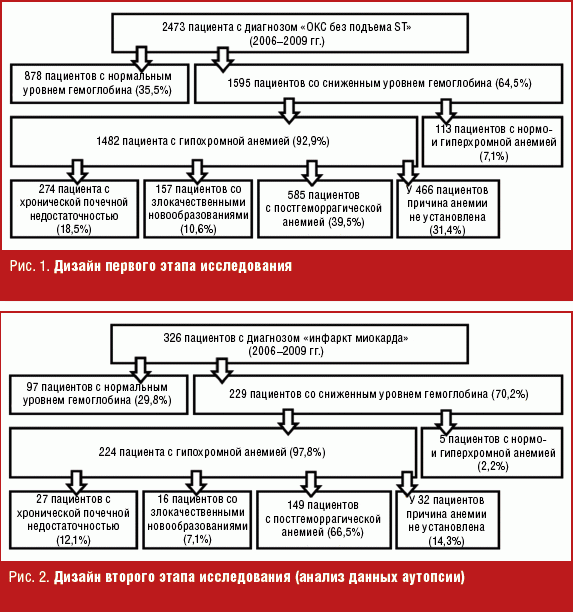
Исследование включало 3 этапа. На первом был ретроспективно проведен анализ 2473 историй болезни пациентов с ОКСБПST, поступивших в отделение кардиореанимации многопрофильного стационара города Москвы в 2006–2009 гг. Среди 2473 пациентов было 1352 (54,7%) мужчины и 1121 (45,3%) женщина. Средний возраст больных составил 69,3 ± 12,1 года.
Проведенный скрининг показал, что у 1595 (64,5%) пациентов с ОКСБПST уровень гемоглобина (Hb) и количество эритроцитов были снижены. При этом у 1482 больных (92,9%) цветовой показатель был меньше единицы, что свидетельствовало о гипохромной анемии, у 98 пациентов (6,2%) анемия была гиперхромная, а у 15 больных (0,9%) — нормохромная (рис. 1).
На втором этапе исследования проводили изучение протоколов патологоанатомических вскрытий и историй болезней 326 пациентов с острым инфарктом миокарда, умерших в отделениях кардиореанимации и неотложной кардиологии многопрофильного стационара города Москвы в 2006–2009 гг. (рис. 2). Среди этих 326 пациентов было 107 (32,8%) мужчин и 219 (67,2%) женщин. Средний возраст больных составил 73,3 ± 9,4 года.
Третий этап исследования включал в себя проспективное исследование эффективности и безопасности лечения ОКСБПST с железодефицитной анемией и высоким риском ЖКК дальтепарином натрия и препаратами железа. Критериями включения являлись одновременное наличие у пациента ОКСБПST, железодефицитной анемии, высокого риска развития ЖКК (CRUSADE) и неблагоприятных событий в ближайшее время (по системе TIMI (Trombolysis in Myocardial Infarction)). В качестве группы контроля выступали пациенты, не получавшие антикоагулянты (рис. 3).

В исследование не включали пациентов с наличием или появлением на ЭКГ признаков трансмуральной ишемии и некроза миокарда (подъема сегмента ST, патологического зубца Q, комплекса QS, впервые возникшей блокады левой ножки пучка Гиса), активным и/или перенесенным менее 10 дней назад клинически значимым кровотечением любой локализации, развитием нового кровотечения, выраженными нарушениями свертываемости крови, острой почечной недостаточностью, программным гемодиализом, анамнестическими указаниями на наличие иммунной гепарининдуцированной тромбоцитопении, признаками хронической недостаточности кровообращения III-IV функционального класса по классификации Нью-Йоркской Ассоциации кардиологов (New York Heart Association, NYHA), острым цереброваскулярным заболеванием менее 6 месяцев назад, наличием в анамнезе аллергических реакций на дальтепарин натрия или с гиперчувствительностью к нему и другим гепаринам.
ОКСБПST диагностировали согласно рекомендациям ВНОК (2007–2009) и ACC/AHA (2007). Хроническую железодефицитную анемию диагностировали на основании жалоб, данных анамнеза (выявление хронической кровопотери), а также данных лабораторных показателей крови (снижение уровня Hb, эритроцитов, цветового показателя, гематокрита, сывороточного железа, ферритина, а также повышение уровня трансферрина, общей (ОЖСС) и латентной железосвязывающей способности сыворотки (ЛЖСС)) [13, 14].
Из 247 пациентов с ОКСБПST 92 человека (88,5%) полностью соответствовали всем необходимым критериям и были включены в дальнейшее исследование. Этим больным было проведено общеклиническое и лабораторное обследование. Суммарное число баллов по системе TIMI (2000) более четырех расценивали как высокий риск развития неблагоприятных событий (смерть, инфаркт миокарда, инсульт), при котором, согласно рекомендациям ВНОК и Европейского общества кардиологов (European Society of Cardiology, ESC), всем пациентам показано назначение комплексной фармакотерапии, в том числе НМГ.
Уровень тропонина T определяли при поступлении и через 12 часов после развития ангинозного приступа. Качественное определение тропонина T в плазме крови пациента проводилось посредством полосок экспресс-диагностики инфаркта миокарда Teco Diagnostics (США) с помощью иммунохроматографического метода с использованием антител к тропонину Т.
Все лабораторные методики, с помощью которых оценивали показатели обмена железа и функции печени и почек, были выполнены на аппарате для исследования сыворотки крови компании «Биофизическая аппаратура» (Россия).
Из 92 больных высокий риск неблагоприятных событий обнаружили у 83 пациентов (90,2%), которые затем методом «случай-контроль» были разделены на две сопоставимые по полу, возрасту и сопутствующей патологии группы (А и В) и продолжили исследование.
Для исключения активного кровотечения на момент начала исследования лекарственного препарата все больные с выявленной железодефицитной анемией и высоким риском развития ЖКК были осмотрены хирургом.
Пациентам группы А (n = 37) с момента рандомизации, в дополнение к рекомендуемой ВНОК и ESC неотложной терапии ОКСБПST, назначали НМГ — дальтепарин натрия [15, 16]. Разработана особая методика данной антитромботической терапии, основанная на рекомендациях компании-изготовителя. В связи с высоким риском развития ЖКК первую дозу дальтепарина натрия вводили внутривенно болюсно в дозе 5 МЕ/кг с последующим внутривенным введением 60 МЕ/кг каждые 12 часов. Таким образом, пациенты основной группы получили пятидневный курс терапии дальтепарином натрия, суточная доза которого на одного больного массой 80 кг в среднем составила 9600 МЕ, что в 2 раза меньше дозы, одобренной для пациентов с ОКСБПST. При первом назначении лекарственного препарата учитывали показатели коагулограммы, а также проводимую на догоспитальном этапе антитромботическую терапию.
Пациентам группы В (контроль) (n = 46) терапию ОКСБПST проводили в полном объеме, но без антикоагулянтов.
Пациентам обеих групп, согласно рекомендациям ВНОК и ESC, продолжали проводить терапию ОКСБПST в полном объеме в условиях отделения кардиореанимации с дальнейшей реабилитацией в кардиологических отделениях стационара.
Статистическую обработку результатов осуществляли в программах Microsoft Excel и Statistica (Version 6.0). Использовали следующие статистические методики: вычисление среднего значения, вычисление стандартного отклонения, расчет достоверности и критерия Стьюдента, построение диаграмм и гистограмм. Различия между группами считали достоверно значимыми при p < 0,05.
Полученные результаты
На первом этапе исследования в результате скрининга уровня гемоглобина (Hb) у 1482 (92,9%) больных ОКСБПST была выявлена гипохромная анемия, в том числе легкая (90 г/л < Hb < 120 г/л) — у 758 (51,1%) человек, средней тяжести (70 г/л < Hb < 90 г/л) — у 537 (36,2%) пациентов и тяжелая (Hb < 70 г/л) — у 187 (12,7%) больных.
Все 1482 пациента были отнесены к четырем категориям: у 274 (18,5%) причиной гипохромной анемии была хроническая почечная недостаточность, вследствие артериолонефросклероза на фоне гипертонической болезни, у 157 (10,6%) — злокачественные новообразования различных локализаций, у 585 (39,5%) — имелись анамнестические указания на различные кровотечения, в том числе у 446 (30,1%) — ЖКК из ЭЯП слизистой оболочки верхних отделов ЖКТ. У 466 пациентов (31,4%) — установить генез гипохромной анемии не удалось.
Из 1482 больных с гипохромной анемией исследование уровня сывороточного железа врачи провели в 869 случаях (58,6%). Другие показатели обмена железа (Fe) (ферритин, трансферрин, общая и латентная железосвязывающая способность сыворотки крови) были исследованы лишь в 139 случаях (9,4%). В связи с низкой частотой проведения исследований обмена железа, анамнестические указания на кровопотерю, наличие злокачественных новообразований и поражения почек, а также выявленная гипохромия расценивались автором как проявление дефицита железа. Таким образом, количество пациентов с ОКСБПST и железодефицитной анемией составило 59,9% от общего числа больных ОКСБПST. Из 1482 больных ОКСБПST и железодефицитной анемией препараты железа (табл. 1) в стационаре получали только 717 больных (48,4%), а в первый день заболевания в отделении кардиореанимации — 348 человек (23,5%).
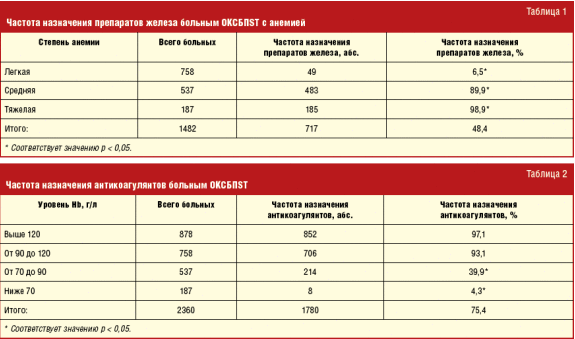
Как видно из табл. 1, больным ОКС и железодефицитной анемией коррекцию дефицита железа проводят только при значительном снижении уровня Hb (в 89,9% случаев — при анемии средней тяжести и в 98,9% случаев — при тяжелой анемии). Частота назначения препаратов железа пациентам с легкой гипохромной анемией достоверно ниже (6,5%) (p < 0,05). Из 1482 пациентов с ОКСБПST и железодефицитной анемией антикоагулянты в стационаре были назначены 928 больным (62,6%), в то время как 878 больным ОКСБПST без анемии — в 852 случаях (97,1%) (табл. 2).
Как следует из табл. 2, частота назначения антикоагулянтов пациентам с ОКСБПST и больным ОКСБПST с легкой гипохромной анемией составляет 97,1% и 93,1%, что достоверно выше, чем пациентам с анемией средней тяжести и тяжелой железодефицитной анемией (39,9% и 4,3% соответственно) (p < 0,05).
Спектр назначения больным ОКСБПST и железодефицитной анемией антикоагулянтов и препаратов железа представлен в табл. 3.
Как видно из табл. 3, наибольшее предпочтение в выборе антитромботического препарата клиницисты отдают нефракционированному гепарину (НФГ) (88,2%), в то время как НМГ используют лишь в 9,1% случаев (p < 0,05). Коррекцию дефицита железа в 92,3% случаев проводят препаратами соли двухвалентного железа (p < 0,05). Из 1482 больных ацетилсалициловая кислота была назначена 812 пациентам (69,2%), клопидогрел — 230 (19,6%), а их сочетание — 131 (11,2%) больному. Таким образом, в группе пациентов с ОКСБПST и снижением уровня Hb, ассоциированным с плохим прогнозом и большой вероятностью развития неблагоприятных событий в ближайшее время, треть пациентов не получает антикоагулянты, а каждый пятый — антиагреганты. В завершение первой части исследования была сопоставлена тяжесть клинического течения ОКСБПST с уровнем гемоглобина и частотой развития инфаркта миокарда (табл. 4).
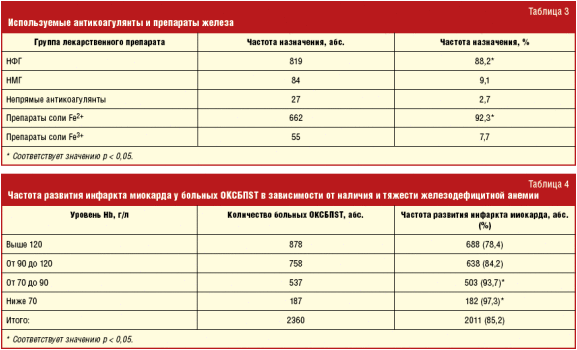
Общая частота развития инфаркта миокарда в группе пациентов с ОКСБПST и железодефицитной анемией составила 89,3%, а в группе пациентов с ОКСБПST и нормальным уровнем Hb — 78,4%. Как следует из табл. 4, у пациентов с железодефицитной анемией средней и тяжелой степеней риск развития инфаркта миокарда достоверно выше, чем у больных с легким снижением уровня Hb или его нормальным уровнем (93,7% и 97,3% против 84,2% и 78,4% соответственно) (p < 0,05). Таким образом, риск развития инфаркта миокарда у больных ОКСБПST прямо пропорционален степени снижения уровня Hb.
Во второй этап исследования вошли 326 больных, поступивших в отделение неотложной кардиологии с направительным диагнозом «ОКС без подъема сегмента ST» и умерших в отделении в связи с развившимся инфарктом миокарда. У всех на секции диагноз инфаркта миокарда был подтвержден. При анализе историй болезни из 326 умерших пациентов у 229 человек (70,2%) при жизни было выявлено снижение концентрации гемоглобина, из них у 224 больных (97,8%) — гипохромная анемия. Анемия легкой степени была выявлена у 47 человек (20,9%), средней степени — у 71 пациента (31,7%), а тяжелой степени — у 106 больных (47,4%). При патологоанатомическом исследовании у всех 224 больных были выявлены косвенные признаки малокровия, однако точную причину возникновения железодефицитной анемии морфологам удалось выявить в 192 случаях (85,7%). У 27 (12,1%) из 224 больных при аутопсии был выявлен нефроангиосклероз, у 16 (7,1%) — злокачественные новообразования (рак желудка — у 2, кишечника — у 2, матки и придатков — у 4, предстательной железы — у 3, мочевого пузыря — у 3, легкого — у 1, молочной железы — у 1). В 32 случаях (14,3%) субстрат для развития железодефицитной анемии на секции обнаружен не был.
Из 224 пациентов с железодефицитной анемией у 149 (66,5%) были выявлены признаки состоявшегося острого кровотечения — у 94 (63,1%) и причин для хронической скрытой кровопотери — у 55 больных (36,9%). Среди причин состоявшегося ЖКК у 73 из 94 больных (77,6%) источником служили ЭЯП слизистой оболочки верхних отделов ЖКТ, у 16 (17,1%) — хроническая язва желудка или 12-перстной кишки, у 5 (5,3%) — эрозивное поражение слизистой оболочки мочевого пузыря с развитием гематурии. В пользу скрытой хронической кровопотери с развитием железодефицитной анемии свидетельствовало обнаружение ЭЯП слизистой оболочки верхних отделов желудочно-кишечного тракта или других локализаций без признаков состоявшегося кровотечения (n = 55). Частота развития осложнений у больных ОКСБПST различалась в зависимости от наличия и степени тяжести железодефицитной анемии (табл. 5).
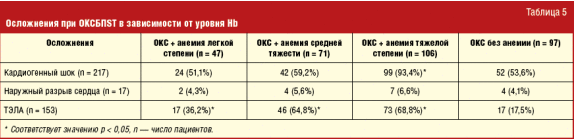
Как видно из табл. 5, у пациентов с ОКСБПST и тяжелой железодефицитной анемией частота развития кардиогенного шока достоверно выше, чем у больных с анемией средней и легкой степеней, а также при нормальном уровне Hb (93,4% против 59,2%, 51,1% и 53,6% соответственно) (p < 0,05). Тромбоэмболия легочной артерии (ТЭЛА) и ее ветвей у больных ОКСБПST с железодефицитной анемией развиваются чаще, чем у пациентов с нормальным уровнем гемоглобина (36,2%, 64,8% и 68,8% против 17,5% соответственно) (p < 0,05) и не зависят от тяжести железодефицитной анемии (p > 0,05).
У умерших 326 пациентов в зависимости от тяжести железодефицитной анемии различалась и частота назначения врачами антикоагулянтов. Так, в группе пациентов с железодефицитной анемией (n = 224) антитромботические препараты были назначены в 101 случае (45,1%), а в группе пациентов с нормальным уровнем гемоглобина (n = 97) — в 93 случаях (95,2%). Частота развития осложнений различалась в зависимости от наличия антитромботических препаратов в составе комплексной фармакотерапии. У пациентов с ОКСБПST и железодефицитной анемией, которым антитромботическую терапию в стационаре не проводят, частота развития кардиогенного шока составляет 83,7% против 61,4% в группе больных, получающих антикоагулянты (p < 0,05). ТЭЛА у больных ОКСБПST с железодефицитной анемией при отсутствии атитромботической терапии развивается на 50,2% чаще, чем при назначении антикоагулянтов (p < 0,05). В то же время у больных железодефицитной анемией, которым по поводу ОКСБПST проводят антитромботическую терапию, частота развития геморрагических осложнений на 12,4% выше, чем у больных ОКСБПST, которым терапию антикоагулянтами в стационаре не проводят (p < 0,05). Однако предотвращение тромботических осложнений ОКС превосходит риск развития кровотечения. Таким образом, у больных ОКСБПST и тяжелой железодефицитной анемией высока опасность тромботических и геморрагических осложнений, что подтверждает наличие трудностей в тактике их лечения.
Заключительный этап исследования предусматривал изучение эффективности и безопасности применения дальтепарина натрия у 83 пациентов с ОКСБПST, железодефицитной анемией, высоким риском развития кровотечения и высоким риском развития неблагоприятных событий (смерть, инфаркт миокарда). Коррекцию дефицита железа, независимо от степени снижения Hb и тяжести железодефицитной анемии, в составе комплексной фармакотерапии ОКСБПST проводили в 100% случаев. Были получены положительные результаты в отношении конечных точек, которыми являлись развитие кровотечения, инфаркт миокарда и смерть от любых причин. В группе А было зарегистрировано 2 случая развития инфаркта миокарда с патологическим зубцом Q, что повлекло за собой отмену у этих больных дальтепарина натрия.
Остальные 35 больных своевременно закончили прием дальтепарина натрия на пятый день стационарного лечения. В группе В инфаркт миокарда с патологическим зубцом Q сформировался у 9 больных. Инфаркт миокарда без патологического зубца Q в группе А развился в 19 случаях, в то время как в группе В ОКСБПST привел к развитию инфаркта миокарда без патологического зубца Q у 32 пациентов. У больных ОКСБПST и железодефицитной анемией, получавших терапию НМГ, частота развития инфаркта миокарда с патологическим зубцом Q была на 14,2% меньше (p < 0,05), а частота развития инфаркта миокарда без патологического зубца Q — на 18,2% меньше (p < 0,05), чем в группе больных, которым терапию НМГ не проводили. Ни одного случая кровотечения на фоне терапии дальтепарином натрия зарегистрировано не было. Анти-Ха активность плазмы находилась в пределах 0,2–0,4 МЕ/мл. В последующие за отменой препарата 10 дней у 4 больных группы А были отмечены носовые кровотечения (частота 10,8%), которые по шкале GUSTO соответствовали легкой степени, не вызывали нарушений гемодинамики, прошли самостоятельно и не требовали проведения гемотрансфузии.
В группе В было зарегистрировано два случая носовых кровотечений (частота 4,3%) легкой степени по шкале GUSTO (p > 0,05). За время, проведенное в отделении кардиореанимации, смертей в группе А зафиксировано не было, между тем в группе В умерло три пациента. В последующие 10 дней стационарного лечения в группе А умерло два человека, а в контрольной группе В — трое больных. Таким образом, общая летальность в группе А составила 8,1%, а в группе В — 13,1% (p < 0,05). На фоне коррекции железодефицитной анемии препаратом двухвалентного железа в обеих группах увеличилась концентрация гемоглобина (p < 0,05), сывороточного железа (p < 0,05), ферритина (p < 0,05), а также уменьшился уровень трансферрина (p < 0,05) и ЛЖСС (p < 0,05).
Таким образом, пациентам с ОКСБПST, высоким риском ЖКК и железодефицитной анемией показана антитромботическая терапия дальтепарином натрия на фоне одновременной коррекции дефицита железа. Данная терапия снижает смертность и частоту развития инфаркта миокарда у этих больных, не увеличивая частоту геморрагических осложнений, а полученные результаты позволяют широко использовать дальтепарин натрия в терапии этой категории больных.
Литература
- Subherwal S., Bach R. G., Chen A. Y., Gage B. F., Rao S. V., Newby L. K., Wang T. Y., Gibler W. B., Ohman E. M., Roe M. T., Pollack C. V. Jr., Peterson E. D., Alexander K. P. Baseline risk of major bleeding in non-ST-segment-elevation myocardial infarction: the CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA Guidelines) Bleeding Score // Circulation. 2009, Apr 14; 119 (14): 1873–1882.
- Oler A., Whooley M. A., Oler J., Grady D. Adding heparin to aspirin reduces the incidence of myocardial infarction and death in patients with unstable angina. A meta-analysis // JAMA. 1996, № 276, с. 811–815.
- Van der Hulst R. W., Zandstra D. F., Geraedts A. A., van der Ende A., Tytgat G. N. Prevalence of Helicobacter pylori infection in stress-induced gastric mucosal injury // Intensive Care Med. 2001, Jan; 27 (1): 68–73.
- Yang X., Alexander K. P., Chen A. Y. CRUSADE Investigators. The implications of blood transfusions for patients with non-ST-segment elevation acute coronary syndromes: results from the CRUSADE National Quality Improvement Initiative // J Am Coll Cardiol. 2005; 46: 1490–1495.
- Ix J. H., de Boer I. H., Wassel C. L., Criqui M. H., Shlipak M. G., Whooley M. A. Urinary creatinine excretion rate and mortality in persons with coronary artery disease: the Heart and Soul Study // Circulation. 2010, Mar 23; 121 (11): 1295–1303.
- Eikelboom J. W., Mehta S. R., Anand S. S., Xie C., Fox K. A., Yusuf S. Adverse impact of bleeding on prognosis in patients with acute coronary syndromes // Circulation. 2006; 114: 774–782.
- Meneveau N., Schiele F., Seronde M. F., Descotes-Genon V., Oettinger J., Chopard R., Ecarnot F., Bassand J. P. Anemia for risk assessment of patients with acute coronary syndromes // Am J Cardiol. 2009, Feb 15; 103 (4): 442–447.
- Верткин А. Л., Зайратьянц О. В., Вовк Е. И. Поражения желудка и двенадцатиперстной кишки у больных с острым коронарным синдромом // Лечащий Врач. 2006, №.1, с. 66–70.
- Alexander K. P., Peterson E. D. Minimizing the risks of anticoagulants and platelet inhibitors // Circulation. 2010, May 4; 121 (17): 1960–1970.
- Anand I., McMurray J. J., Whitmore J. Anemia and its relationship to clinical outcome in heart failure // Circulation. 2004; 110: 149–154.
- Nancy M., LaPointe A., Pharm D., Anita Y., Chen M. S. Enoxaparin Dosing and Associated Risk of In-Hospital Bleeding and Death in Patients With Non-ST-Segment Elevation Acute Coronary Syndromes // Arch Intern Med. 2007; 167: 14: 1539–1544.
- Husted S. Evidence-based prescribing and adherence to antiplatelet therapy-how much difference do they make to patients with atherothrombosis? // Int J Cardiol. 2009, May 15; 134 (2): 150–159.
- Воробьев А. И. Руководство по гематологии в 2-х т. М.: Медицина, 1985.
- Дворецкий Л. И. Рациональная фармакотерапия. Справочник терапевта. М.: Литерра, 2010.
- Fragmin during Instability in Coronary Artery Disease (FRISC) study group. Low-molecular-weight heparin during instability in coronary artery disease // Lancet. 1996, Mar 2; 347 (9001): 561–568.
- Lagerqvist B., Kontny F. 5-year outcomes in the FRISC-II randomised trial of an invasive versus a non-invasive strategy in non-ST-elevation acute coronary syndrome: a follow-up study // Lancet. 2006; Sep. 16, 368: 998-10-04.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







