Введение
Новая коронавирусная инфекция (COVID-19) — инфекционное заболевание, вызываемое SARS-CoV-2, которое влияет на течение (патоморфоз) неинфекционных заболеваний [1]. Во время пандемии COVID-19 были ограничены возможности предоставления медицинской помощи пациентам со многими хроническими неинфекционными заболеваниями. Пациенты с редкими заболеваниями соединительной ткани (синдром Элерса — Данло, синдром Марфана), а также с чаще встречающимся синдромом гипермобильности суставов наиболее чувствительны к неблагоприятным внешним воздействиям, что необходимо учитывать при планировании мероприятий в сфере здравоохранения в случае возможных чрезвычайных ситуаций [2].
Одним из основных механизмов повреждения органов и тканей при COVID-19 принято считать «цитокиновый шторм». Провоспалительные цитокины оказывают повреждающее действие, прежде всего, на сосуды, вызывая эндотелиальную дисфункцию, с максимальным повреждением в той части организма, где соединительная ткань дефектна (в так называемом locus minoris). При наследственных нарушениях соединительной ткани (синдроме Элерса — Данло, синдроме Марфана, гипермобильном синдроме) особая «ранимость» соединительной ткани проявляется множественными болевыми синдромами, сердечно-сосудистыми, дыхательными, суставными, гастроэнтерологическими, вегетативными расстройствами и психосоматическими проблемами [3]. Можно предположить, что у этих категорий пациентов последствия перенесенного COVID-19 будут более значимыми, чем в общей популяции [4, 5].
Цель исследования: сравнительный анализ клинических проявлений и особенностей течения гипермобильного синдрома у пациентов, перенесших COVID-19, и пациентов, не болевших COVID-19, и потребностей в медикаментозных вмешательствах.
Материал и методы
В поликлинику БУЗОО «ГКБ №1 им. Кабанова А.Н.» в течение 2021 г. обратилось 256 пациентов в возрасте от 18 до 55 лет с болевыми суставно-мышечными проявлениями. Из них были отобраны пациенты (n=102), у которых при проведении лабораторно-инструментальных исследований на предыдущем этапе не было выявлено признаков ревматических заболеваний, сопровождающихся суставным синдромом, и повышения острофазовых показателей крови (СОЭ, уровень С-реактивного белка). Отобранным пациентам были проведены тесты на гипермобильность суставов [6].
Критерии включения: 1) гипермобильность суставов от 4 до 9 баллов по критериям Бейтона [6]; 2) суставно-мышечный болевой синдром, включая артралгии и дорсалгии, без указания на их травматический генез; 3) отсутствие воспалительных и острофазовых изменений в показателях крови, зафиксированных в амбулаторной карте; 4) возраст пациентов от 18 до 55 лет включительно; 5) подписание добровольного информированного согласия пациента на участие в исследовании.
Критерии невключения: 1) ревматические заболевания, сопровождающиеся суставным синдромом; 2) травмы; 3) отказ пациента от участия в исследовании.
Было выявлено 58 человек с гипермобильностью суставов, что составило 21,5% от всех пациентов с суставными и мышечными болями. Среди них у 4 пациентов был диагностирован синдром Элерса — Данло (согласно Вильфраншским критериям), у 1 пациента — синдром Марфана (согласно Гентским критериям пересмотра 1996 г.).
Из 58 включенных в исследование пациентов 37 человек в течение 6 мес. после выявления гипермобильности суставов перенесли COVID-19, подтвержденный методом ПЦР. Было сформировано 2 группы пациентов с гипермобильным синдромом: 1-я — перенесшие COVID-19 (n=37), 2-я — без указаний в анамнезе на заболевание COVID-19 (n=21). Три человека с синдромом Элерса — Данло и 1 пациент с синдромом Марфана включены в 1-ю группу, 1 пациент с синдромом Элерса — Данло — во 2-ю группу.
Исследовались особенности течения суставного синдрома, другие клинические проявления, важность которых отмечали сами пациенты. Каждой группе были предложены оптимальные методы немедикаментозной и медикаментозной коррекции. Немедикаментозные методы включали: рациональную психотерапию; обучение корректной модели движений; упражнениям, выполняемым в домашних условиях для укрепления мышц, окружающих проблемные суставы и отделы позвоночник e0; тренировки равновесия и применение эластичных ортезов с целью улучшения проприоцепции. Обучение пациента проводилось по следующим правилам: 1) выбор удобного режима занятий с учетом занятости пациента, наличия командировок, дежурств (использовались упражнения, не требующие спортивных снарядов); 2) отсутствие боли при выполнении упражнений; 3) хорошее самочувствие на протяжении занятия.
Интенсивность мышечно-суставной боли измерялась по визуально-аналоговой шкале (ВАШ), представленной в виде отрезка с 10 делениями по 1 см. Слабая боль соответствовала отрезку до 3 см, боль средней интенсивности — от 3 до 6 см, сильная боль — от 7 до 9 см, очень сильная боль — 10 см. Всем пациентам, перенесшим COVID-19, при интенсивном болевом синдроме назначались НПВП в стандартной терапевтической дозе перорально в течение 7–10 дней (по 2–3 курса), а также местно в виде геля на область суставов. В группе пациентов, не болевших COVID-19, НПВП были назначены только при выраженном болевом синдроме 4 пациентам (1 курс).
Экспериментально-психологическое обследование проводилось для выявления ассоциированной с синдромом гипермобильности суставов тревожности и исключения депрессии с использованием Госпитальной шкалы тревоги и депрессии (HADS). Определение уровня ситуативной и личностной тревожности проводилось по тесту Спилбергера — Ханина. При интерпретации показателей использовались следующие оценки: до 30 баллов — низкая тревожность, от 31 до 44 баллов — умеренная тревожность, 45 и более баллов — высокая тревожность.
Изучение качества жизни проводилось с использованием русской версии опросника SF-36 v.2тм, валидированной Межнациональным центром исследования качества жизни г. Санкт-Петербурга. Каждая характеристика качества жизни оценивалась в диапазоне от 0 до 100 баллов.
Важной составляющей частью лечения было применение тофизопама и сульбутиамина у большей части пациентов, перенесших COVID-19.
Эффективность лечения оценивалась через 10 дней, 1 мес. и 2 мес.
В процессе статистической обработки данных использованы методы описательной статистики, графического анализа. Так как большая часть результатов имела распределение, отличное от нормального, то расчеты проводились с использованием непараметрических м етодов, а полученные данные представлены в виде медианы, верхнего и нижнего квартилей (Q1, Q3). Для сравнения двух независимых групп использован критерий Вальда — Вольфовица (Z), для сравнения двух связанных групп — критерий Вилкоксона (z), для сравнения средних более чем в двух зависимых группах — критерий Фридмана. Результаты сравнения считались значимыми при p<0,05.
Результаты и обсуждение
Артралгии и дорсалгии отмечали все пациенты из 1-й и 2-й групп, однако выраженность болей по ВАШ была значимо выше в 1-й группе (табл. 1). Преимущественную локализацию болей в шейном, грудном отделах позвоночника, коленных, голеностопных, лучезапястных, плечевых суставах можно объяснить тем, что указанные суставы и отделы позвоночника испытывают наибольшую нагрузку при повседневной работе. Пациенты 1-й группы описывали эти боли как прокалывающие, жгучие, как ощущение иголок под кожей, удар током, прострел. Подобные описания характерны для нейропатических болей, однако заболеваний, при которых возможно появление таких болей (сахарный диабет, алкоголизм и др.), у пациентов не было. Учитывая данные литературы об особенностях течения COVID-19, можно предположить, что системная эндотелиальная дисфункция, сопровождающаяся образованием микротромбов, приводит к нарушению трофики нервных створов и вызывает соответствующие клинические проявления.
При сборе анамнеза у пациентов 1-й группы особое внимание уделялось препаратам, которые они принимали в период болезни и которые могли способствовать возникновению вышеуказанных симптомов. Так, было выявлено, что 4 (10,8%) пациента получали гидроксихлорохин, 9 (24,3%) — глюкокортикостероиды (ГКС) как минимум 3 нед. (максимально — 2 мес.). Один из пациентов сообщил о длительном приеме ГКС, так как после легкой формы COVID-19 у него развилась ревматическая полимиалгия, в связи с чем ГКС были назначены в дозе 15–20 мг на 1 год. Боль в суставах появилась после отмены ГКС у 2 пациентов более чем через 3 мес., у 7 пациентов — более чем через 6 мес.
Можно предположить, что антипролиферативный эффект ГКС проявился через несколько месяцев после их применения. У пациента, до выявления гипермобильности суставов принимавшего ГКС в течение 1 года по поводу ревматической полимиалгии, появились боли в тазобедренных суставах. На рентгенограммах обнаружена III стадия коксартроза, хондромаляция передневерхнего отдела вертлужной впаины и нагрузочной зоны головки бедренной кости 3–4-й степени, рекомендовано эндопротезирование.
Оценивая разные попытки патогенетического воздействия на SARS-CoV-2 (от гидроксихлорохина, в конечном итоге не показавшего эффективности, но и не наносившего существенного вреда суставам, до ГКС, нашедших широкое применение при лечения COVID-19 для подавления чрезмерного иммунного ответа организма), следует подчеркнуть, что ГКС являются значимым повреждающим фактором. Известно, что ГКС в дозировке выше 10 мг снижают выработку синовиальной жидкости, что способствует механическому разрушению сустава и формированию последующих выраженных заболеваний, требующих эндопротезирования суставов [7–10].
Значительной проблемой для таких пациентов стала ситуация в период пандемии COVID-19, когда учреждения здравоохранения в первую очередь оказывали помощь инфекционным больным. При этом очень большая доля пациентов с хроническими суставными болями не получала необходимой помощи [5, 11, 12].
В процессе исследования было выявлено, что интенсивность мышечно-суставной боли была выше, а спонтанная и связанная с физической нагрузкой одышка, сердцебиения и перебои в работе сердца, другие вегетативные расстройства перманентного типа, панические атаки выявлялись в 1-й группе значимо чаще, чем во 2-й (табл. 1). В связи с одышкой все пациенты, перенесшие COVID-19, обследовались в поликлинических условиях с проведением спирографии (показатели в пределах нормальных значений у 18 пациентов, незначительные обструктивные или рестриктивные нарушения — у 29), пульсоксиметрии (показатели в пределах 95–98%), теста с 6-минутной ходьбой (показатели соответствовали норме). Для оценки выраженности фиброзных изменений 6 пациентам была проведена повторная МСКТ легких. Выявлено субплевральное усиление периферического легочного интерстиция, что было расценено (при нормальных показателях спирографии, теста с 6-минутной ходьбой и пульсоксиметрии) как остаточные изменения поражения легких посл е COVID-19. Эти данные свидетельствуют об отсутствии явных органических изменений в легких, которые могли бы быть причиной спонтанной одышки (n=5) и одышки при физической нагрузке (n=29), беспокоившей лиц, перенесших COVID-19.
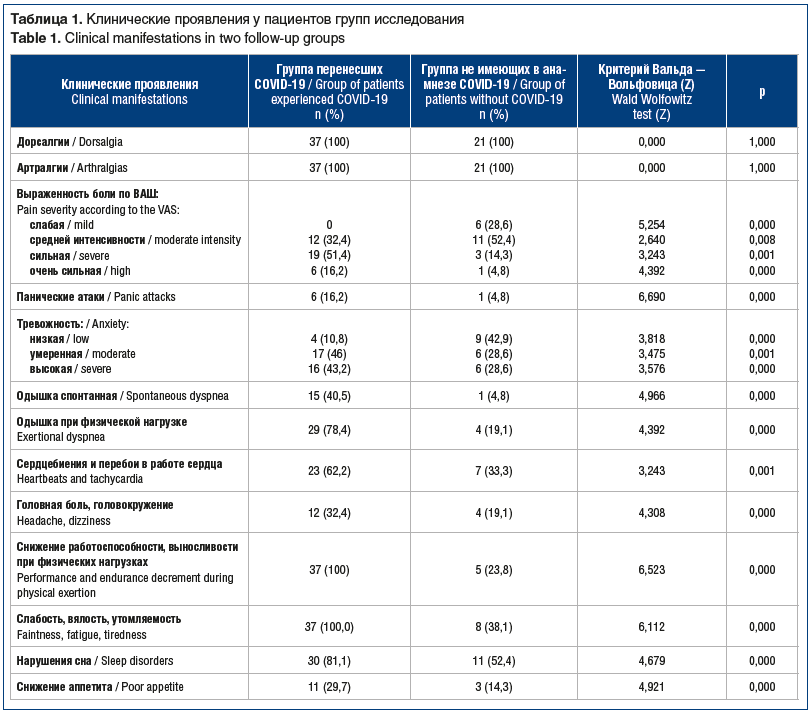
Динамика показателей качества жизни (SF-36) и боли по ВАШ представлена на рисунках 1 и 2. Если в 1-й группе основным методом лечения был медикаментозный — НПВП на 7–10 дней, то во 2-й группе, у подавляющего большинства пациентов которой интенсивность мышечно-суставной боли изначально была слабой и умеренной, проводились немедикаментозные мероприятия — коррекция модели движения и укрепление мышц, окружающих проблемные суставы. Только 3 пациентам с сильной больной и 1 пациенту с очень сильной болью во 2-й группе были назначены НПВП на 7 дней, повторных курсов не потребовалось.
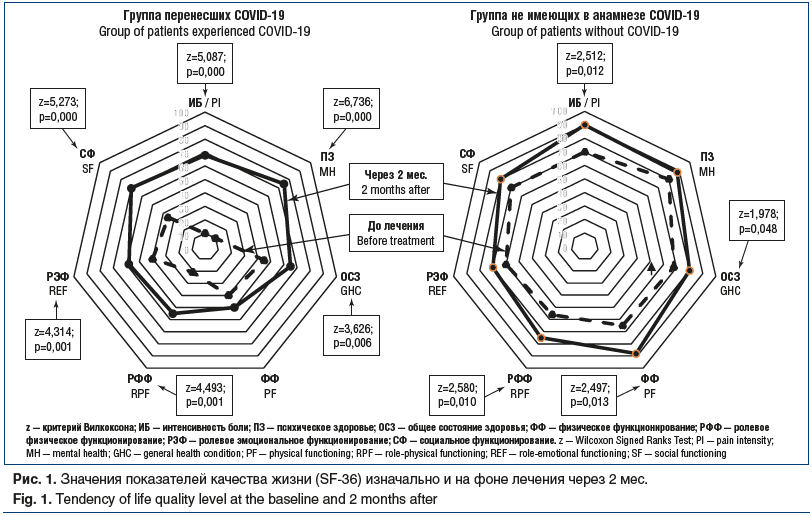
В течение 10 дней после назначения НПВП в 1-й группе у 29 человек боль уменьшилась, но не купировалась и через 1 нед. рецидивировала до первоначального уровня, что потребовало повторно применить НПВП. Через 2 нед. еще 1 курс медикаментозной терапии потребовался 15 пациентам для уменьшения и купирования болевых ощущений.
У пациентов 1-й группы НПВП оказывали достаточно быстрое, но кратковременное действие, что проявлялось недостаточным купированием и последующим рецидивированием мышечно-суставной боли при отмене препарата и даже ее усилением при сохраняющейся некорректной модели движения.
Исходные показатели интенсивности боли и качества жизни приведены в таблице 2. В 1-й группе получены изменения по 6 показателям опросника SF-36, а во 2-й группе — только по 4 показателям. Так, в 1-й группе пациентов достоверно выше показатель, характеризующий интенсивность боли, в то же время значимо ниже показатели ролевого физического функционирования, социального функционирования, общего состояния здоровья и психического здоровья.
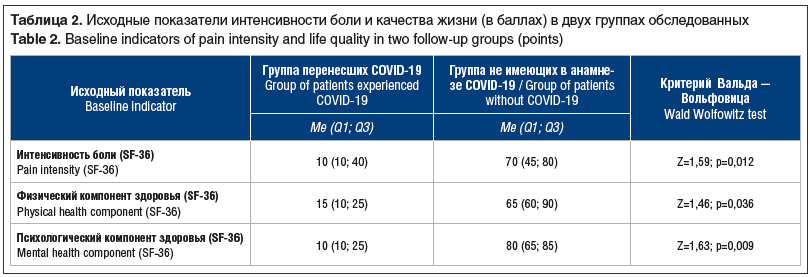
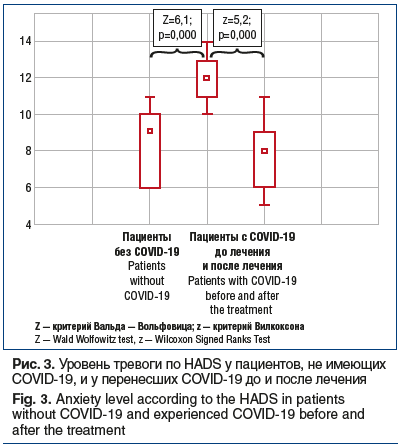
При исследовании по HADS получены достоверные различия в уровне тревожности в двух группах: 13 (11; 14) против 9 (6; 10), р<0,05 (рис. 3), а также исключена маскированная депрессия. При сравнении уровня ситуативной и личностной тревожности по шкале Спилбергера — Ханина были выявлены статистически значимые межгрупповые отличия. Так, уровень ситуативной тревожности в 1-й группе пациентов составил 49 (39; 51), а во 2-й — 40 (35; 44) баллов (p=0,001). Личностная тревожность в 1-й группе соответствовала 57 (52; 62), во 2-й группе — 44 (38; 55) баллам (p=0,05). Эти данные подчеркивают значение развития устойчивых болевых синдромов на фоне тревожных расстройств. Кроме того, для большинства пациентов, перенесших COVID-19 и имеющих болевой суставной синдром и дорсалгию, характерны перманентные или пароксизмальные вегетативные расстроЦ 9ства. Примечательно то, что у подавляющего большинства обследованных в возрасте до 30 лет эти расстройства появились впервые (n=33). У этих же 33 пациентов отмечалось рецидивирование болевого мышечно-суставного синдрома после двух курсов противовоспалительной терапии, а также умеренный и высокий уровень тревожности.
Указанным пациентам был назначен анксиолитик тофизопам по 50 мг 3 р/сут. Его применение способствовало снижению выраженности ассоциированной тревожности, купированию вегетативной симптоматики и уменьшению суставной боли (см. рис. 3), однако астенические жалобы сохранялись. Опосредованное влияние анксиолитика на болевые ощущения вполне объяснимо.
Через 2 мес. после начала наблюдения во 2-й группе не отмечено усиления болевого суставного синдрома или появления новой симптоматики на фоне немедикаментозной терапии. Подобные рекомендации давались и в 1-й группе пациентов, однако выявлено их нерегулярное и неточное выполнение пациентами с высоким уровнем тревожности.
Прием НПВП оказывал неполное и непродолжительное действие у пациентов в 1-й группе, в отличие от 2-й группы. Это обусловлено тем, что при медикаментозном лечении воздействие на основные звенья патогенеза мышечно-суставной боли не осуществлялось [13]. В частности, зафиксированная у пациентов 1-й группы повышенная тревожность, перманентные и пароксизмальные вегетативные нарушения и сохраняющаяся перегрузка суставов, приводящая к микротравматизации околосуставных мягких тканей, — это множественные механизмы возникновения и поддержания мышечно-суставной боли. Купирование боли на фоне приема НПВП можно объяснить тем, что основной причиной мышечно-суставной боли в 1-й группе пациентов было воспаление. Таким образом, можно согласиться с рекомендациями других авторов по медикаментозному лечению пациентов с синдромом гипермобильности суставов [13, 14], которые считают обоснованным назначение данной группы препаратов в случае интенсивной ¶ 1уставной боли. Однако боль может полностью купироваться и рецидивировать через некоторое время (1–2 нед.), что требует возобновления курсов противовоспалительной терапии [13, 14].
После 1 мес. наблюдения пациентов 1-й группы (с применением НПВП и анксиолитика), у которых сохранялись жалобы на слабость, вялость, утомляемость, снижение работоспособности, выносливости при физических нагрузках (n=34), им был назначен препарат, регулирующий метаболические процессы в ЦНС, — сульбутиамин по 200 мг утром и в обед на 4 нед. Через 1 мес. лечения было проведено исследование качества жизни, интенсивности боли и уровня тревожности. Отмечался рост показателей ролевого физического функционирования, социального функционирования, общего состояния здоровья и психического здоровья (см. рис. 1). Оценка динамики интенсивности боли (рис. 2), проведенная с помощью критерия Фридмана, показала статистически значимое снижение показателя у пациентов 1-й группы. Этого результата удалось достичь только при добавлении адъювантной терапии анксиолитиком и препаратом, регулирующим процессы в ЦНС, что привело к значимому снижению показателей тревожности у лиц, перенесших CОVID-19
(см. рис. 3).
Клинические, организационные и экономические проблемы здравоохранения во время эпидемии COVID-19 продемонстрировали важность обеспечения непрерывности медицинской помощи при ведении пациентов с гипермобильным синдромом, перенесших COVID-19, включая, во-первых, адекватную диагностику, а во-вторых, структурированную стратегию и экстренной помощи, и длительной реабилитации.
Заключение
Таким образом, усиление болевых суставных ощущений у пациентов с гипермобильным синдромом, перенесших COVID-19, во многом связано с высоким уровнем тревожности и сопутствующими ей перманентными и пароксизмальными вегетативными расстройствами в виде панических атак. Лавинообразное нарастание вегетативной симптоматики и тревожности у пациентов, перенесших COVID-19 с усилением болей при гипермобильном синдроме, требует назначения не только стандартной обезболивающей терапии (НПВП), но и адъювантной терапии в виде анксиолитиков (тофизопам) и препарата, регулирующего метаболические процессы в ЦНС (сульбутиамин). Назначение указанных средств приводит к значимому уменьшению или купированию суставно-мышечных болевых синдромов, вегетативных расстройств и улучшению качества жизни при снижении уровня тревожности.
Сведения об авторах:
Викторова Инна Анатольевна — д.м.н., профессор, заведующая кафедрой поликлинической терапии и внутренних болезней ФГБОУ ВО ОмГМУ Минздрава России, главный внештатный специалист по терапии и общей врачебной практике Министерства здравоохранения Омской области; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-8728-2722.
Иванова Дарья Сергеевна — к.м.н., доцент кафедры поликлинической терапии и внутренних болезней ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0003-3668-1023.
Моисеева Марина Викторовна — к.м.н., доцент кафедры поликлинической терапии и внутренних болезней ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0003-3458-9346.
Кочимов Роман Ширваниевич — врач участковый терапевт БУЗОО «Городская поликлиника № 4»; 644045, Россия, г. Омск, пр-кт Королева, д. 10, корп. 2; ORCID iD 0000-0002-1366-467X.
Адырбаев Альберт Муратович — к.м.н., заведующий дневным стационаром БУЗОО «КМХЦ» МЗОО; 644007, Россия, г. Омск, ул. Булатова, д. 105; ассистент кафедры поликлинической терапии и внутренних болезней ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0003-1003-8953.
Контактная информация: Викторова Инна Анатольевна, e-mail: vic-inna@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.02.2022.
Поступила после рецензирования 28.02.2022.
Принята в печать 25.03.2022.
About the authors:
Inna A. Viktorova — D. Sc. (Med.), Professor, Head of the Department of Outpatient Therapy and Internal Diseases, Omsk State Medical University; 12, Lenina str., Omsk, 644099, Russian Federation; chief supernumerary specialist in internal medicine and general practice Ministry of Health of the Omsk Region; ORCID iD 0000-0001-8728-2722.
Darya S. Ivanova — C. Sc. (Med.), Associate Professor of the Department of Outpatient Therapy and Internal Diseases, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0003-3668-1023.
Marina V. Moiseeva — C. Sc. (Med.), Associate Professor of the Department of Outpatient Therapy and Internal Diseases, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0003-3458-9346.
Roman Sh. Kochimov — general practitioner, City Outpatient Clinic No. 4; 10, bldg. 2, Korolev Ave, Omsk, 644045, Russian Federation; ORCID iD 0000-0002-1366-467X.
Albert M. Adyrbaev — C. Sc. (Med.), Head of the Day Hospital of the Clinical Medical and Surgical Center; 105, Bulatova str., Omsk, 644007, Russian Federation; Assistant Professor of the Department of Outpatient Therapy and Internal Diseases, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0003-1003-8953.
Contact information: Inna A. Viktorova, e-mail: vic-inna@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 02.02.2022.
Revised 28.02.2022.
Accepted 25.03.2022.
.
Информация с rmj.ru




