Введение
Актуальность проблемы диагностики и лечения больных с новообразованиями яичников (НЯ) обусловлена высокой частотой встречаемости данной патологии, особенно у пациенток старшей возрастной группы, и отсутствием четких критериев, указывающих на злокачественность поражения на ранних стадиях. НЯ, согласно современным данным, выявляют у 7,8% женщин репродуктивного возраста и 2,5–18% пациенток в постменопаузе1. Согласно мировой литературе, до 5–10% женского населения подвергаются оперативному лечению по поводу опухолей яичников, среди них у 13–21% выявляются злокачественные поражения. Рак яичников (РЯ) занимает седьмое место среди всех онкологических заболеваний, диагностированных у женщин во всем мире, и девятое место — в России [1], а в структуре онкологической смертности в России — восьмое место (5,5%). Особенности течения РЯ даже при современном подходе к лечению, к сожалению, не позволяют достичь излечения большинства больных, а общая пятилетняя выживаемость остается в пределах 30% [1, 2].
Трудность выявления РЯ обусловлена тем, что на данный момент в мире нет общепринятого «золотого стандарта» неинвазивной ранней диагностики РЯ2. Это связано с рядом причин, в основе которых лежит отсутствие четко обоснованного представления об этиологии и патогенезе данного заболевания. На сегодняшний день отсутствуют специфические диагностические тесты, позволяющие определить опухоль на начальных стадиях развития [3–5]. Поэтому до 70% больных со злокачественными опухолями яичников I стадии и до 40% со II стадией заболевания госпитализируются в гинекологические стационары общего профиля, что затрудняет стадирование данного процесса [6, 7]. Поэтому в 70% случаев диагностика РЯ осуществляется уже в распространенной стадии, вследствие чего пятилетняя выживаемость больных не превышает 30% [1, 8, 9]. Однако четких критериев для маршрутизации больных в общегинекологический или специализированный онкологический стационар не существует. Так, в структуре гинекологического стационара общего профиля, согласно данным литературы, частота выявленного РЯ составляет 1–3% [10].
Для выявления группы высокого риска РЯ предложены различные прогностические модели, такие как ультразвуковые критерии IOТА (International Ovarian Tumor Analysis — Международная группа по анализу опухолей яичников), расчет индекса риска злокачественности RMI (Risk of Malignancy Index) и диагностический алгоритм расчета риска аденокарциномы яичников ROMA (Risk of Ovarian Malignancy Algorithm) [2, 4, 5, 10–15]. К сожалению, несмотря на высокую точность, данные модели не нашли широкого распространения в клинической практике. Так как придатковые новообразования в большинстве случаев имеют доброкачественный характер, существует низкая онкологическая настороженность у врачей первичного звена, а сложность дифференциальной диагностики может служить причиной позднего обнаружения злокачественных НЯ [16, 17]. Именно это делает выявление новых клинико-анамнестических факторов риска развития РЯ на этапе предоперационного обследования актуальным и позволит сформировать группу пациенток высокого риска малигнизации для направления их в специализированный онкологический стационар.
Цель исследования: выявить клинико-анамнестические факторы риска НЯ и уточнить значение различных диагностических критериев в ранней диагностике РЯ.
Содержание статьи
Материал и методы
Проведен ретроспективный анализ 50 историй болезни пациенток, поступивших на оперативное лечение в связи с НЯ в гинекологическую клинику, и амбулаторных карт 32 женщин, обратившихся для планового осмотра в женскую консультацию № 1 ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России. Пациентки дали информированное согласие, исследование одобрено этическим комитетом организации, проводившей исследование.
Сформированы следующие группы: основная группа — 50 пациенток с НЯ и контрольная группа — 32 практически здоровые женщины. Ретроспективно в зависимости от результатов гистологического исследования удаленного операционного материала основная группа подразделена на 2 подгруппы: 1-я подгруппа — 37 пациенток с доброкачественными НЯ, 2-я подгруппа — 13 пациенток с пограничными и злокачественными НЯ. Всем пациенткам с НЯ выполнено полное клинико-лабораторное обследование согласно действующему клиническому протоколу и проведено оперативное лечение. Все пациентки с высокими значениями Сa-125 были проконсультированы онкогинекологом и получили рекомендации о лечении в стационаре общего гинекологического профиля.
В исследовании для каждой пациентки рассчитывали индекс малигнизации (ИМ) RMI по следующей формуле: RMI = М × U × Ca-125, где М — состояние менструальной функции, которое оценивается в 1 балл для пациенток в пременопаузе и в 3 балла для пациенток в постменопаузе. Ультразвуковая оценка (U) включала в себя наличие многокамерности, билатеральных образований яичников, солидного компонента, асцита или внутрибрюшинных метастазов. Присваивается 0 баллов при отсутствии вышеперечисленных признаков, 1 балл при наличии одного из признаков, 3 балла при наличии двух и более признаков [4]. Прогноз вероятности РЯ по RMI: при пороге 200 чувствительность 78%, специфичность 87%; при пороге 250 — чувствительность и специфичность соответственно 70 и 90% [5].
Статистическую обработку данных осуществляли в пакете прикладных лицензионных программ с использованием программ Microsoft Office 2016, Open Epi. В зависимости от типа распределения данных статистическую значимость различий между показателями независимых выборок оценивали по критерию U Манна — Уитни или t-критерию (М±m). Для оценки относительного риска рассчитывали отношение шансов (ОШ) с 95% доверительным интервалом (95% ДИ).
Результаты исследования
Исследуемые группы были сопоставимы по возрасту, большая часть пациенток находилась в постменопаузе (средний возраст пациенток с НЯ составил 54,40±1,72 года, у женщин без гинекологической патологии — 45,63±2,84 года). Значительная часть женщин с НЯ проживала в городе (89,21%) и поступила в стационар в плановом порядке по направлению женской консультации (74,58%).
В ходе нашего исследования проанализирована частота встречаемости экстрагенитальной патологии у женщин. Установлено, что у пациенток с НЯ достоверно чаще встречаются заболевания желудочно-кишечного тракта (ЖКТ), такие как гастродуоденит, холецистит, желчнокаменная болезнь, по сравнению с группой контроля (22 (44%) и 3 (9,38%) женщины соответственно, р<0,05). В 1-й подгруппе заболевания ЖКТ выявлены у 20 (54,05%) женщин, во 2-й подгруппе — у 8 (61,54%) женщин без достоверных различий. Заболевания мочевыделительной системы (в основном хронический пиелонефрит и цистит, а также мочекаменная болезнь) выявлены у 12 (24%) и 2 (6,25%) женщин соответственно с НЯ и гинекологически здоровых (р<0,05). Среди женщин с НЯ частота встречаемости заболеваний мочевыделительной системы составляет: в 1-й подгруппе — 10 (27,78%) случаев, во 2-й подгруппе — 2 (15,38%). Также были довольно распространены заболевания эндокринной системы, такие как ожирение, сахарный диабет 2 типа, заболевания щитовидной железы, — у 18 (36%) женщин с НЯ. Так, в 1-й подгруппе частота встречаемости заболеваний эндокринной системы составила 13 (35%) случаев, а во 2-й подгруппе — 8 (61,54%), что выше, чем в контрольной группе, — 6 (18,75%) случаев (p>0,05).
Семейный анамнез по встречаемости злокачественных заболеваний женских репродуктивных органов (рак молочной железы, РЯ и рак эндометрия) у ближайших родственников отягощен более чем у трети — у 18 (36%) пациенток основной группы и у 1 (3%) — в контрольной группе (р<0,05).
Анализ клинических особенностей течения НЯ показал, что практически все пациентки — 49 (98%) — жаловались на боли внизу живота различного характера, 8 (16%) пациенток — на увеличение живота в объеме, 3 (6%) — на дизурию, 2 (4%) — на кровянистые выделения в постменопаузе. Среди женщин репродуктивного периода с такой же частотой — 2 (4%) случая — встречалось нарушение менструального цикла (НМЦ), и только 1 (2%) пациентка не имела жалоб.
Нами был проанализирован репродуктивный анамнез. Установлено, что средний возраст наступления менархе у женщин в группе с НЯ и контрольной группе составил 13,12±0,61 и 13,42±0,23 года соответственно (р>0,05). Раннее (до 9 лет) и позднее (после 16 лет) менархе выявлялось только у пациенток с НЯ (2 (4,1%) и 4 (8,13%) пациентки соответственно), а ранняя менопауза отмечалась чаще у пациенток 2-й подгруппы по сравнению с контрольной группой — 4 (30,77%) и 4 (12,50%) пациентки соответственно. Различные НМЦ выявлены у 15 (30%) пациенток с НЯ и только у 1 (3%) женщины контрольной группы (р<0,05). Генеративная функция у пациентки с НЯ и женщин контрольной группы достоверно не различалась.
У женщин с НЯ по сравнению с женщинами контрольной группы статистически значимо (р<0,05) чаще выявляли хронические воспалительные заболевания органов малого таза (ВЗОМТ) — у 23 (47%) и 3 (9,4%) женщин соответственно, а также доброкачественные опухоли матки (миома) — у 18 (36%) и 1 (3%) женщины соответственно. У 6 (12%) женщин из группы НЯ уже проведено одностороннее удаление придатков в связи с доброкачественными НЯ.
При анализе данных анамнеза обследованных женщин установлено, что факторами риска развития НЯ являются заболевания ЖКТ (OШ 2,09, 95% ДИ 1,49–2,92), мочевыделительной системы (OШ 1,53, 95% ДИ 1,13–2,07), наследственная предрасположенность к раку репродуктивных органов (OШ 1,86, 95% ДИ 1,43–2,43), НМЦ (OШ 1,86, 95% ДИ 1,43–2,43), миома матки (OШ 1,74, 95% ДИ 1,31–2,31) и ВЗОМТ (OШ 1,83, 95% ДИ 1,35–2,48).
По данным УЗИ, у пациенток 1-й подгруппы преобладали опухоли размером от 10 до 20 см (18 (48,7%) случаев) и менее 10 см в диаметре (16 (43,24%) случаев), лишь у 1 (2,8%) женщины они имели размер более 20 см. Среди женщин 2-й подгруппы чаще были выявлены образования от 10 до 20 см (5 (38,5%) случаев) и даже более 20 см (6 (46,1%) случаев), у остальных пациенток выявлены образования менее 10 см (2 (15,4%) случая). По характеру содержимого более двух третей (68%) из всех НЯ были жидкостными. Внутристеночный кровоток был выражен у пациенток и 1-й, и 2-й подгрупы в 9 (24,3%) и 5 (38,46%) случаях соответственно. У женщин 1-й подгруппы преобладали однокамерные тонкостенные НЯ (25 (67,56%) случаев), двухкамерные НЯ выявлены у 3 (8,33%) женщин 1-й подгруппы и у 3 (23,07%) женщин 2-й подгруппы. Многокамерные новообразования с утолщенными стенками выявлены у 9 (69,23%) женщин 2-й подгруппы. Солидный компонент по УЗИ обнаружен в обеих группах НЯ, но чаще у женщин 2-й подгруппы (3 (8,33%) и 6 (46,15%) случаев соответственно для 1-й и 2-й подгрупп, p<0,05). Среди пациенток 1-й подгруппы в 21 (56,75%) случае новообразования были односторонние, в 11 (29,72%) — двухсторонние. Похожая тенденция прослеживалась и у пациенток 2-й подгруппы — 9 (69,2%) случаев и 4 (30,7%) случая соответственно. Свободная жидкость в брюшной полости выявлялась у женщин в обеих подгруппах — 2 (5,56%) и 1 (7,69%) случай соответственно в 1-й и 2-й подгруппах (p>0,05).
Среди лабораторных показателей большое значение имеет уровень онкомаркера Сa-125 [5]. У пациенток 1-й подгруппы среднее значение Сa-125 составляло 30,53±2,12 Ед/мл (при норме 35 Ед/мл). У 6 (16%) женщин этой подгруппы показатель Сa-125 был выше нормы. Женщины 2-й подгруппы имели среднее значение Сa-125 30,51±3,12 Ед/мл. У 2 женщин во 2-й подгруппе значение Сa-125 было выше нормы — 80,8±4,12 Ед/мл, но предварительное заключение у онкогинекологов предполагало доброкачественные НЯ. Таким образом, повышенные значения Сa-125 отмечались как в группе с доброкачественными НЯ, так и группе с пограничными и злокачественными опухолями яичников, что свидетельствует о его невысокой специфичности при данной патологии.
В исследовании нами подсчитывался ИМ согласно прописанной ранее формуле. В 1-й подгруппе с доброкачественными НЯ диапазон значений ИМ составил от 9,6 до 3085,2, во 2-й подгруппе — от 35,0 до 543,6. Статистически значимых различий по данному показателю подгруппы не имели.
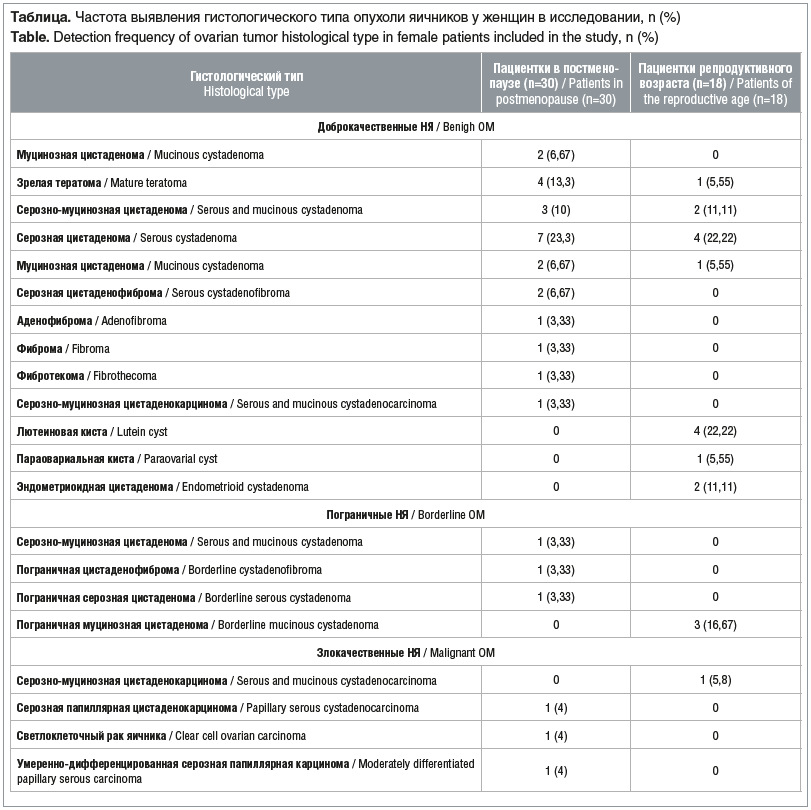
Всем пациенткам с НЯ проведено оперативное лечение в объеме лапаротомии, аднексэктомии с интраоперационной цитодиагностикой. В дальнейшем объем оперативного лечения определялся возрастом пациентки и результатом цитодиагностики. При гистологическом исследовании в 1-й подгруппе женщин менопаузального возраста обнаружились эпителиальные опухоли, опухоли стромы полового тяжа, а также герминогенные опухоли. Пограничные и злокачественные НЯ представлены опухолями эпителиального происхождения. У пациенток репродуктивного возраста доброкачественные и пограничные НЯ также представлены эпителиальными опухолями; злокачественное новообразование было диагностировано лишь у одной пациентки — серозно-муцинозная цистаденокарцинома. Наиболее частым морфологическим вариантом НЯ у женщин в постменопаузе является серозная цистаденома, а у женщин репродуктивного возраста — серозная цистаденома и лютеиновая киста. Подробная характеристика гистотипов опухолей, встретившихся в нашем исследовании, приведена в таблице.
Обсуждение
Поиском новых диагностических критериев злокачественного поражения яичников занимаются ученые всего мира. В качестве клинических факторов риска развития НЯ рассматриваются отсутствие беременностей в анамнезе, активное курение, ожирение, лечение бесплодия, гормональная монотерапия эстрогенами [1].
В нашем исследовании факторами риска развития НЯ выступили желудочно-кишечные заболевания и болезни мочевыделительной системы (ОШ 2,09 и 1,53 соответственно). Данные факторы, скорее всего, являются неспецифическими факторами развития опухолей, ведь нарушение пищеварения приводит к преобладанию процессов гниения или брожения в кишечнике, что ведет к повышенному всасыванию различных канцерогенов, а заболевания почек затрудняют их выведение.
Согласно полученным данным ВЗОМТ также увеличивают вероятность НЯ в 1,83 раза. Известно, что воспалительные заболевания органов малого таза и/или брюшины являются предрасполагающим фактором к развитию серозных пограничных опухолей и низкодифференцированной карциномы яичника, а тубэктомия может быть фактором профилактики НЯ [9, 18].
Нарушения менструального цикла различного характера явились фактором риска развития НЯ, увеличивая частоту их встречаемости в 1,86 раза. Роль НМЦ в развитии НЯ остается спорной, так как к факторам риска различные исследователи относят как раннее менархе, так и позднюю менопаузу, так же как и наоборот, позднее менархе и раннюю менопаузу [9]. По данным литературы, наличие поликистозных яичников и менопаузальная гормональная терапия также приводят к увеличению встречаемости НЯ [9, 18].
Наследственная отягощенность семейного анамнеза, безусловно, ключевой фактор риска развития РЯ. В нашем исследовании семейный анамнез отягощен у трети пациенток и был фактором риска (ОШ 1,86). Известно, что мутации в генах BRCA1 и BRCA2 являются фатальными и увеличивают риск возникновения рака молочной железы до 80–90% [10], риск развития серозного РЯ — до 54% для носителей мутаций BRCA1 и до 23% — при мутациях в гене BRCA2 [19, 20].
Приводим клинический пример выявления НЯ, алгоритм расчета ИМ и определения факторов риска.
Пациентка 59 лет с НЯ при поступлении предъявляла жалобы на периодические тянущие боли внизу живота, у гинеколога наблюдалась нерегулярно. Из гинекологических заболеваний в анамнезе указывала на хронический аднексит, НМЦ в виде олигоменореи с 34 лет. В анамнезе 1 своевременные роды, 1 медицинский аборт, самопроизвольный выкидыш в раннем сроке и 1 внематочная беременность, завершившаяся тубэктомией. Преждевременная менопауза в 39 лет. Гормонотерапию не получала. Наследственность не отягощена. По данным УЗИ матка не увеличена, М-эхо 4 мм, в области правых придатков определяется многокамерное жидкостное образование диаметром около 25 см без солидного компонента, однокамерная тонкостенная киста левого яичника до 5 см. Свободной жидкости нет. Уровень Ca-125 составил 342,8 Ед/мл, что более чем в 10 раз превышает норму. Проведен расчет ИМ: постменопауза — 3 балла, ультразвуковая характеристика — 3 балла, итого: ИМ = 3 × 3 × 342,8 = 3085,2. Пациентка проконсультирована онкологом, рекомендовано оперативное лечение по месту жительства. Проведены лапаротомия, двухсторонняя аднексэктомия с цитодиагностикой. Заключение цитодиагностики: злокачественный процесс. Расширен объем до экстирпации матки, резекции сальника и биопсии брюшины. Окончательный гистологический ответ: серозно-муцинозная цистаденокарцинома с участками некроза, псаммозными тельцами правого яичника, простые серозные кисты левого яичника.
В данном примере с большой долей вероятности можно было уже на дооперационном этапе предположить злокачественное НЯ, однако пациентке было отказано в лечении в специализированном стационаре, несмотря на имевшиеся клинические факторы риска — ВЗОМТ, НМЦ, ранняя менопауза, высокий ИМ.
Второй клинический пример иллюстрирует ложноположительный показатель RMI. Пациентка 57 лет предъявляла жалобы на периодические ноющие боли внизу живота. У гинеколога наблюдалась регулярно, из гинекологических заболеваний отмечает миому матки малых размеров. В акушерском анамнезе: двое родов без осложнений. Последнюю менструацию отмечает год назад в 56 лет, что свидетельствует о поздней менопаузе. Наследственность отягощена по заболеваниям женских репродуктивных органов (НЯ, миома матки). По УЗИ указывается на двухстороннее поражение яичников, многокамерное жидкостное образование с левой стороны размером 15 см. Показатели Ca-125 в полтора раза превышают норму — 58,4 Eд/мл. Расчет ИМ: постменопауза — 3 балла, ультразвуковая характеристика — 3 балла, итого: ИМ = 3 × 3 × 58,4 = 525,6. Пациентке после консультации онколога рекомендовано оперативное лечение по месту жительства. Проведены лапаротомия, субтотальная гистерэктомия с придатками с цитодиагностикой. По данным цитодиагностики установлен доброкачественный процесс, заключительный гистологический ответ: муцинозная цистаденома левого яичника, инволютивные изменения правого яичника. У данной пациентки имелись факторы риска: доброкачественная опухоль репродуктивных органов (миома матки), поздняя менопауза, наследственная отягощенность и высокий показатель ИМ, тем не менее в итоге заключительный диагноз: доброкачественное НЯ.
Следующий клинический пример иллюстрирует ложноотрицательный низкий ИМ. Пациентка 60 лет обратилась в женскую консультацию с жалобами на мажущие кровянистые выделения, которые связывала с приемом антикоагулянтов. В анамнезе: миома матки малых размеров, аденомиоз, ВЗОМТ. В акушерском анамнезе: двое родов и два медицинских аборта без осложнений. Наследственность не отягощена. По УЗИ матка не увеличена, интерстициальные узлы 13, 16 и 21 мм, М-эхо 3 мм. Правый яичник в виде многокамерного образования 47×20×25 мм, левый яичник в виде многокамерного образования 125×135×87 мм. Свободная жидкость на участке 67×77×76 мм. Показатели Сa-125 составили 15,3 Ед/мл. Выполнена магнитно-резонансная томография (МРТ): кистозные образования обоих яичников, миома матки. При раздельном диагностическом выскабливании полости матки и цервикального канала получен гистологический ответ: железисто-фиброзный полип эндометрия на фоне эндометрия атрофического типа, хронический эндометрит, эндоцервикс без особенностей. Проведено обследование ЖКТ, патологии не выявлено. Данная пациентка не консультировалась онкологом, так как подозрения на малигнизацию не было ни по УЗИ, ни по МРТ, а онкомаркеры показывали нормальные значения. Пациентке выполнены лапаротомия, субтотальная гистерэктомия с придатками с цитодиагностикой. Заключение цитодиагностики: доброкачественный процесс. Окончательное гистологическое заключение: пограничная двухсторонняя папиллярная серозно-муцинозная цистаденома яичников с имплантатом в тазовую связку, лейомиома матки с гиалинозом стромы, аденомиоз, хронический двухсторонний сальпингит, диффузное воспаление тазовой связки. Пациентке рекомендован пересмотр препаратов в онкодиспансере, консультация онкогинеколога. После консультации выставлен окончательный диагноз: пограничная опухоль пересмотрена в сторону серозно-муцинозной аденокарциномы яичников. Пациентке рекомендовали релапаротомию с полным объемом операции и последующей химиотерапией. В данном примере только по УЗИ, учитывая критерии IOTA (многокамерность, двухстороннее поражение, асцит), уже на дооперационном этапе можно было думать о возможном злокачественном процессе [21]. Кроме того, такие факторы риска, как миома матки, аденомиоз, ВЗОМТ и кровомазанье в постменопаузе, могли повысить настороженность врача. К сожалению, в данном примере МРТ показала более низкую специфичность, чем УЗИ, а Сa-125 как прогностический маркер вообще не сработал. Срочное гистологическое исследование фрагментов опухоли также не обладает 100% диагностической значимостью. Согласно мировым данным, его чувствительность 71,1%, специфичность 84,3%, а в 6,6% случаев наблюдается гипердиагностика, в 30,6% — гиподиагностика [22]. Известно, что Са-125 может быть в пределах нормальных значений до 50% случаев при аденокарциноме. По данным литературы, он часто остается в норме при муцинозных (32%), эндометриоидных (30–60%) и светлоклеточных (40%) аденокарциномах [8]. И наоборот, повышение уровня Са-125 может быть связано с наличием эндометриоза, с болезнями печени, заболеваниями ЖКТ и туберкулезом [9, 23].
В 2015 г. предложена новая система учета заболеваний яичников O-RADS (Ovarian-Adnexal Reporting and Data System) для стандартизации терминологии и классификации рисков РЯ [24, 25]. Данная система объединила в себе морфологические критерии ультразвуковой, МРТ- и рентгеновской диагностики для повышения онкологической настороженности врача. К сожалению, несмотря на удобство в повседневной практике, данная система не учитывает ни факторы риска, ни содержание специфических онкомаркеров.
На сегодняшний день не существует надежного критерия, обладающего высокой чувствительностью и специфичностью для диагностики данных заболеваний. Вероятно, это связано с многообразием этиологических факторов, множеством морфологических вариантов опухолей и отсутствием специфических клинических проявлений. Учитывая пороговое значение ИМ, у женщин в постменопаузе с неблагоприятными ультразвуковыми критериями IOTA онкологическая настороженность врачей должна быть и при низких значениях Сa-125.
Заключение
Обобщая результаты проведенного исследования, можно заключить, что установленными факторами риска развития НЯ являются хронические заболевания ЖКТ (OШ 2,09) и мочевыделительной системы (OШ 1,53), наследственная предрасположенность к раку репродуктивных органов (OШ 1,86), НМЦ (OШ 1,86), миома матки (OШ 1,74) и ВЗОМТ (OШ 1,83) в анамнезе. Наиболее частым морфологическим вариантом НЯ у женщин в постменопаузе является серозная цистаденома, а у женщин репродуктивного возраста — серозная цистаденома и лютеиновая киста. Несмотря на большое количество исследований, посвященных проблеме ранней диагностике РЯ, до сих пор не существует надежного критерия, обладающего высокой чувствительностью и специфичностью. При ведении женщин в постменопаузе с неблагоприятными ультразвуковыми критериями врачам необходимо иметь высокую онкологическую настороженность даже при низких значениях онкомаркера Сa-125.
1Министерство здравоохранения Российской Федерации. Клинические рекомендации (протокол лечения). Диагностика и лечение доброкачественных новообразова- ний яичника с позиции профилактики рака. 2018. (Электронный ресурс.) URL: https://amurzdrav.ru/ftp/deti/docs/2018.12.04_15_4_10_2_7838.pdf (дата обращения: 05.09.2022).
2Министерство здравоохранения Российской Федерации. Клинические рекомендации. Рак яичников / рак маточной трубы / первичный рак брюшины. 2020. (Электрон- ный ресурс.) URL: https://protiv-raka.ru/wp-content/uploads/2021/07/kr547_60375480.pdf (дата обращения: 05.09.2022).
Сведения об авторах:
Смирнова Анастасия Владимировна — к.м.н., доцент кафедры акушерства и гинекологии, медицинской генетики ФГБОУ ВО ИвГМА Минздрава России; 153012, Россия, г. Иваново, Шереметевский пр-т, д. 8; врач акушер-гинеколог гинекологического отделения № 1 стационара клиники ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России; 153045, Россия, г. Иваново, ул. Победы, д. 20; ORCID iD 0000-0002-6811-6830.
Малышкина Анна Ивановна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии, медицинской генетики ФГБОУ ВО ИвГМА Минздрава России; 153012, Россия, г. Иваново, Шереметевский пр-т, д. 8; директор ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России; 153045, Россия, г. Иваново, ул. Победы, д. 20; ORCID iD 0000-0002-1145-0563.
Хрушкова Екатерина Павловна — ординатор ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России; 351609, Россия, г. Иваново, ул. Победы, д. 20.
Контактная информация: Смирнова Анастасия Владимировна, e-mail: anguseva@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 21.10.2022.
Поступила после рецензирования 16.11.2022.
Принята в печать 09.12.2022.
About the authors:
Anastasia V. Smirnova — C. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology, Medical Genetics, Ivanovo State Medical Academy; 8, Sheremetevskiy pass., Ivanovo, 153012, Russian Federation; obstetrician-gynecologist of Division No. 1 of the Clinical Hospital, V.N. Gorodkov Ivanovo Research Institute of Maternity and Childhood; 20, Pobedy str., Ivanovo, 153045, Russian Federation; ORCID iD 0000-0002-6811-6830.
Anna I. Malyshkina — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Medical Genetics, Ivanovo State Medical Academy; 8, Sheremetevskiy pass., Ivanovo, 153012, Russian Federation; Director of V.N. Gorodkov Ivanovo Research Institute of Maternity and Childhood; 20, Pobedy str., Ivanovo, 153045, Russian Federation; ORCID iD 0000-0002-1145-0563.
Ekaterina P. Khrushkova — resident of the V.N. Gorodkov Ivanovo Research Institute of Motherhood and Childhood; 20, Pobedy str., Ivanovo, 351609, Russian Federation.
Contact information: Anastasia V. Smirnova, e-mail: anguseva@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 21.10.2022.
Revised 16.11.2022.
Accepted 09.12.2022.
Информация с rmj.ru






