Введение
Боль в животе — чрезвычайно распространенная жалоба, с которой обращаются к врачу. Болевой абдоминальный синдром (БАС) — многофакторный синдром, подразумевающий проведение дифференцированной диагностики. С повторными эпизодами боли в животе сталкиваются 10–25% детей и подростков школьного возраста в течение года. И лишь 2–4% обращаются за медицинской помощью [1]. Общепринятая классификация в зависимости от продолжительности боли подразделяет ее на острую и хроническую. Благодаря достижениям в области медицинских технологий и лучшему пониманию патофизиологии боли в животе все чаще появляется возможность поставить точный диагноз. При этом наиболее частой причиной БАС у детей остаются функциональные заболевания (ФЗ) желудочно-кишечного тракта (ЖКТ) [2].
Цель настоящего обзора: обобщить последние тенденции в обследовании и дифференциальной диагностике острой и хронической боли в животе у детей, отразить современные терапевтические подходы к лечению БАС.
Проанализирована литература, посвященная БАС, за период с марта 2007 г. по март 2023 г., представленная в базах PubMed, Scopus и Web of Science, предпочтение отдавалось научным обзорам и метаанализам.
Содержание статьи
Острая боль в животе
Острая боль в животе у детей может представлять собой сложную жалобу для клинициста и требует быстрой диагностики и лечения, в том числе хирургического при необходимости. Наиболее распространенными причинами острой боли в животе у детей являются кишечные инфекции, хирургические или гастроэнтерологические заболевания (табл. 1) [3].
![Таблица 1. Частые патологии, протекающие с болью в животе (адаптировано по [3]) Table 1. Common disorders associated with abdominal pain (adapted from [3]) Таблица 1. Частые патологии, протекающие с болью в животе (адаптировано по [3]) Table 1. Common disorders associated with abdominal pain (adapted from [3])](https://medblog.su/wp-content/uploads/2023/06/Maski-abdominalnoj-boli-u-detej-doshkolnogo-i-rannego-shkolnogo-vozrasta-Medvedeva.png)
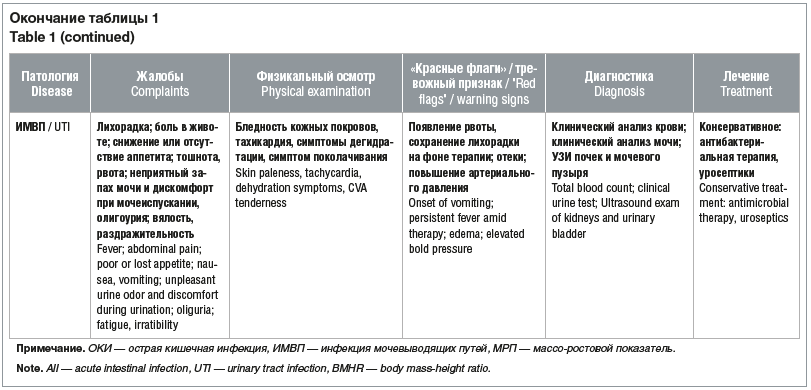
До 10% случаев БАС приходится на заболевания урогенитального тракта. Кроме того, иррадиация боли в живот возможна при патологии сердечно-сосудистой системы (перикардит), бронхолегочной системы (плеврит) [3]. Ряд аутоиммунных и эндокринных заболеваний (сахарный диабет, васкулиты) также может дебютировать в виде БАС [4, 5]. Однако до 60% эпизодов острой боли остаются этиологически не распознанными [3].
При выявлении причины и надлежащем лечении острая боль в животе обычно не приводит к неблагоприятным долгосрочным последствиям. Тем не менее существует ряд трудностей в ведении детей с БАС. Во-первых, боль у них часто является вторичной и требует проведения тщательного обследования. Во-вторых, как минимум у трети пациентов в исходе острого болевого синдрома формируется нарушение восприятия боли от гипо- до гипервисцеральной чувствительности, изменение микробиома и нарушение моторики ЖКТ [6]. Так, например, более чем у половины пациентов, перенесших экстренное хирургическое вмешательство, отсроченно возникает клиника функциональных расстройств органов пищеварения (ФРОП) с БАС [5], а в исходе кишечных инфекций — у 10–15% [7], что в свою очередь становится причиной жалоб на повторяющуюся или хроническую боль и/или резистентность к методам лечения, которые изначально были эффективными.
Хроническая боль в животе
Повторяющаяся боль в животе у детей определяется как минимум тремя эпизодами боли, которые возникают в течение как минимум 3 мес. и влияют на нормальную жизнедеятельность ребенка [8]. Под хронической болью в педиатрической практике принято понимать боль продолжительностью более 2 мес. [8–11], что согласуется с Римскими критериями IV (2016 г.) относительно продолжительности жалоб до постановки диагноза в течение как минимум 2 мес. [12].
Хронические, повторяющиеся боли в животе возникают у 9–15% детей и подростков. На данную жалобу приходится до 4% обращений к врачам звена первичной медицинской помощи и не менее 50% обращений к детским гастроэнтерологам [8, 11, 13].
После исключения анатомических, инфекционных, воспалительных или других метаболических причин в клинической практике наиболее распространенным диагнозом являются ФРОП. Органическая причина выявляется в 5–10% случаев [8, 9]. ФРОП, протекающие с болевым синдромом, обычно обусловлены одним ФЗ или их комбинацией: функциональной диспепсией (ФД), синдромом раздраженного кишечника (СРК), абдоминальной мигренью или синдромом функциональной абдоминальной боли (ФАБ) [8–10, 12, 14].
При проведении дифференциальной диагностики необходимо помнить также о заболеваниях ЖКТ, способных протекать под маской ФРОП.
Маски ФРОП
Аллергические заболевания ЖКТ, или пищевая непереносимость, нередко скрываются под маской ФД и СРК. При этом сопутствующие аллергические заболевания в 3 раза увеличивают шанс возникновения ФРОП в подростковом возрасте (отношение шансов 3,2, 95% доверительный интервал (ДИ) 1,6–6,6) [15]. В практике педиатра нередко наблюдается не-IgE-опосредованный вариант гастроэнтерологических нарушений ЖКТ. Подтвердить такой вариант аллергии можно, повторно задокументировав связь клинических проявлений с триггером (аллергеном) и по данным гистологического исследования (подсчет количества эозинофилов на 0,3 мм2), проведенного по биоптатам (не менее шести), взятым при эндоскопическом исследовании. Однако четкие гистологические критерии разработаны только для эозинофильного эзофагита и отсутствуют для определения эозинофильного гастроэнтерита и колита, также не установлены нормы для плотности тучных клеток слизистой оболочки, несмотря на доказанный их вклад в патогенез клинических проявлений [15–17].
Следует помнить о необходимости исключения гельминтной и другой паразитарной инвазии, особенно у пациентов с сочетанием болевого синдрома, нарушения характера стула и наличия сыпи на коже. Как правило, жалобы неспецифичны и могут сочетаться с периферической эозинофилией [17, 18].
Целиакия — это системное генетическое иммунное заболевание, ассоциированное с непереносимостью глютена. Распространенность целиакии в мире составляет около 1%. У ряда детей симптомы малоспецифичны и похожи на клинику ФРОП. Серологические тесты на целиакию следует проводить у пациентов с необъяснимой хронической или периодической диареей, с задержкой массо-ростовых показателей и полового развития, необъяснимой потерей массы тела, аменореей, трудно корректируемой железодефицитной анемией, тошнотой, рвотой, хроническими болями в животе, вздутием живота, хроническими запорами, рецидивирующим афтозным стоматитом и аномальным повышением уровня печеночных ферментов и у детей определенных групп риска [19].
Хроническая гастроинтестинальная ишемия (ХГИ) считается редким заболеванием. Большинству пациентов с ХГИ ставят диагноз только после длительного периода медленно прогрессирующих абдоминальных симптомов, в некоторых случаях с впечатляющей потерей массы тела. Нередко эти пациенты подвергаются повторным тщательным лабораторно-инструментальным обследованиям, не позволяющим, однако, поставить диагноз. Классическая триада симптомов, также известная как «абдоминальная стенокардия», определяется как сочетание боли после приема пищи, потери массы тела из-за страха боли после еды и боли в животе во время медицинского осмотра, наблюдается не у всех пациентов и нередко сочетается с неспецифическими симптомами со стороны ЖКТ [11]. В рамках проведения дифференциальной диагностики клиницистам важно помнить о частном варианте ХГИ — синдроме Данбара, представляющем собой компрессионный стеноз чревного ствола (median arcuate ligament syndrome — MALS, синдром срединной дугообразной связки), — заболевании, возникающем вследствие сдавления чревного ствола срединной дугообразной связкой диафрагмы, ее внутренними ножками и нейрофиброзной тканью чревного сплетения [20]. Диагноз ХГИ удается поставить с помощью УЗИ с допплерографией или при проведении мультиспиральной компьютерной томографии с болюсным контрастным усилением или КТ-ангиографии [11, 20].
Хронический аппендицит — это диагноз, характеризующийся длительной болью в правом нижнем квадранте. Реже боль локализуется атипично — в околопупочной области. Боль имеет разную степень выраженности, может возникать при погрешности в диете. Нередко в анамнезе таких пациентов есть указания на повторные исключения острой хирургической патологии при осмотре хирурга или госпитализации в хирургическое отделение без проведения оперативного вмешательства. Трудности при постановке диагноза могут быть связаны с тем, что БАС нередко сопровождается тошной, рвотой и нарушением характера стула. Диагноз удается поставить на основании данных УЗИ органов брюшной полости и малого таза, с обязательной оценкой слепой кишки, червеобразного отростка и мезентериальных лимфатических узлов. Маркерами хронического аппендицита являются: скопление жидкости в правой подвздошной ямке (3–5 мл); наличие зоны пониженной эхогенности, увеличение регионарных лимфатических узлов; замедление/отсутствие перистальтики в червеобразном отростке, незначительная гипоэхогенность мышечного слоя, участки сужения (менее 4 мм) или расширения (более 6 мм), локальная болезненность при надавливании датчиком [11, 21].
Если ребенок получает какие-либо лекарственные препараты, необходимо оценить взаимосвязь приема препарата и клиники ФРОП. Так, например, ферропрепараты, препараты, содержащие кальций, цинк, антибактериальные, нестероидные противовоспалительные препараты и др. нередко приводят к нарушению моторики ЖКТ и микрофлоры кишечника, клинически проявляющемуся симптомами ФЗ ЖКТ.
Длительное сохранение жалоб, не поддающихся стандартной терапии, требует от врача исключения аномалии развития ЖКТ, генетических (в том числе аутовоспалительных) и наследственных заболеваний.
Диагностика абдоминальной боли
Российским обществом детских гастроэнтерологов, гепатологов и нутрициологов с целью снижения количества ненужных исследований рекомендована этапность диагностики [2, 9, 10].
Первым шагом в диагностике являются сбор подробного анамнеза и тщательное физикальное обследование. Важно классифицировать БАС в зависимости от локализации, характера и типа боли, преобладающего симптома, связанного с болью (диспепсия, изолированная боль или нарушение функции кишечника). Оценить симптомы тревоги («красные флаги») и дифференцировать боль как органическую или функциональную (в соответствии с Римскими критериями IV) (табл. 2).
![Таблица 2. Дифференциальный диагноз органической и функциональной боли в животе [9] Table 2. Differential diagnosis of organic and functional abdominal pain [9] Таблица 2. Дифференциальный диагноз органической и функциональной боли в животе [9] Table 2. Differential diagnosis of organic and functional abdominal pain [9]](https://medblog.su/wp-content/uploads/2023/06/1687353145_257_Maski-abdominalnoj-boli-u-detej-doshkolnogo-i-rannego-shkolnogo-vozrasta-Medvedeva.png)
Среди симптомов («красные флаги»), требующих углубленного обследования пациента, выделяют [17]:
-
замедление роста и развития ребенка;
-
необъяснимую потерю массы тела или отсутствие долженствующей прибавки в соответствии с возрастом;
-
задержку полового созревания;
-
повторные эпизоды рвоты, постоянную рвоту;
-
дисфагию, одинофагию;
-
гастроинтестинальное кровотечение;
-
наличие ночной симптоматики: боли, приводящей к пробуждению ребенка или не дающей уснуть, ночной диареи;
-
наличие перианальной патологии (фистулы, свищи, параректальная боль и др.);
-
системные симптомы, такие как необъяснимая лихорадка или артрит;
-
органомегалию или ощутимое образование в брюшной полости;
-
вентральную грыжу брюшной полости;
-
наличие семейного анамнеза по воспалительным заболеваниям кишечника, целиакии, ранним злокачественным новообразованиям различных отделов ЖКТ.
Обнаружение «красных флагов» свидетельствует в пользу органической патологии ЖКТ и требует дальнейшего обследования пациента [17].
Вторым шагом является проведение соответствующих исследований, ограниченных простыми тестами при подозрении на функциональную боль (уровень I), и дополнительных исследований, если есть симптомы тревоги, а также в случае отсутствия ответа на адекватную терапию в течение 2 нед. Инвазивные исследования уровня II (эндоскопия) могут быть показаны пациентам с предполагаемой органической патологией. Потребность в проведении исследований уровня III, направленных на исключение более редких заболеваний, в том числе генетических и наследственных, возникает в небольшом проценте случаев [10, 22].
Наиболее часто педиатру приходится сталкиваться с ФЗ. Диагноз ФРОП ставится путем выявления характерных симптомов, определенных Римскими критериями IV, и исключения органических заболеваний ЖКТ, которые иначе могли бы объяснить эти симптомы [12].
Опубликованные Римские критерии IV (2016 г.) охватывают 20 функциональных расстройств у детей, часть из которых протекает с БАС [12]. Среди детей с функциональными болями в животе, получающих первичную медицинскую помощь, наиболее часто встречается ФАБ (53,8%), за которой следуют СРК (38,5%) и функциональная диспепсия (7,7%) [9, 12–16]. Несмотря на наличие четко определенных диагностических критериев, абдоминальная мигрень остается малоизвестным заболеванием и недооценивается как педиатрами, так и детскими гастроэнтерологами [13, 14].
Средняя продолжительность ФАБ у детей составляет 7,5 мес. (межквартильный диапазон 4,5–12 мес.), с большей продолжительностью у детей старшего возраста [6, 8]. Наравне с этим ФАБ сохраняется у 29% детей (95% ДИ от 28,1 до 30,2%) в течение как минимум 5 лет [23]. Не менее трети (35%) пациентов, имеющих ФРОП с абдоминальной болью, продолжают наблюдаться с аналогичными жалобами специалистами взрослого терапевтического звена [12].
Ниже представлены Римские критерии IV наиболее часто встречающихся в практике ФРОП, протекающих с клиникой боли в животе у детей и подростков (по [12, 24]).
Синдром раздраженного кишечника:
-
боль в животе, связанная по крайней мере с одним из следующих симптомов: дефекацией, изменением частоты стула, изменением формы стула;
-
у детей с запором или диареей боль не должна исчезать с устранением запора/диареи.
-
Функциональная диспепсия:
-
чувство сытости после приема пищи;
-
раннее насыщение;
-
боль или жжение в эпигастрии, не связанные с дефекацией.
Функциональная абдоминальная боль:
-
эпизодическая или непрерывная боль в животе, которая не возникает во время физиологических событий (например, прием пищи, менструация);
-
недостаточные критерии для СРК, функциональной диспепсии или абдоминальной мигрени.
-
Для постановки диагноза СРК, ФД и ФАБ вышеуказанные жалобы должны появляться не менее 4 раз в месяц в течение 2 мес., а боль не может быть объяснена другим заболеванием.
Абдоминальная мигрень:
-
приступообразные эпизоды интенсивной, острой периумбиликальной, средней или диффузной боли в животе продолжительностью не менее 1 ч;
-
эпизоды, разделенные неделями или месяцами;
-
боль выводит из строя и мешает нормальной деятельности;
-
стереотипная картина и симптомы у отдельного пациента;
боль связана с двумя или более из следующих симптомов:
Для постановки диагноза необходимо подтвердить наличие не менее двух эпизодов жалоб из всех перечисленных выше в течение не менее 6 мес.
Патогенез хронической абдоминальной боли
Современные медицинские технологии позволяют врачу выявить не только органическую причину боли, но и лучше понять ее патофизиологию. Хотя полный обзор патогенеза рассматриваемых расстройств выходит за рамки этой статьи, мы кратко изложим предполагаемые физиологические основы заболевания, чтобы лучше понять используемые стратегии лечения.
Возникновение хронической боли в животе представляет собой сложный патофизиологический процесс, включающий взаимодействие биологических (генетика, нарушение моторики, висцеральная гиперчувствительность, воспаление, нарушения сна, изменение микробиома, изменения в эндокринной и иммунной системе), психологических (тревога, депрессия) и социальных (например, плохие отношения с родителями, сверстниками или учителями) факторов. Эти факторы становятся причинами возникновения или поддержания боли, обусловливая тяжесть, частоту и длительность симптомов ФРОП [15].
Таким образом, у пациентов без органической патологии ЖКТ висцеральная боль возникает вторично по отношению к различным раздражителям, приводящим к активации энтеральной нервной системы для передачи нервного импульса в спинной и головной мозг. Потенциальные механизмы, объясняющие возникновение функциональной боли в животе, основаны на нарушении работы этой системы в разных анатомических локусах. К ним относятся усиление передачи сигналов периферическими нервами, центральная сенсибилизация и нарушения центральной модуляции боли [8–10, 12, 18, 25].
Висцеральная гиперчувствительность относится к измененной периферической нервной сигнализации или возникновению ощущения боли при отсутствии реальных раздражителей. При этом следует помнить о возможном изменении энтеральной чувствительности в ответ на острое повреждение в ЖКТ (например, инфекции или хирургическое вмешательство), нередко не возвращающейся к исходному уровню после купирования воспаления [8, 12, 25].
Другим предполагаемым механизмом является центральная сенсибилизация, концепция, аналогичная периферическому усилению. В этом случае мозг гиперактивен в ответ на входящий раздражитель, поступающий от периферических нервов.
Нарушения центральной модуляции боли влияют на систему, ответственную за усиление или ограничение периферических сигналов. Центральные механизмы связаны с психосоциальными стрессорами, а не с остаточными эффектами местных вредных раздражителей [8, 12].
Лечение абдоминальной боли
На сегодняшний день предусмотрен индивидуальный подход к каждому пациенту, основанный на сопутствующих физических и психологических симптомах. Стратегии лечения включают как немедикаментозные, так и фармакологические варианты терапии. Основополагающим условием является устранение причины, вызвавшей боль, и обеспечение удовлетворительного качества жизни ребенка. Первым компонентом терапии принято считать диетотерапию, модуляцию образа жизни и биопсихосоциальный подход (консультирование родителей, установление доверительных отношений как с ребенком, так и с его семьей, создание психологического комфорта у ребенка). Вторым компонентом является купирование болевого синдрома и симптомов, сопутствующих боли [1–5, 8–12, 25].
Наиболее частой причиной боли в животе выступает спазм и нарушение моторики, в связи с чем основой терапии будут спазмолитические средства, которые непосредственно воздействуют на гладкие мышцы ЖКТ [8, 9]. Большинство лекарственных препаратов, используемых для купирования болевого синдрома в животе при ФРОП, не имеют доказательной базы по эффективности в педиатрической практике. Это обусловлено не только малочисленностью исследований, но и значительной вариабельностью используемых методов диагностики и оценки эффективности в исследованиях. Решение о наиболее подходящем фармакологическом лечении в каждом конкретном случае необходимо принимать на основании доказательств, полученных в ходе исследований. В нескольких метаанализах (по данным рандомизированных клинических исследований) показана эффективность применения таких спазмолитических средств, как препарат масла мяты перечной (не имеющий разрешения к применению в России), тримебутин малеат и дротаверин [16, 26, 27].
Дротаверин — неселективный миотропный спазмолитик, ингибитор фосфодиэстеразы 4 (ФДЭ-4), входящий в стандарты лечения болезней органов пищеварения у детей [2]. Спазмолитический механизм действия обусловлен подавлением сократительной активности гладкой мускулатуры вследствие уменьшения поступления ионов кальция в гладкомышечные клетки, опосредованного блокадой распада циклического аденозинмонофосфата (цАМФ). Кроме кишечника, значительное содержание ФДЭ-4 отмечается в желче- и мочевыводящих путях, матке; в меньшем количестве ФДЭ-4 находится в бронхолегочной и сердечно-сосудистой системе. Так, например, накопление цАМФ в мышцах бронхов вызывает их расслабление — бронходилатацию, в миокарде увеличивает число сердечных сокращений, в юкстагломерулярных клетках почек увеличивается продукция ренина. Поэтому применение неселективных ингибиторов ФДЭ-4 ограничено большим числом лекарственных взаимодействий и узким диапазоном терапевтических доз, наличием возможных нежелательных явлений со стороны сердечно-сосудистой системы и ЖКТ [28].
M. Narang et al. [28] оценили эффективность 4-недельной терапии дротаверином в сравнении с плацебо у пациентов старше 4 лет с рецидивирующими болями в животе (n=132). Несмотря на снижение частоты эпизодов возникновения боли, количество дней без боли в месяц в группах было сопоставимо (17,4±8,2 дня в группе вмешательства и 15,6±8,7 дня в группе плацебо, p=0,234). При назначении дротаверина следует помнить о его системном действии и отсутствии риски на таблетках. При выборе различных лекарственных средств не менее важными являются возрастные ограничения назначения препарата. Для дротаверина (таблетки) это 6 лет и старше.
Таким образом, купирование БАС при использовании дротаверина будет достигнуто в случае гиперкинетических дискинезий ЖКТ. Следует помнить, что в педиатрической практике врач сталкивается не только с гипер-, но и с гипокинетическими нарушениями функции ЖКТ, а также нередкой сменой этих состояний у ребенка в течение года. Кроме того, неуклонно растет количество пациентов, БАС у которых обусловлен, прежде всего, наличием висцеральной гиперчувствительности, что требует подбора терапии, влияющей на энтеральную нервную систему, в том числе за счет энкефалинергической модуляции.
Наиболее часто используемым в педиатрической практике спазмолитиком, разрешенным с 3-летнего возраста, является тримебутина малеат, который широко применяется с конца 1960-х годов для лечения ФРОП, протекающих с абдоминальной болью. Он отнесен к классу спазмолитических средств, но по факту является многофункциональным препаратом. Эффективность в облегчении боли в животе была продемонстрирована в различных клинических исследованиях с различными протоколами лечения. Сначала считалось, что основной эффект обусловлен только его антиспастической активностью, но дальнейшие исследования его применения расширили знания о фармакологических эффектах. Так, было показано, что действие тримебутина опосредовано его действием как агониста на периферические δ-, μ- и κ-опиатные рецепторы и модуляцию высвобождения пептидов ЖКТ. Конечные моторные эффекты на ЖКТ сводятся к ускорению опорожнения желудка, индукции преждевременной фазы III мигрирующего моторного комплекса в тонкой кишке и модуляции сократительной активности толстой кишки. Кроме того, было установлено, что тримебутина малеат играет определенную роль в регулировании висцеральной чувствительности, а также является модулятором работы ионных каналов в кишечнике. В доклинических исследованиях обнаружено, что тримебутин изменяет работу кальциевого насоса в зависимости от концентрации кальция в клетках гладкой мускулатуры подвздошной кишки, также определена способность к блокаде натриевых каналов в сенсорных нейронах ганглиев спинного мозга крысы, что обеспечивало местный анестезирующий эффект препарата в кишечнике, активность которого была в 17 раз сильнее, чем у лидокаина [29]. Его функция на различных уровнях, от моторики до контроля боли, делает этот препарат уникальным, а его спектр действия может быть использован для лечения как гипермоторики, так и гипомоторики [28–32], что особенно актуально при перекресте ФЗ (overlap-синдроме) [26–35]. Тримебутина малеат безопасен, в том числе в комбинации с другими лекарственными препаратами [26–33]. Таким образом, одним из возможных патогенетических методов терапии, рекомендованных Российским обществом детских гастроэнтерологов, гепатологов и нутрициологов, является использование тримебутина малеата, который действует на энкефалинергическую систему, координирует работу кишечника, нормализует моторику и снижает висцеральную чувствительность [9].
Клинически доказано, что тримебутина малеат эффективен при лечении как острой, так и хронической боли в животе у детей, в том числе с ФЗ, особенно с СРК [29, 31–36].
G.S. Karabulut et al. [34] оценили эффективность терапии тримебутина малеатом в течение 3 нед. в сравнении с плацебо у пациентов 4–18 лет с СРК и ФД. Установлена статистически значимая (р<0,0001) разница в частоте клинического выздоровления — 94,9 и 20,5% в группе тримебутина малеата и группе плацебо соответственно.
O. Bekem et al. [36] оценили эффективность терапии тримебутина малеатом в течение 6 мес. в сравнении с плацебо у пациентов старше 3 лет (n=21) с замедлением моторики на уровне желудка и снижением аппетита. В конце лечения показатели стандартного отклонения массы тела и роста значительно улучшились (-1,0±0,6 против -0,8±0,7, р=0,008 и -1,1±1,0 против -0,8±0,9, р=0,003 соответственно) и уровень дефицита массы снизился с 81 до 66,7%. Улучшение опорожнения желудка было показано у 11 из 16 детей. Показатели аппетита по визуальной аналоговой шкале значительно улучшились при терапии (7,5±1,3 против 5,3±2,0, р=0,012).
Одним из препаратов, содержащих тримебутина малеат, разрешенных к применению у детей в России, является безрецептурный препарат Необутин®1. В педиатрической практике при выборе лекарственного препарата важно учитывать форму лекарственного средства и удобство применения. С 2023 г. на российском рынке представлена новая форма выпуска препарата Необутин® в виде гранул для приготовления суспензии в порционных пакетиках2. Преимуществом новой формы выпуска является стандартизированная дозировка препарата: 1 пакетик (25 мг) =1 доза для ребенка 3–5 лет. Гранулы для приготовления суспензии разводятся непосредственно перед приемом в стакане воды (100 мл) и имеют приятный апельсиновый вкус, который нравится детям, что облегчает прием препарата. Форма выпуска в виде порционных пакетиков исключает возможность микробной контаминации препарата в процессе использования.
Препарат Необутин® доступен в педиатрической практике в трех дозировках и двух лекарственных формах: таблетки 100 мг, таблетки 200 мг, гранулы для приготовления суспензии 25 мг. Это позволяет подобрать оптимальный вариант для детей разного возраста:
-
детям 3–5 лет: по 25 мг (1/4 таблетки или 1 пакетик гранул для приготовления суспензии) 3 р/день;
-
детям 5–12 лет: по 50 мг (1/2 таблетки или 2 пакетика гранул для приготовления суспензии) 3 р/день;
-
детям старше 12 лет и взрослым: по 100/200 мг 3 р/день [31].
Заключение
Боль в животе является распространенным симптомом у детей. Дифференциальная диагностика боли в животе обширна и нередко требует мультидисциплинарного подхода. Однако у подавляющего большинства пациентов в конечном итоге чаще всего диагностируют ФРОП. Сбор подробного анамнеза, тщательный физикальный осмотр и лабораторно-инструментальная диагностика позволяют установить верный диагноз. Современные стратегии персонализированного лечения включают как немедикаментозные, так и фармакологические варианты терапии. Лечебная тактика направлена на купирование болевого синдрома за счет устранения причины, вызвавшей боль, и применения спазмолитических препаратов. Арсенал спазмолитических средств в педиатрии ограничен рядом факторов: возрастные ограничения, форма выпуска, органолептические свойства, соотношение эффективности и безопасности препарата. Препаратом выбора для купирования абдоминальной боли у детей, после исключения ее органической природы, в педиатрической практике является тримебутина малеат (Необутин®) — наиболее изученный спазмолитический препарат, обладающий прокинетическим действием, который может быть рекомендован для лечения острой нехирургической и хронической боли в ЖКТ, обусловленной нарушением моторики и висцеральной гиперчувствительностью.
1Инструкция по медицинскому применению лекарственного препарата Необутин®. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_ v2.aspx?routingGuid=32aee573-5fa0-430d-80bf-d6177f576742 (дата обращения: 12.02.2023).
2Листок-вкладыш— информация для пациента. Необутин® 25 мг, гранулы для приготовления суспензии для приема внутрь, Необутин® 100 мг, гранулы для приготовления суспензии для приема внутрь. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=3bd0509f-cf61-4b0b-b959-182dfa3ef155 (дата об- ращения: 12.02.2023).
Сведения об авторах:
Медведева Евгения Александровна — к.м.н., ассистент кафедры пропедевтики внутренних болезней и гастроэнтерологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1; ORCID iD 0000-0001-7786-3777.
Хавкин Анатолий Ильич — д.м.н., профессор, главный научный сотрудник отдела гастроэнтерологии Института педиатрии им. Ю.Е. Вельтищева РНИМУ им. Н.И. Пирогова Минздрава России; 125412, Россия, г. Москва, ул. Талдомская, д. 2; ORCID iD 0000-0001-7308-7280.
Контактная информация: Медведева Евгения Александровна, e-mail: evgeniya0103med@yandex.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 10.03.2023.
Поступила после рецензирования 04.04.2023.
Принята в печать 27.04.2023.
About the authors:
Evgeniya A. Medvedeva — C. Sc. (Med.), assistant of the Department of Propaedeutics of Internal Diseases and gastroenterology, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, Delegatskaya str., Moscow, 127473, Russian Federation; ORCID iD 0000-0001-7786-3777.
Anatoliy I. Khavkin — Dr. Sc. (Med.), Professor, chief researcher of the Gastroenterology Department, Yu.I. Veltishchev Research Institute for Pediatrics of the Pirogov Russian National Research Medical University; 2, Taldomskaya str., Moscow, 125412, Russian Federation; ORCID iD 0000-0001-7308-7280.
Contact information: Evgeniya A. Medvedeva, e-mail: evgeniya0103med@yandex.ru.
Financial Disclosure: the authors have no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 10.03.2023.
Revised 04.04.2023.
Accepted 27.04.2023.
Информация с rmj.ru






