В статье представлены результаты оригинального исследования, посвященного определению влияния провоцирующих факторов на клиническую картину и течение острых аллергических и псевдоаллергических реакций у детей.

Острые аллергические реакции (ОАР) — распространенная патология, с которой дети проходят лечение в отделениях аллергологического профиля. ОАР часто относят к неотложным состояниям как весьма серьезную проблему, требующую скорее экстренной, чем плановой госпитализации. Причинами ОАР становятся преимущественно продукты питания и лекарственные препараты. По данным публикаций последних лет, распространенность аллергии, обусловленной реакциями немедленного типа на пищевые аллергены, составляет 0,1–7,0%, крапивница — 15,3–31,0% и в каждом втором случае сочетается с ангиоотеком. Хроническая крапивница у детей в общей популяции в среднем встречается у 0,1–3% [1–9]. Продукты питания наиболее часто вызывают ОАР — пищевую аллергию. Лекарственная аллергия среди госпитализированных с аллергическими реакциями встречается в 5–10% случаев. Распространенность кожных нежелательных лекарственных реакций составляет 2,2%; антибиотики становятся их причиной в 7% случаев, причем повторные реакции гиперчувствительности развиваются у 42% пациентов: у 28% — на ту же группу препаратов, при этом только 10% от всех побочных реакций обусловлены истинной лекарственной гиперчувствительностью [4, 10–13]. ОАР возникают преимущественно у лиц с генетической предрасположенностью, лица мужского пола подвержены им в 2 раза чаще [2, 3].
Цель данного исследования — выяснить влияние провоцирующих факторов (медикаментов или продуктов питания) на клиническую картину и течение острых аллергических (ОАР) и псевдоаллергических реакций (ПАР).
Содержание статьи
Материал и методы
Ретроспективное сравнительное исследование проведено на базе 23-го отделения ГДКБ св. Владимира (Москва). Проанализированы выписки из историй болезни 192 детей в возрасте от 6 мес. до 17 лет 11 мес. с основным клиническим диагнозом: «крапивница» или «отек Квинке», находившихся на лечении в 2010–2017 гг. Выборка произведена произвольно из компьютерного архива отделения. Доля пациентов с ОАР/ПАР, пролеченных в специализированном аллергологическом отделении, ежегодно составляет 13–18,2% и за последние 7 лет выросла на 5,2%. Верификация диагноза проводилась согласно Федеральным клиническим рекомендациям по диагностике и лечению крапивницы и отека Квинке (2013, 2015, 2018) с использованием диагностических критериев и современной классификации заболева-ний [1, 2, 7, 8]. Таким образом, в исследовании основной клинический диагноз «крапивница» имели 41,7% детей, «отек Квинке» — 15,6%, у 42,7% пациентов ОАР/ПАР протекала одновременно с симптомами крапивницы и ангиоотека.
Проведено общеклиническое обследование и лабораторное — анализ крови с оценкой лейкоцитарной формулы и эозинофилии (91% пациентов), печеночных показателей (69%). С учетом сложности дифференциальной диагностики рецидивирующих ОАР/ПАР в план обследования пациентов (по показаниям) включались: аллергодиагностика (с учетом стадии заболевания); УЗИ брюшной полости, пищевода и желудка (7,3%); эзофагогастродуоденоскопия (12%); серологические исследования (7,8%) на антитела к инфекционным агентам («атипичным» внутриклеточным патогенам, вирусам); консультации врачей смежных специальностей — отоларинголога, гастроэнтеролога, дерматолога.
Выполнен анализ anamnesis vitae et morbi пациентов, тщательно изучены и проанализированы факторы, непосредственно спровоцировавшие ОАР/ПАР. Предполагаемые причины заболевания конкретизированы родителями лишь в 73% случаев, в 52 (27%) случаях они остались неизвестными ввиду отсутствия полной информации о пищевом рационе ребенка, лекарственной полипрагмазии, отсроченности клинических проявлений. Невозможность верификации причины ОАР/ПАР росла с возрастом ребенка, пик неопределенности пришелся на 6–12 лет — 37,9% (рис. 1). У части пациентов причины не соответствовали критериям формирования групп сравнения, поэтому мы исключили из анализа 17 историй болезни. В группу исключения попали дети с физической крапивницей на холод и солнце, укусы насекомых, краску для волос (хну) и туалетное мыло с цитрусовыми добавками, реакциями на введение туберкулина и адсорбированную дифтерийно-столбнячную вакцину (данные причины указаны вместе с пищевыми погрешностями).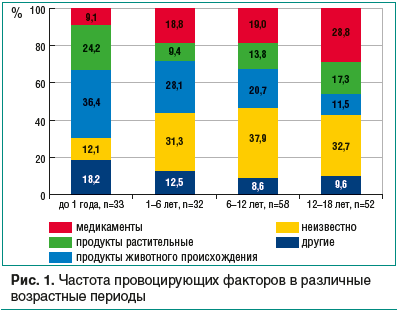
Таким образом, исходя из поставленной цели исследования сформированы группы сравнения: группа 1 — 46 детей с реакциями лекарственной гиперчувствительноcти (РЛГ), т. е. с ОАР/ПАР, возникшими на фоне приема или контакта с различными лекарственными веществами; группа 2 — 77 детей с ОАР/ПАР, развившимися в ответ на прием продуктов питания.
Результаты и обсуждение
Распределение детей по возрасту в группах сравнения представлено на рис. 2. Отмечается высокий процент (в 4 раза больше) детей грудного возраста в группе с пищевыми ОАР/ПАР, напротив, пациентов старше 12 лет в 2,2 раза больше в группе с РЛГ. Таким образом, дети младшего возраста чаще подвержены пищевым ОАР/ПАР, а подростки — РЛГ. Гендерные различия среди пациентов с ОАР/ПАР проявились лидерством мальчиков (на 14 и 20% больше в группах 1 и 2 соответственно).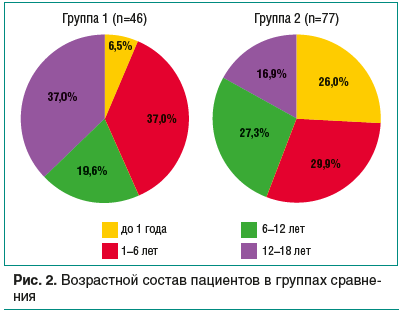
Сравнительный анализ причин, спровоцировавших настоящее заболевание и предшествующие реакции, представляет наиболее интересную и практически значимую часть исследования. Изучение анамнеза показало, что в группе 1 (РЛГ) крапивница (или ангиоотек) в ответ на медикаменты развилась у 26,1% детей, причем четверть из них повторили предыдущие ошибки (прием антибиотика и жаропонижающего средства на основе ибупрофена). Предшествующие реакции на пищу в этой группе имели лишь 10,9% детей. В группе 2 (ОАР/ПАР на продукты питания) реакция на медикаменты в анамнезе встречалась в 2,6 раза (10,2%) реже, а на пищу в 3,3 раза (36,4%) чаще. Настораживает, что у 14,3% пациентов (каждый 7-й больной) повторно развились симптомы ОАР/ПАР на те же продукты, на которые ранее уже была реакция: яйца, морковь, орехи, семечки, морепродукты. Необходимо заметить, что из 10 пациентов с наличием пыльцевой аллергии в анамнезе у 6 детей настоящая ОАР могла быть перекрестной, т. е. спровоцированной продуктами питания (морковь, орехи, фрукты, соки, фруктовый чай). Таким образом, четко прослеживается преемственность провоцирующих ОАР/ПАР факторов в динамике рецидивов заболевания.
Анализ причин, спровоцировавших настоящую госпитализацию, продемонстрировал изменение значимости причинных факторов в зависимости от возраста пациента (см. рис. 1). Обращает на себя внимание уменьшение в 2 раза значимости пищевых факторов (с 60,6% у детей до 1 года жизни до 28,8% у детей в возрасте старше 12 лет) и увеличение в 3 раза роли лекарственных средств (с 9,1 до 28,8% соответственно) в развитии ОАР/ПАР по мере взросления ребенка. Среди причин пищевых реакций у детей грудного возраста превалируют продукты животного происхождения (36,4%): молоко и смеси на коровьем молоке, яйца, мясо (курица, индейка, говядина), рыба. После 12 лет их значение падает до 11,5% (рыба, креветки, колбасы). Отметим, что спектр растительных продуктов, провоцирующих ОАР/ПАР у детей, почти не меняется с возрастом: фрукты (абрикосы, персики, яблоки), ягоды и соки из них, орехи и семечки, однако расширяется за счет фруктов экзотических сортов (цитрусовых, киви), меда, специй.
Следует заметить, что родители предельно внимательны в уходе за детьми грудного возраста и почти всегда знают причину ОАР/ПАР. Зарегистрированы единичные случаи реакций на медикаменты (фенспирид, йод), причем эти препараты были применены с нарушением возрастных показаний, однако ошибок с повторным приемом этих средств не отмечено. В возрасте старше 12 лет возрастает значимость лекарственных препаратов, причем среди медикаментозных причин регистрируются общие реакции на топические лекарственные средства (грамицидин C + цетилпиридиния хлорид, амилметакрезол + дихлорбензиловый спирт, фрамицетин), а также продукты бытовой химии местного применения (лекарства, кремы, мыло, краска для волос — хна).
Детальный анализ причин ОАР/ПАР у детей с РЛГ (группа 1) показал, что родители пациентов при сборе anamnesis morbi в большинстве случаев (80%) конкретно указывают одно определенное лекарственное средство, вызывающее реакцию, а в группе 2 (пищевые реакции) — определенная причина известна лишь в 53% случаев.
В группе 1 (медикаментозные ОАР/ПАР) у каждого третьего пациента причиной стал прием антибиотиков (30,4%), лидерами оказались аминопенициллины (86%), что закономерно ввиду действия современных рекомендаций о порядке применения антибактериальных препаратов при распространенных воспалительных заболеваниях детского возраста (дыхательной и мочевыводящей систем, ЛОР-органов) (рис. 3). Интересно, что половину случаев реакций (вероятно, ПАР) на аминопенициллины составили реакции на защищенные препараты (клавуланаты), поскольку клавулановая кислота подавляет активность ферментов печени (метилтрансферазы и диаминоксидазы), нарушая метаболизм гистамина. Еще у 14% пациентов развилась ОАР/ПАР на макролиды (эритромицин, азитромицин) [12, 13, 22]. Иммуномодуляторы (тилорон, бензокаин + интерферон альфа-2b + таурин, интерферон альфа-2b) стали причиной крапивницы/ангиоотека у 10,9% детей, витамины — у 8,7%, отхаркивающие средства (ацетилцистеин, бромгексин + гвайфенезин + сальбутамол, амброксол) — у 6,5%, НПВП (ибупрофен, парацетамол) — у 6,5%, противовоспалительные (фенспирид) — у 4,4%, спазмолитики (метамизол натрия + питофенон + фенпивериния бромид, дротаверин) — у 4,3% (в т. ч. девочки 17 лет, принимавшие препараты по поводу болевого синдрома при менструациях), другие (дипиридамол, циннаризин, фталилсульфатиазол) — у 6,5%. Интересно, что 21,7% детей ответили генерализованной реакцией на лекарственные средства местного действия (йод, амилметакрезол + дихлорбензиловый спирт, грамицидин C + цетилпиридиния хлорид, фузафунгин, фрамицетин, декспантенол).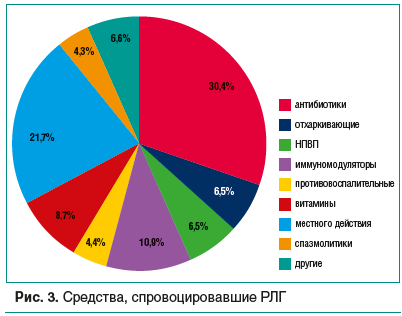
В группе 2 факторами пищевых ОАР/ПАР стали продукты животного происхождения (яйца, мясо, молочные продукты, рыба и креветки) — 30% случаев, растительная пища — 40,3%, сладости в виде конфет, шоколада, мороженого — 20,8%, другая пища — лапша быстрого приготовления, фаст-фуд (родители не смогли выделить конкретный причинный пищевой ингредиент). Пищевые реакции у каждого 4-го ребенка (26%) вызывают фрукты, ягоды, соки, морсы и чаи с фруктовыми добавками, овощи (картофель), а у каждого 10-го — орехи и семечки (9,1%) (рис. 4).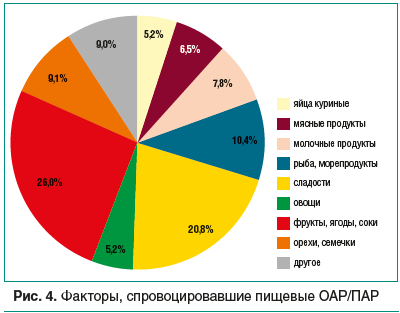
Анализ клинико-анамнестических данных показал, что отягощение семейной аллергологической наследственности у детей с ОАР/ПАР встречалось нечасто (лишь у каждого 6-го пациента), что может свидетельствовать о высокой частоте неаллергической природы заболевания. В личном аллергологическом анамнезе у 28,1% детей выявлены: атопический дерматит (АД) (15,2 и 18,2% пациентов соответственно группам сравнения) и респираторная аллергия: бронхиальная астма, аллергический ринит, поллиноз (13 и 16,9% соответственно группам сравнения), по поводу чего к моменту настоящей госпитализации дети уже состояли на диспансерном учете у аллерголога. Интересно, что при пищевой аллергии в анамнезе в 2 раза чаще регистрировался АД (что соответствует представлению об «атопическом марше») [2, 3, 14], а при ангиоотеках (в области лица) у каждого 5-го пациента обнаруживался аллергический ринит (возможно, предшествующая сенсибилизация слизистой носо-, ротоглотки играет неблагоприятную роль в будущих провокациях ОАР).
Гастроэнтерологическая патология (хронический
гастрит, гастродуоденит, функциональные расстройства желчевыделения, желчнокаменная болезнь, гастроэзофагеальная рефлюксная болезнь) выявлена в анамнезе у 8,7 и 6,5% детей соответственно группам сравнения, по поводу чего до настоящей госпитализации пациенты наблюдались гастроэнтерологом. Обследования, выполненные в отделении в рамках диагностического поиска причин ОАР/ПАР, обнаружили эзофагит у 11 пациентов (5,7%) и эрозивный бульбит у 5 (3,1%). Острота воспаления слизистой оболочки ЖКТ на момент проявлений ОАР/ПАР отражает последствие агрессивного контакта (с пищей, лекарством), но возможно, что предшествовавшее воспаление спровоцировало пищевую (лекарственную) агрессию с развитием крапивницы/ангиоотека [12]. Именно эти изменения со стороны гастродуоденальной зоны были характерны для детей с распространенной крапивницей (в 3 раза чаще по сравнению с локализованными отеками Квинке).
Кроме прочего, 2,6% пациентов имели инфекционные заболевания (кишечную инфекцию, вирус Эпштейна — Барр, цитомегаловирусную инфекцию) в преддверии ОАР/ПАР, что доказано положительными серологическими тестами.
Дети с ОАР/ПАР в остром периоде госпитализировались преимущественно экстренно, пик поступления в стационар приходился на 2–3-е сут заболевания (более 50%) независимо от провоцирующих факторов (рис. 5). Однако пациенты с РЛГ (особенно с клиникой ангиоотека) госпитализировались быстрее — на 4–5-е сут болезни все уже находились на больничном режиме, а при пищевой провокации (и проявлениях в виде крапивницы) 5,2% пациентов продолжали поступать в больницу в плановом порядке на 2–4-й нед. заболевания на обследование (по направлению участкового врача или узкого специалиста) для выяснения причин рецидивирующих высыпаний.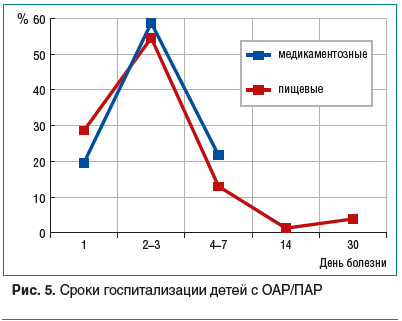
Представляет интерес динамика сезонной нагрузки профильного аллергологического отделения детьми с ОАР/ПАР, что весьма логично выявляет связь с провоцирующими факторами. Рисунок 6 демонстрирует увеличение количества пациентов, госпитализируемых с пищевыми реакциями, в январе — феврале, с максимумом в летнее время (июнь — сентябрь), что, вероятно, обусловлено возрастающим употреблением фруктов и овощей в теплый сезон года и частыми диетическими погрешностями в период зимних и летних школьных каникул. Частота госпитализаций детей с РЛГ увеличивается в холодное время года, с пиком в конце лета (в августе), что связано с динамикой заболеваемости сезонными вирусными инфекциями (респираторными зимой, кишечными летом).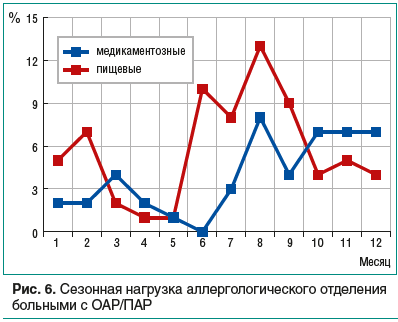
Анализ клинических проявлений ОАР/ПАР в сравниваемых группах показал превалирование у больных группы 1 (РЛГ) крапивницы (52%), сочетание крапивницы с отеками Квинке (еще 26,1%), изолированный ангиоотек наблюдался у этих пациентов лишь в 6,5% случаев. В группе 2 (дети с пищевой аллергией) отек Квинке без крапивницы встречался в 3 раза чаще (16,9%) и в 2 раза чаще имело место сочетание его с крапивницей (еще 53,2%).
Представляет интерес анализ частоты различной локализации отека Квинке в группах сравнения (рис. 7). Необходимо отметить, что клиническую картину ангиоотеков (изолированных или сочетанных с крапивницей) при ОАР/ПАР имели 58,3% детей, причем одновременная их локализация в разных (асимметричных) частях тела наблюдалась у каждого 3-го. Отеки в области головы (лицо, веки, губы, уши) имели 93,8% пациентов, отеки в области конечностей (кисти, стопы, суставы) встречались в 3 раза реже (32,3%).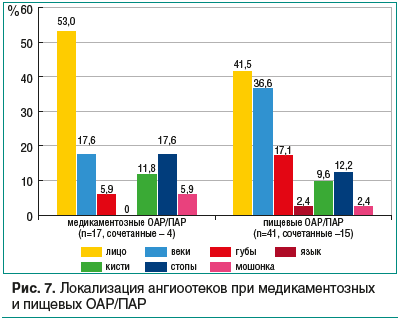
На рисунке 7 видно, что при медикаментозной провокации отеки лица встречались чаще, чем при пищевой, однако отеки губ и языка втречались в 3,3 раза реже, что, вероятно, отражает особенности техники приема лекарств — быстрое проглатывание таблетки (капсулы, суспензии), а не тщательное пережевывание пищи (что увеличивает время контакта с аллергеном). Интересно, что среди изолированных отеков Квинке их частота в области головы составляла 85%, а в области конечностей они встречались значительно реже. Отек мошонки в нашем исследовании наблюдался у 2 мальчиков из обеих групп сравнения. Мы не обнаружили у наших больных отека подскладкового пространства гортани, возможно, вследствие редкости подобной локализации аллергического отека или ввиду госпитализации пациентов в связи с тяжестью состояния в отделение реанимации.
Детальный анализ клинического исследования крови демонстрирует в остром периоде заболевания лейкоцитоз (выше 9×109) в крови у 58,7 и 54,5% пациентов (в группах 1 и 2 соответственно), причем при развитии клинической картины по типу отека Квинке лейкоцитоз имели 85,7% детей. Характерен яркий нейтрофильный сдвиг лейкоцитарной формулы для большинства пациентов с ОАР/ПАР, который у больных с отеком Квинке наблюдался чаще, чем при крапивнице (71,5% против 64,2%), возможно, ввиду более активной терапии глюкокортикоидами (ГКС). У трех детей обнаружена лейкопения (ниже 4×109). Умеренная эозинофилия (от 6 до 11%) в клиническом анализе крови выявлена лишь у 5 пациентов в остром периоде аллергической реакции, что подтверждает хемотаксис эозинофилов в ткани, в очаг аллергического воспаления. Кроме того, следует помнить, что активная ГКС-терапия подавляет продукцию эозинофилов.
Анализ биохимических показателей крови выявил повышение продукции одного из маркеров защитной острой системной воспалительной реакции — С-реактивного белка от 6 до 20 мг/л у 20,5% (у одного ребенка 13 лет с крапивницей с поздним поступлением — 50 мг/л). Исследование печеночных функций продемонстрировало повышение общего билирубина (более 20 мкмоль/л) лишь у 3 пациентов, уровня аланинаминотрансферазы (более 45 Ед/л) у 8,3% детей (максимально до 124–183 Ед/л), аспартатаминотрансферазы (более 45 Ед/л) у 35,6% больных (максимально до 178,9 Ед/л), причем функция печени (главного органа детоксикации, метаболизма, элиминации) больше страдала при РЛГ и клинической картине по типу распространенной крапивницы. Увеличение печени и селезенки ни у кого из пациентов не отмечено.
Аллерготестирование (скарификационные пробы) проведено лишь у 7 пациентов (3,6%) группы 2, поступивших в отделение в плановом порядке, через 3–4 нед. от начала первых проявлений ОАР/ПАР: выявлены единичные положительные пробы (1+, 2+) на животные (белок куриного яйца, курицу), растительные (яблоко, киви, арахис) продукты; бытовая сенсибилизация к эпидермису кошки — у одного больного. В анамнезе сенсибилизация к пыльце обнаружена у 22 пациентов (11,5%), к моменту госпитализации 10 из них имели клинический диагноз «поллиноз», однако проявления ОАР/ПАР не совпадали с сезоном пыления причинно-значимых растений. У 3 детей младшего возраста выполнено серологическое тестирование (стандартная педиатрическая панель), сенсибилизация к эпителию кошки низкого уровня обнаружена у одного пациента. Следует заметить, что уровень специфических IgE в остром периоде аллергической реакции может быть в пределах возрастной нормы, поскольку IgE-антитела не циркулируют в кровотоке, а фиксируются в шоковом органе ввиду высокой тропности к тканевым клеткам; уровень специфических IgE у маленьких детей еще очень низкий, а у старших детей может отражать не аллергическую природу, а паразитарную инвазию; наконец, отрицательный результат аллерготестирования может свидетельствовать о IgE-независимой аллергии или о псевдоаллергической реакции [1–3].
Согласно принятому протоколу лечения всем детям назначались гипоаллергенная (и по возможности элиминационная) диета, достаточный водный режим, антигистаминные препараты II поколения в возрастной дозировке; 15% пациентов в первые 2 сут пребывания в стационаре получали препараты I поколения (парентерально). Потребность в терапии ГКС у исследуемых детей была высокой (85,4%) независимо от причин заболевания, ввиду тяжести клинических проявлений, требующих госпитализации для оказания экстренной помощи. Однако целесообразно заметить, что при РЛГ и отеке Квинке в остром периоде системная гормональная терапия была необходима в 100% случаев, причем более длительным курсом, нежели при пищевой аллергии. Анализ показал, что короткие курсы ГКС-терапии (в течение первых суток, и даже однократно) применялись в 9 раз чаще при пищевых ОАР/ПАР (19,5% случаев), чем при РЛГ (2,2%). Причем при клинической картине ангиоотека 3 дней гормонотерапии было достаточно для купирования остроты ОАР/ПАР у 80% детей, а при крапивнице — у 50% пациентов. В остром периоде терапия ГКС более 7 дней детям не проводилась. Следует заметить, что 2,2–12% детей с ОАР/ПАР (наиболее часто при реакциях на пищу с клинической картиной рецидивирующей крапивницы) в ГКС не нуждались.
Инфузионная терапия потребовалась 19,1% пациентов в начале лечения заболевания с целью дезинтоксикации и восстановления микроциркуляции (с введением гормонов внутривенно), причем необходимость в интенсивной терапии возникала в 2 раза чаще при РЛГ с клинической картиной генерализованной крапивницы.
Мы проанализировали длительность стационарного лечения пациентов с ОАР/ПАР в зависимости от характера провоцирующих факторов, оказалось, что длительность в значительной степени зависит от клинических особенностей заболевания (рис. 8). Выявлено, что половина пациентов выписываются из отделения в первые 3 дня стационарного лечения (50 и 49,4% с медикаментозной и пищевой ОАР/ПАР соответственно) независимо от причинного фактора. В 1-е сут в 3 раза чаще выписываются дети с пищевой провокацией ОАР/ПАР (преимущественно по требованию родителей) в связи с быстрой стабилизацией состояния и в 5 раз чаще — с клинической картиной ограниченного отека Квинке.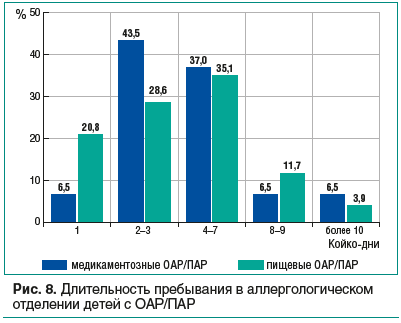
Таким образом, полученные в исследовании сравнительные данные наглядно демонстрируют влияние определенного провоцирующего фактора (продуктов питания или лекарств и химических веществ) на клиническую картину ОАР/ПАР и динамику симптомов на фоне проводимой терапии.
Заключение
Ретроспективный анализ, проведенный в ходе исследования, акцентировал наше внимание на некоторых особенностях клиники и течения ОАР/ПАР у детей, что, возможно, даст практические ориентиры в дифференциальной диагностике и тактике дальнейшего ведения пациентов. Так, пищевая реакция чаще возникает в младшем детском возрасте, реже наблюдается у подростков — на продукты животного происхождения и овощи. К фруктам, вызывающим ОАР/ПАР, относятся в основном экзотические сорта. У каждого 10-го пациента провоцируют реакцию орехи или семечки. В клинической картине ангиоотеки встречаются часто, особенно отеки губ и языка (из-за различной «техники» приема пищи и приема лекарств). Госпитализация с клиникой крапивницы нередко затягивается ввиду нестабильного терапевтического эффекта, но при пищевых отеках дети выписываются быстро. РЛГ учащаются с возрастом, часто встречаются реакции на препараты местного действия. Превалирует клиническая картина генерализованной крапивницы с повреждением барьерной функции печени и изменением лабораторных показателей, когда пациенты госпитализируются в ранние сроки (особенно с проявлениями ангиоотеков).
Терапия антигистаминными препаратами эффективна как при ОАР, так и при ПАР. ГКС требуются в 100% случаев при РЛГ, а инфузионная терапия применяется чаще у детей с распространенной крапивницей, стационарное лечение более длительное из-за рецидивирующих высыпаний вследствие рециркуляции лекарственных метаболитов.
Анализ фоновой патологии показал, что роль семейной отягощенности аллергологического анамнеза в развитии крапивницы и ангиоотека невелика ввиду превалирования в патогенезе неиммунных реакций. Напротив, наличие АД и аллергического ринита в личном анамнезе с сенсибилизацией (общей и местной), предшествующей ОАР, влияет на ее клиническую картину: АД часто способствует развитию крапивницы, а аллергический ринит — локализованного ангиоотека в области рото- и носоглотки.
Исследование позволило выявить сезонные взаимосвязи ОАР/ПАР с провоцирующими факторами и корреляцию лекарственных веществ с циркадными ритмами распространения инфекционных заболеваний, а пищевых — с пищевыми пристрастиями и погрешностями.
Прослежена преемственность провоцирующих факторов в историях заболевания: в анамнезе детей с пищевыми ОАР/ПАР, как правило, до госпитализации уже имелись реакции на продукты питания, а при лекарственных — на медикаменты. Анализ продемонстрировал высокую частоту (27%) ОАР/ПАР в ситуациях, когда родители не могли верифицировать причину, теряли контроль или не оказывали должного внимания рациону питания ребенка, а также при полипрагмазии. Выявленные случаи повторного приема причинных лекарственных средств и продуктов питания, уже однажды спровоцировавших ОАР/ПАР, должны вызывать настороженность ввиду риска развития жизнеугрожающего состояния (в частности, анафилактического шока при истинной аллергии). Лекарственные препараты, наиболее часто вызывающие ОАР/ПАР (антибиотики, жаропонижающие, отхаркивающие, противовирусные), являются широко применяемыми средствами безрецептурного отпуска, что повышает риск бесконтрольного самолечения. Кроме того, незнание проблем перекрестной аллергии, правил питания и лечения детей с поллинозом способствует провокации ОАР.
Информация с rmj.ru




