Введение
Вопросы противовирусной терапии респираторных инфекций у детей в настоящий момент являются крайне актуальными. Пандемия новой коронавирусной инфекции, вызванной вирусом SARS-Cov-2, еще раз продемонстрировала, что применение препаратов с противовирусным действием в первые 48 ч от начала клинических проявлений инфекции снижает тяжесть течения и улучшает исходы заболевания.
Назначение противовирусной терапии при респираторных инфекциях у детей определяется возрастом пациента, тяжестью состояния и этиологией заболевания. Кроме обширной группы респираторных вирусов причиной острых респираторных инфекций, в т. ч. рецидивирующих, могут стать вирусы группы герпеса.
Показана роль активных форм герпесвирусных инфекций (ГВИ) в рецидивировании инфекций органов респираторного тракта у детей и формировании хронических очагов инфекции аденотонзиллярной зоны. По данным А.С. Левиной и соавт., рекуррентные респираторные заболевания у детей от 1 года до 6 лет в 75% случаев ассоциированы с ГВИ [1]. Наиболее часто обнаруживаются активные формы инфекции, вызванной вирусом герпеса человека (ВГЧ) 6А/В, несколько реже — вирусом Эпштейна — Барр (ВЭБ) и цитомегаловирусом (ЦМВ) [2]. Проведенные ранее исследования показали, что в группе пациентов с ежемесячными респираторными заболеваниями маркеры ГВИ обнаруживаются в 91% случаев. При этом, по данным наших исследований, в группе детей с ежемесячными респираторными инфекциями доля активных форм составляет около 40%, что еще раз подчеркивает необходимость комплексного подхода к диагностике этиологии рекуррентных заболеваний органов респираторного тракта [3].
В последние годы становится актуальной проблема сочетанных ГВИ. Наличие сразу нескольких герпесвирусов в активной форме в острой фазе заболевания меняет клиническую картину и затрудняет лабораторную диагностику состояния.
В работе Н.Г. Ярославцевой [4] продемонстрировано, что концентрация ДНК ВГЧ-6 в лейкоцитах периферической крови и плазме взрослых пациентов почти в 3 раза ниже при смешанной ГВИ, чем при моноинфекции ВГЧ-6 (5,9×104 и 2×104 соответственно). Более ранние работы демонстрировали способность ВГЧ-6 к активации репликации ВЭБ из латентного состояния при сочетанной инфекции [5, 6]. В свою очередь, присутствие генома ВЭБ делало В-клетки более восприимчивыми к инфекции ВГЧ-6 [7]. Сочетание инфекции ВГЧ-6 и ВЭБ затрудняло диагностику активных форм ГВИ у беременных женщин [8] и у детей после трансплантации печени и почек [9].
Одним из наиболее изученных во всем мире противовирусных средств является инозин пранобекс [10, 11]. Препарат может влиять на уровни вирусной РНК, активен в отношении вируса простого герпеса (ВПГ), вируса папилломы человека, вируса иммунодефицита человека, вирусов гриппа и острых респираторных инфекций, ЦМВ-инфекции и ВЭБ [12].
Инозин пранобекс (синтетическое соединение парааминобензоата N-N-диметиламино-2-пропанола с инозином в молярном соотношении 3:1) широко используется с 1971 г. в качестве противовирусного средства, влияет на иммунную систему, усиливая пролиферацию Т-лимфоцитов и активность естественных клеток-киллеров, повышая уровни цитокинов [12–15].
В настоящее время противовирусные эффекты инозина пранобекса объясняют тремя механизмами:
Инозин пранобекс связывается со специфическими рецепторами клеточной мембраны лимфоцитов или проникает в клетку и оказывает прямое влияние на передачу сигналов, которые увеличивают ядерно-цитоплазматический транспорт и синтез РНК в лимфоцитах. Это приводит к стимуляции, созреванию и функционированию инфицированных вирусом лимфоцитов [16].
Инозин пранобекс подавляет синтез РНК вируса. Этот механизм обусловливает преобладание мРНК над РНК в клетках организма-хозяина, что снижает способность вируса контролировать синтез белка [17].
Инозин пранобекс усиливает действие эндогенного γ-ИФН, что является одним из компонентов стимулирующего воздействия препарата на клеточный иммунный ответ. Препарат способен повышать уровни ИЛ-2 и γ-ИФН, снижать уровень ИЛ-10, стимулировать созревание и дифференцировку Т-лимфоцитов, а также усиливать активированные лимфопролиферативные реакции [15].
В 2020 г. М. Votava и J. Beran предложили использовать инозин пранобекс в качестве неспецифического иммуностимулятора в лечении инфекции, вызванной вирусом SARS-CoV-2 [18]. Однако описания исследований по изучению противовирусной активности инозина пранобекса в отношении SARS-Cov-2 in vitro или клинических исследований в доступной литературе пока не встречалось.
В 2016 г. J. Beran et al. опубликовали результаты рандомизированного плацебо-контролируемого двойного слепого исследования IV фазы, где показаны эффективность и безопасность инозина пранобекса при острой респираторной вирусной инфекции (ОРВИ). В исследование было включено 463 взрослых пациента с подтвержденной ОРВИ, из них 231 получал инозин пранобекс, 232 получали плацебо. В исследуемой группе состояние пациентов улучшалось быстрее, чем в группе плацебо, среди пациентов моложе 50 лет без ожирения сроки купирования гриппоподобных симптомов достоверно сокращались. Отмечена хорошая переносимость инозина пранобекса [19].
Таким образом, в любой эпидемический сезон существует проблема выбора тактики противовирусной терапии у детей с респираторными инфекциями, в т. ч. рецидивирующими. В этиологии этих состояний играют роль активные формы ГВИ, включая сочетанные, в связи с этим необходимо применение препаратов с доказанным широким спектром противовирусного действия.
Цель исследования: оценка эффективности различных схем терапии с использованием инозина пранобекса (Нормомед®) у детей с ежемесячными инфекциями органов респираторного тракта на фоне реактивации ГВИ, в т. ч. сочетанных форм.
Материал и методы
Обследован 91 ребенок в возрасте от 3 до 17 лет (средний возраст 6,9±0,42 года), наблюдавшийся амбулаторно с жалобами на ежемесячные инфекции органов респираторного тракта в течение предыдущих 3 мес. и лабораторно подтвержденными активными формами ГВИ, в т. ч. сочетанных форм.
Пациенты были разделены на 4 группы в зависимости от способа лечения. В 1-й группе 12 детей получали лечение препаратом инозин пранобекс по схеме: инозин пранобекс 10 дней, затем 10 дней перерыв, затем инозин пранобекс 10 дней. Во 2-й группе 29 детей получали инозин пранобекс 10 дней, затем рекомбинантный ИФН-α2b в форме ректальных суппозиториев 10 дней, затем инозин пранобекс 10 дней. И в 3-й группе 24 детям была назначена терапия инозином пранобексом 10 дней, затем меглумина акридонацетатом по схеме на 1, 2, 4, 6, 8, 11, 14, 17, 20-е, 23-и сутки. Группу сравнения составили 26 детей, которым проводилась местная терапия воспалительных изменений в ротоглотке лекарственными средствами растительного происхождения. Доза инозина пранобекса в соответствии с инструкцией производителя составляла 50–75 мг/кг/сут, разделенных на 3–4 приема. Группы были сопоставимы по возрасту и гендерным характеристикам (табл. 1).
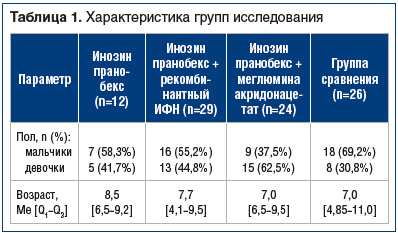
Всем пациентам проведено комплексное клинико-лабораторное исследование до начала терапии, а также после завершения лечения. Диагностика ГВИ проводилась на основании косвенных и прямых данных.
Методом ПЦР с гибридизационно-флуоресцентной детекцией результатов анализа в режиме реального времени в образцах периферической крови, мазках из ротоглотки выявляли и количественно определяли ДНК ВГЧ 5 типа, ВГЧ 6 типа, ВГЧ 4 типа. ПЦР-исследование проводили при помощи наборов реагентов, разработанных в ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
Кровь и мазки из ротоглотки проверяли на наличие антигенов вируса. Быстрым культуральным методом (vero, u937) выявляли ранние антигены ВГЧ-6 в сыворотке крови, клетках крови, мазке из ротоглотки. Методом непрямой реакции иммунофлюоресценции (экспериментальные тест-системы, созданные в ФГБУ НИЦЭМ им. Н.Ф. Гамалеи Минздрава России) выявляли поздние антигены ВГЧ-6 в сыворотке крови, клетках крови, мазке из ротоглотки.
Методом иммуноферментного анализа определяли вирусспецифические IgМ и IgG к белкам ВПГ-1, ВЭБ, ЦМВ с помощью наборов фирмы «Вектор-Бест» (Россия). Выявление специфических IgG к антигенам ВГЧ-6 проводили методом иммуноферментного анализа с использованием набора реагентов «ВектоHHV-6-IgG» (РУ № ФСР 2011/09853 2166, ЗАО «Вектор-Бест», Россия) на автоматическом иммуноферментном анализаторе Freedom EVOlyzer 200 (TECAN Schweiz AG, Швейцария). Концентрацию вирусспецифических IgG оценивали по коэффициенту позитивности: положительный результат ≥1,0; пограничный — от ≥0,8 до <1,0; отрицательный — <0,80.
Острая первичная инфекция диагностировалась при наличии виремии, повышении уровня IgM, а также отсутствии IgG. Реактивированная инфекция определялась при виремии и повышении уровня IgG в 2,5 раза и более. Повышение IgG и/или наличие ДНК вируса в мазке из ротоглотки без виремии расценивалось как проявление латентной формы инфекции.
Для объективной оценки данных до и после назначения курса исследуемых препаратов применялась схема ранжирования клинических признаков, представленная в таб-
лице 2.

Также оценивали вирусологическую и комплексную клиническую эффективность лечения в зависимости от проявлений острого респираторного заболевания (ОРЗ): полная эффективность — отсутствие ОРЗ в течение 3 мес. от начала терапии; неполная эффективность — уменьшение числа ОРЗ и/или снижение тяжести течения; отсутствие эффективности — сохраняющиеся ежемесячные ОРЗ.
Статистическая обработка данных проводилась с использованием Microsoft Office Excel 2016, IBM SPSS Statistics v.26. Для количественных показателей при нормальном распределении рассчитывались средние арифметические величины (M±SD), для сравнения выборок использовался t-критерий Стьюдента; при распределении, отличном от нормального, рассчитывались медианы (Me) и межквартильный интервал (Q1–Q3), для сравнения совокупностей использовался U-критерий Манна — Уитни. Номинальные данные описаны с указанием абсолютных значений и процентных долей. Сравнение номинальных данных проводилось при помощи критерия χ2 Пирсона и точного критерия Фишера. Различия считались достоверными при р<0,05.
Результаты исследования
Оценка клинической эффективности
Оценка клинической эффективности терапии, основанная на динамике зернистости задней стенки глотки, гипертрофии миндалин, лимфаденопатии и гепатомегалии, представлена в таблице 3.
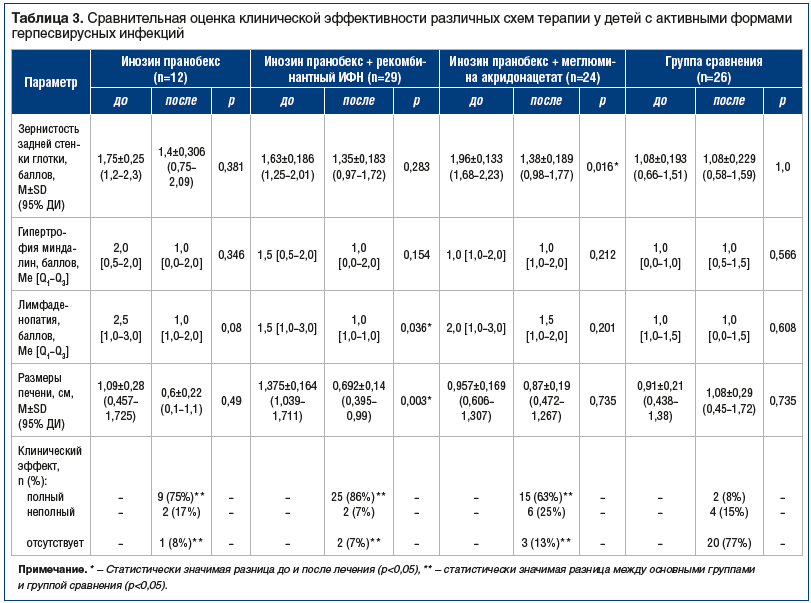
При сравнении выраженности зернистости задней стенки глотки видно, что наиболее выраженным на фоне проводимой терапии было восстановление слизистой задней стенки глотки у пациентов, получавших курс противовирусной терапии инозином пранобексом в сочетании с меглумина акредонацетатом. Во всех исследуемых группах изменение размера небных миндалин до и после проведения терапии, а также в группе сравнения были статистически незначимыми. При сравнении степени лимфаденопатии, выраженной в баллах (критерий Манна — Уитни), было установлено, что различия в группах статистически незначимы, за исключением группы с терапией инозином пранобексом в сочетании с рекомбинантным ИФН, где были отмечены статистически значимые различия (р=0,036). Выраженность лимфаденопатии была выше до терапии, чем после терапии (1,5 и 1,0 балла соответственно). Таким образом, наиболее быстро уменьшение выраженности полилимфаденопатии наступало у пациентов, получавших терапию инозином пранобексом в сочетании с рекомбинантным ИФН.
При сравнении размеров печени выявлено, что в группе пациентов, получавших терапию сочетанием инозин пранобекс + рекомбинантный ИФН, показатель до и после терапии имел статистически значимые различия (р=0,003 по t-критерию Стьюдента).
Таким образом, клинический эффект, оцененный с помощью установленных критериев (см. табл. 2), был достигнут у большинства пациентов, которые получали противовирусную терапию. Наибольшая доля пациентов с полным клиническим эффектом, т. е. отсутствием респираторных инфекций в течение 3 мес. от начала наблюдения, была в группе терапии инозином пранобексом в сочетании с рекомбинантным ИФН — 86%, в группе монотерапии инозином пранобексом полный клинический эффект достигнут у 75% пациентов, в группе терапии инозином пранобексом в сочетании с меглюмина акридонацетатом — у 63%, а в группе сравнения, не получавшей этиотропную терапию, — только в 8% случаев. Различия между пациентами, получавшими терапию, и пациентами группы сравнения статистически достоверны.
Оценка вирусологической эффективности
Структура ГВИ до и после лечения представлена на рисунке 1. Суммарно до начала терапии реактивация, вызванная ВГЧ-6А/В, была зафиксирована у 85,8% детей, вызванная ВЭБ — у 35,6%, вызванная ЦМВ — у 7,5%, вызванная ВПГ-1 — у 16%. До терапии моноинфекции были диагностированы более чем в половине случаев, сочетанные ГВИ — у 41% пациентов, из них наиболее часто выявлялся микст ВГЧ-6А/В + ВЭБ — в 23% случаев. После проведенного лечения у 63% пациентов имела место латентная инфекция ВГЧ-6А/В, доля микст-инфекций составила 8%.
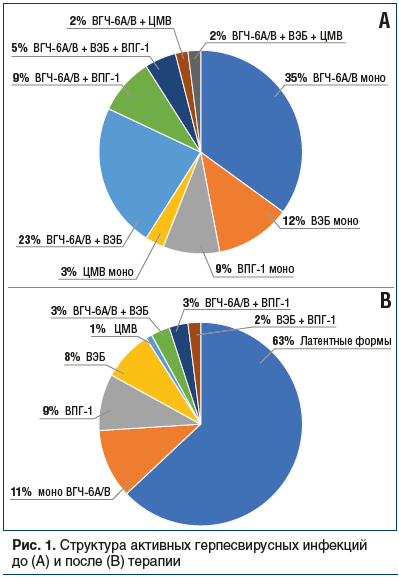
Вирусологическая эффективность оценивалась по доле пациентов с активными формами ГВИ в группах до и после лечения. Доля пациентов с активной инфекцией ВГЧ-6А/В после противовирусной терапии (65 пациентов) составила 35,4% (23 пациента), а в группе сравнения (26 пациентов) этот показатель был равен 69,2% (18 пациентов). При сравнении частоты реактивации ВГЧ-6 в зависимости от наличия этиотропного лечения препаратом инозин пранобекс (в виде монотерапии и в сочетании с другими противовирусными средствами) были выявлены статистически значимые различия (p<0,01). Таким образом, применение этиотропной терапии уменьшает шансы реактивации ГВИ в 4,11 раза (95% ДИ 0,092–0,646). Между сопоставляемыми признаками отмечалась средняя связь (V=0,307).
Заключение
Вопросы противовирусной терапии детей с респираторными инфекциями до настоящего момента остаются дискуссионными [20]. Узкий спектр противовирусного действия химиопрепаратов и отсутствие доказательной базы в зарубежных странах ограничивают применение этих лекарственных средств в детской практике [21]. Противовирусные свойства инозина пранобекса изучаются с середины ХХ в. в странах Европы и США [1, 3, 4, 6]. На сегодняшний день благодаря исследованиям in vitro объяснены его механизмы действия и продемонстрирована клиническая эффективность в ходе рандомизированных клинических исследований, в т. ч. плацебо-контролируемых [9].
Доказанный факт прямого противовирусного действия как на сезонные респираторные вирусы, так и на герпесвирусы позволяет использовать инозин пранобекс у детей с рецидивирующими респираторными инфекциями, связанными с реактивацией герпесвирусов. Для лечения ГВИ в Российской Федерации, кроме инозина пранобекса, зарегистрированы и другие препараты, имеющие опосредованную противовирусную активность: рекомбинантный ИФН-α2b, меглумина акридонацетат и тилорон. Ранее были описаны схемы последовательного применения препаратов с противовирусной активностью в терапии ГВИ у детей [19].
Все проанализированные в нашем исследовании схемы лечения показали большую клиническую и вирусологическую эффективность по сравнению с неприменением этиотропной терапии в группе сравнения. Показано, что на фоне терапии с использованием препарата инозин пранобекс более чем у 75% детей, включенных в исследование, отмечалось стойкое клиническое улучшение и снижение активности герпесвирусных инфекций, что было достоверно чаще, чем в группе сравнения. Применение препарата инозин пранобекс у детей с рекуррентными респираторными инфекциями в возрасте 3 года и старше снижало риск реактивации ВГЧ-6 в 4,11 раза. Полученные данные позволяют рекомендовать использование инозина пранобекса (Нормомед®) в терапии респираторных инфекций у детей как в острый период респираторного заболевания, так и при реактивации ГВИ.
Благодарность
Редакция благодарит АО «Валента Фарм» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru
