Введение
Объявление Всемирной организацией здравоохранения (ВОЗ) первого десятилетия XXI века «Декадой болезней костей и суставов» отражало озабоченность мирового сообщества как социальными проблемами, связанными с этим важнейшим разделом ревматологии и смежными с ним дисциплинами, так и ревматическими заболеваниями (РЗ) в целом. Последние, как известно, характеризуются высокой распространенностью, склонностью к прогрессирующему течению, ведущему к инвалидизации и снижению качества жизни, а также высокой «стоимостью» для пациента и здравоохранения в целом [1–3]. Постоянно появляются работы, оценивающие достижения и перспективы в области ревматологии [4, 5], возможности и эффективность внедрения новых методов диагностики, лечения и реабилитации различных РЗ в реальную клиническую практику [6–9, 10–12], их непростые организационные аспекты [13]. Вместе с тем эта реальная клиническая практика на протяжении последней четверти века осуществляется на фоне постоянно меняющейся социально-экономической ситуации, довольно неоднозначных реформ здравоохранения, а также случающихся форс-мажорных обстоятельств, например пандемии COVID-19, повлиявшей по-разному в разных регионах на эпидемические характеристики и организацию ревматологической помощи. Анализируя течение болезни [14, 15] и выявляя общие патогенетические аспекты коронавирусной инфекции и ревматической патологии [16–21], следует признать, что «несмотря на успехи, эта проблема содержит много белых пятен» [22]. Нозологическая структура госпитализированных больных, являясь отражением оказываемой стационарной специализированной ревматологической помощи, даже без глобального изучения эпидемических данных и данных на уровне поликлиники (безусловно, с оговорками и учетом известного несовершенства статистики), с нашей точки зрения, вполне может отражать состояние ревматологической помощи в регионе в целом и интересна для ее оценки в различные временные периоды.
Цель исследования: оценка изменений нозологической структуры больных ревматологического отделения за прошедшие четверть века: насколько они существенны и отражают ли тенденции в подходах к решению ревматологических проблем на госпитальном уровне в одном из регионов РФ.
Содержание статьи
Материал и методы
Методом сплошного исследования выполнен ретроспективный анализ архивных историй болезни 1998 г. (822 истории болезни), «доковидного» 2018 г. (924), «ковидного» 2021 г. (875) и условно «постковидного» 2023 г. (988). На основании анализа историй болезни изучали нозологическую структуру больных ревматологического отделения.
Структура госпитализированных больных за 2018, 2021 и 2023 гг. была скорректирована с учетом исключения плановых повторных краткосрочных госпитализаций с целью проведения курсов поддерживающей терапии генно-инженерными биологическими препаратами (ГИБП).
Результаты и обсуждение
Обратим внимание на то, что нозологическая структура больных, лечившихся в ревматологическом отделении, существенно отличается в указанные годы (табл. 1). В соответствии с доступными нам архивными данными в таблице представлены сведения лишь о выписанных больных (поэтому встречающийся далее термин «госпитализированные пациенты» в данной работе с некоторой условностью можно считать синонимом термина «выписанные пациенты»). Тем не менее, понимая важность вопроса о летальности, который должен был быть рассмотрен отдельно, укажем, что, согласно годовым отчетам, она составляла от 0,3% в 1998 г. и 0,4% в 2018 г. до 1,5% в 2021 г. и 0,9% в 2023 г. Причинами смерти больных во всех случаях наряду с основным заболеванием явились тяжелая коморбидная патология или неспецифическая инфекция. Возросшие цифры летальности в «ковидном» 2021 г. заставляют предполагать, что в этом велика роль вируса SARS-CoV-2, однако этот факт остается на уровне подозрений, поскольку верифицировать коронавирусную инфекцию ни в одном из летальных случаев не удалось, а все больные с зафиксированной в отделении коронавирусной инфекцией оперативно переводились в соответствующие учреждения.
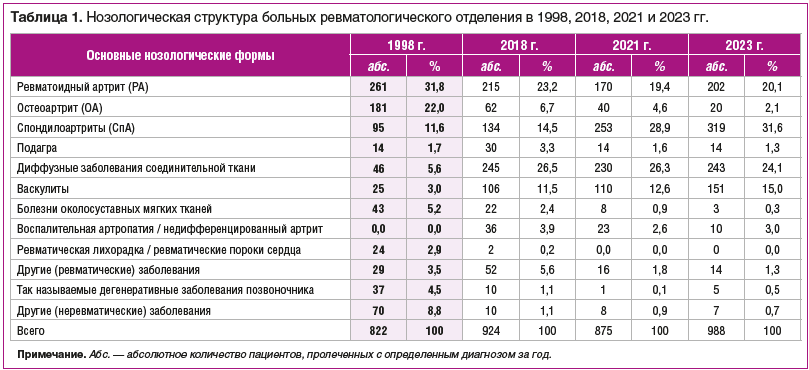
Логично, что наиболее существенные различия в нозологической структуре очевидны при сравнении большего периода: с 1998 г. и спустя четверть века, при этом различия между годами в последнюю пятилетку (2018, 2021 и 2023 гг.) не столь существенны и объяснимы не только произошедшими некими эпидемическими сдвигами или новыми диагностическими возможностями, позволившими сместить акценты на относительно малоизвестную ранее патологию, но и меняющимися нюансами организации высокотехнологичной помощи (в частности, большим числом повторных госпитализаций при некоторых нозологиях для проведения индукционной и поддерживающей терапии).
Итак, какие данные, с нашей точки зрения, заслуживают наибольшего внимания, и каковы возможные причины изменений нозологической структуры больных ревматологического отделения?
Прежде всего, заметим, что сведена к ничтожной доля так называемых «непрофильных больных» (с диагнозами «ИБС», «гипертоническая болезнь» и др.), которые неизбежно по разным причинам могли попасть в отделение (8,8, 1,1, 0,9 и 0,7% в разные годы соответственно), что, несомненно, является свидетельством более жестко контролируемой, более оптимальной госпитализации в последние годы в специализированное отделение, сократившееся при этом с 60 до 40 коек.
Полностью исчезли из ревматологического стационара так называемый ревматизм (ревматическая лихорадка) и ревматические пороки сердца (с 2,9% в 1998 г. до 0,0% к 2021 г.). Это логичное завершение «эры ревматизма», доминирующей в советской ревматологии, когда ревматолог считался специалистом прежде всего по «ревматизму». Чем бы ни объяснялся закат этой эры — широкими организационными мероприятиями, связанными с активной диспансеризацией и борьбой со стрептококковой инфекцией, или некими природно-эволюционными закономерностями, но к концу ХХ в. она завершилась: Институт ревматизма был переименован в Институт ревматологии, и в анализируемом 1998 г. в нашем отделении находились немногочисленные больные в основном с пороками сердца и гемодинамическими нарушениями. На этапе поликлиники эти больные еще «по инерции» шли к ревматологу, который перенаправлял их к кардиологу и кардиохирургу. И если в начале 2000-х у ревматолога поликлиники при областной больнице (по данным годовых отчетов) их еще было до 17%, то в 2018, 2020 гг. это были единичные пациенты, терявшиеся на фоне больных с другими РЗ.
Чрезвычайно редко по сравнению с 1998 г. в отделении в качестве основного диагноза звучит «остеохондроз» — дегенеративные заболевания позвоночника (снижение с 4,5 до 1,1–0,1–0,5%), и не потому, что его стало меньше («остео-хондроз» — термин, в последние годы подвергнутый критике неврологами и обозначающий различные варианты дегенеративно-воспалительных заболеваний позвоночника), а потому, что из неких «дипломатических» соображений соблюдения профильности он часто интерпретируется у больных ревматологического отделения не как основной, а как конкурирующий или сопутствующий ОА или другим РЗ диагноз. В то же время не исключается, что, с одной стороны, такая тактика — это только лишь региональная особенность, а с другой — признание дегенеративно-воспалительных заболеваний позвоночника вариантами ОА позвоночника позволит избежать подобных ухищрений, касающихся профильности пациентов, и доля их в структуре больных будет больше.
Прослеживается явная тенденция к сокращению числа случаев госпитализации больных РА (с 31,8 до 19,4–20%). К концу века эта патология заняла ключевое место, которое ранее в отечественной ревматологии занимал ревматизм. Почему это произошло, если в поликлинике количество этих больных в целом не изменилось? Во-первых, доля их все же уменьшилась за счет роста других категорий больных; во-вторых, мы не видим запущенных форм, требующих госпитализации; в-третьих, налицо оптимизация терапии на догоспитальном этапе с использованием и классических базисных средств (прежде всего, новых лекарственных форм и дозировок метотрексата), и современных таргетных и генно-инженерных биологических препаратов; в-четвертых, значительно уменьшилась доля больных с сомнительными и неверифицированными диагнозами, что случалось ранее, в частности, из-за невозможности определения серопозитивности по ревматоидному фактору (РФ), основному иммунологическому маркеру болезни, или ее определения устаревшими качественными методиками. В 2021, 2023 гг. РФ и антитела к циклическому цитруллиновому пептиду определялись практически у всех, и, хотя встречались так называемые серонегативные пациенты, что вызывало сомнения в диагнозе, такие случаи были единичными. В связи с использованием новых методов терапии следует заметить, что количество госпитализаций больных РА за 2018 г. и особенно за 2021, 2023 гг. могло быть еще меньше (и это касается не только больных РА), поскольку часть этих госпитализаций были повторными, и преследовалась цель не только индуцировать терапию ГИБП, но и соблюсти режим поддерживающей терапии. Так, в структуре госпитализированных больных в 2021 г., скорректированной с учетом исключения повторных краткосрочных госпитализаций с указанной целью, доля больных РА составила не 19,4, а 16,2%, т. е. сократилась вдвое по сравнению с 1998 г.
Отмечается существенное (в несколько раз) снижение доли больных ОА (с 22,0 до 2,1%). Несмотря на то, что обычно это заболевание лечат амбулаторно и с ним постоянно сталкивается каждый участковый терапевт, в 1998 г. каждый пятый госпитализированный больной был пациентом с ОА, однако спустя 20 лет — уже каждый двадцатый. Такая ситуация, по нашему мнению, связана: 1) с более правильной организацией поликлинической помощи, с более конкретными показаниями для госпитализации; 2) с более эффективной терапией (что, по-видимому, является наиболее важным) на поликлиническом этапе отдельных фенотипов ОА — болевых и воспалительных; 3) с большей доступностью локальной терапии в поликлинических условиях, в том числе в частной практике; 4) с достаточно широкой информационной работой с больными на всех уровнях оказания медицинской помощи за прошедшие годы, в том числе и в средствах массовой информации, а также со стороны фармкомпаний, активно продвигающих препараты для амбулаторной практики.
Обращает на себя внимание рост числа случаев СпА, особенно в 2021 и 2023 гг. (с 11,6 до 28,9–31,6% соответственно). Значительная доля случаев этой патологии в ревматологическом отделении в указанные годы, возможно, объясняется региональными особенностями ее ведения (которые обусловлены рядом обстоятельств и, безусловно, требуют оптимизации), заключающимися в повторных краткосрочных госпитализациях с целью поддерживающей терапии ГИБП. Если же скорректировать структуру госпитализированных больных с учетом исключения этих повторных госпитализаций, то рост числа случаев СпА за исследуемые годы будет выглядеть не таким «взрывным» (11,6, 14,3, 19,6, 23,9%), хотя и неуклонным, так что все равно каждый пятый больной — это больной СпА. Но, кроме того, такая ситуация связана в целом с ростом интереса к данной проблеме, новыми возможностями диагностики и терапии. Так, если в 1998 г. не проводилось типирование на HLA-B27, то в 2018 г. он исследовался у половины пациентов, а с 2021 г. — практически у всех. Трудно сказать, наблюдается ли истинный рост этих болезней или это обусловлено их выявлением на более ранней стадии. Вероятнее всего, оба факта имеют место в условиях как стационара, так и поликлиники. В связи с этим обращает на себя внимание увеличение количества направлений на госпитализацию с формулировкой «для уточнения диагноза». Отдельно обратим внимание на изменение нозологической структуры в этой группе госпитализированных больных. Из трех нозологических форм в 1998 г. около половины (42%) составляли больные с реактивным артритом (РеА), чуть меньше (34,2%) — с псориатическим артритом (ПсА) и еще меньше (23,8%) — с анкилозирующим спондилитом (АС) (табл. 2). В 2018, 2021, 2023 гг. зарегистрировано существенное снижение числа госпитализированных с РеА, но появились больные с так называемым недифференцированным СпА; возросло число пациентов с ПсА, в том числе и из-за передачи определенного контингента от дерматологов. Чем объяснить уменьшение количества больных РеА? Заметим при этом, что, по данным ревматолога областной поликлиники, их доля с начала века на приеме также постоянно снижается (11,0–3,8–1,6%).
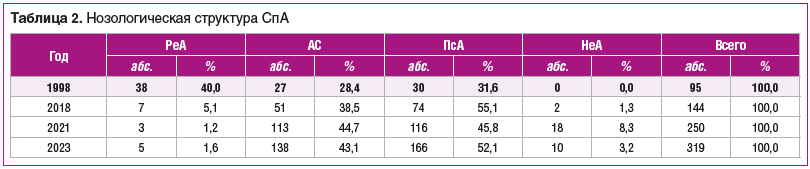
Резкое снижение доли стационарного контингента объясняется тем, что обычно это амбулаторные больные, а адекватное лечение острых форм РеА стало хорошо проводиться и врачами первичного звена. Возможно, это одна из причин уменьшения числа больных с РеА на приеме у ревматолога. Не исключается, что свой вклад внесла информационная работа, а также улучшение социально-экономических, социально-гигиенических и организационных факторов в стране по сравнению с 1990-ми и началом 2000-х. Еще одна возможная причина в том, что раньше в когорту пациентов с РеА входили пациенты, у которых интерпретация суставного синдрома (прежде всего, олигоартритов) была затруднена. Это пациенты, которых мы сегодня могли бы отнести к когорте пациентов с воспалительной артропатией / недифференцированным артритом (НеА). С большой вероятностью можно полагать, что стало больше хронических форм РеА, часть из которых (при отсутствии инфекции в анамнезе или при сомнительных данных) интерпретируются как другие формы СпА (чаще АС), в том числе и недифференцированные. И наконец, следует учесть факт большого диапазона статистических данных в РФ в разное время и в разных регионах, позволяющий предположить «региональный бум» внимания к данной проблеме.
По сравнению с 1998 г. зарегистрирован почти 5-кратный рост числа госпитализированных больных с диффузными болезнями соединительной ткани (с 5,6 до 26%), а также существенное изменение их нозологической структуры.
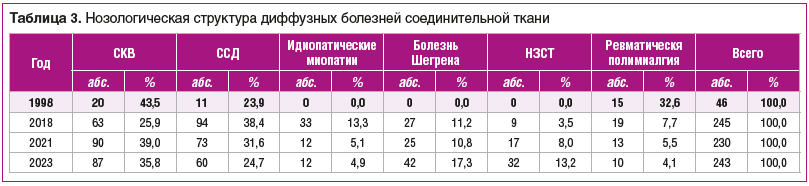
Очевидно, что увеличение количества случаев этих заболеваний связано как с ростом вирусных инфекций и различных неинфекционных провокаторов, нагружающих иммунную систему и вызывающих ее неадекватные реакции, так и с улучшением диагностики диффузных заболеваний соединительной ткани. Серьезный прогноз для этой группы заболеваний сделал их приоритетными для госпитализации, способствовал разработке и внедрению критериев диагностики, в том числе включающих иммунологические маркеры. Увеличению числа случаев госпитализации способствовали также и активные методы терапии, требующие не только индукционных, но и повторных поддерживающих курсов в процессе мониторирования активности заболевания. Если у большинства больных в 1998 г. иммунологические маркеры не определялись (либо имели место редкие случаи) или проводился устаревший тест на наличие lupus erythematosus (LE)-клеток), а диагноз ставился на основании клинической симптоматологии, то к 2021 г. они определялись у подавляющего большинства пациентов. Прежде всего, это касается определения антинуклеарного фактора и антител к ДНК, при необходимости — других маркеров в иммуноблоте, специфичных для отдельных заболеваний. Характерна динамика нозологической структуры этой группы больных (табл. 3). Спектр их стал значительно шире. Это не только три нозологии: две привычные (системная красная волчанка (СКВ) и системная склеродермия (ССД)) и включенная в эту группу ревматическая полимиалгия, но и идио-патические миопатии и болезнь Шегрена. Кроме того, стали регистрироваться смешанное (синдром Шарпа) и недифференцированное заболевания соединительной ткани (НЗСТ), а также перекрестные синдромы, причем если в 1998 г. был всего 1 такой случай (перекрестный синдром РеА и ССД), то в 2018 г. — 9 (4 перекрестных синдрома: РеА и ССД — 2, РеА и СКВ — 1, ССД и полимиозит — 1; 2 случая синдрома Шарпа и 4 НЗСТ). В 2021 г. зарегистрировано уже 17 таких форм (4 перекрестных синдрома, 2 случая классического синдрома Шарпа и 11 случаев НЗСТ (в число последних также вошли больные с формулировкой «неполный синдром красной волчанки»). Отметим, что многие случаи НЗСТ в 2021 г. можно рассматривать в рамках постковидного синдрома. Число НЗСТ еще более возросло в 2023 г., однако однозначно расценить их подобным образом мы уже не смогли, что не исключает (и мы с осторожностью придерживаемся этой точки зрения) того, что многие из них (разумеется, не все!) были индуцированы ранее перенесенной коронавирусной инфекцией. К сожалению, в 2023 г., на фоне изменения эпидемической ситуации и отсутствия обязательного контроля за уровнем антител к SARS-CоV-2, уже была затруднена интерпретация анамнестических сведений из-за их противоречивости, хотя «история с ковидом» еще не закончилась. Но это отдельная проблема, требующая специального изучения.
При сравнении состава больных ревматологического отделения в 1998 г. и в последние 5 лет мы видим 5-кратный рост доли больных васкулитами (с 3,0% в 1998 г. до 15% в 2023 г.). В нозологической структуре последних лет (табл. 4) среди всех больных васкулитами обращает на себя внимание снижение доли больных васкулитом Шенлейн — Геноха (с 36 до 5,3%), а также случаев, классифицированных как «другие васкулиты» (с 40 до 10,6%). Большую часть последних составляют дермо-гиподермальные васкулиты, меньшую (диагностировались преимущественно в последние годы) — иммунокомплексные. Одновременно мы видим примерно 3-кратный рост доли васкулитов с поражением сосудов крупного калибра, прежде всего, за счет роста числа случаев гигантоклеточного артериита, а также васкулитов, ассоциированных с антинейтрофильными цитоплазматическими антителами (АНЦА-васкулитов), которые в структуре васкулитов к 2023 г. составили половину всех случаев.
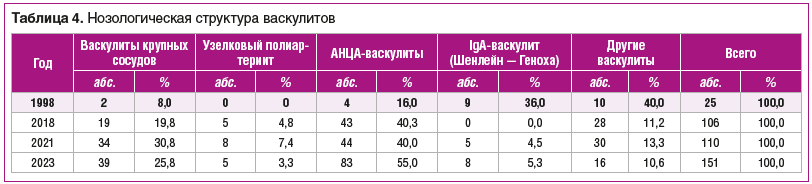
Такие изменения в структуре госпитализированных больных логично объяснимы как расширением диагностических возможностей (например, стало более доступно определение АНЦА и антител к протеиназе 3, миелопероксидазе, появлись более совершенные методы инструментальной диагностики), так и истинным ростом этой патологии (например, рост числа случаев гигантоклеточного артериита в большей мере определялся клинической картиной, а не лабораторными маркерами), а также информированностью о ней широкого круга врачей. Безусловно, на рост числа случаев влияют и повторные госпитализации больных для проведения активной поддерживающей терапии.
Итак, наибольшие различия в нозологической структуре больных ревматологического отделения очевидны между 1998 и 2018 гг., а также последующими годами, в то время как между 2018 и 2021, 2023 гг. они не столь существенны, что представляется логичным, учитывая в последнем случае меньший (лишь 5-летний) временной промежуток. В то же время их можно использовать для сравнения как «доковидный» и «ковидные» годы с целью оценки возможной связи коронавирусной инфекции и ревматической патологии, потребовавшей госпитализации. Мы попытались оценить такую связь, оценив полученные данные в 2021 г., поскольку это был один из «пиковых» годов пандемии; что касается 2023 г., то, несмотря на важность подобной оценки, как уже указывалось, мы встретились с затруднениями, в том числе по причине определенного снижения внимания в целом к контролю за ситуацией с коронавирусной инфекцией. Ранее нами уже были опубликованы детальные данные о влиянии коронавирусной инфекции на нозологическую структуру больных ревматологического отделения за 2018 и 2021 гг. [23].
Итак, в 2021 г. такая связь установлена у 76 (8,7%) больных, у которых коронавирусная инфекция зарегистрирована в пределах 6 мес. до госпитализации. Всех их можно разделить на 3 группы: 1) 18 (2,1%) человек с коронавирусной инфекцией, верифицированной уже в отделении, поскольку были госпитализированы с недиагностированной инфекцией на поликлиническом этапе и в дальнейшем переведены в специализированное инфекционное отделение; 2) пациенты, у которых клиническую картину болезни можно интерпретировать в рамках постковидного синдрома — 35 (4,0%) человек; 3) пациенты, у которых обострение ранее диагностированной болезни было несомненно индуцировано коронавирусной инфекцией — 23 (2,6%) человека [23]. Можно было ожидать более высокой доли больных, составляющих третью группу, но по ряду причин (методы и своевременность диагностики инфекции, субъективность интерпретации анамнестических данных и клинической картины) указанные выше цифры достаточно относительны. Если скорректировать нозологическую структуру 2021 г. с учетом исключения плановых кратковременных повторных госпитализаций с целью проведения курсов поддерживающей терапии, то они несколько увеличатся: 2,7, 5,2, 3,4%. При анализе нозологической структуры особый интерес представляет вторая группа. Это те пациенты, у которых симптоматику констатировали спустя 4 нед. после перенесенной коронавирусной инфекции. Четкая хронологическая связь постковидной астении и других симптомов с последующими событиями делает роль вируса в индукции этой патологии несомненной, хотя официально термин «постковидный синдром» по разным причинам фигурирует не во всех случаях. Из 35 пациентов этой группы у 15 постковидные ревматологические симптомы продолжались в течение 4–12 нед., у 20 — свыше 12 нед. Характерно, что в большинстве случаев эта патология имела неопределенную клиническую картину, не позволявшую четко классифицировать нозологическую форму. Это воспалительная артропатия (НеА) (8 человек), НЗСТ (10), смешанное заболевание соединительной ткани — болезнь Шарпа (2), так называемый неполный синдром красной волчанки (1), синдром ремиттирующего серонегативного симметричного синовита с подушкообразным отеком (remitting seronegative symmetrical synovitis with pitting edema — RS3PE) (1). Другие вирусиндуцированные случаи: ревматическая полимиалгия (2) и полимиозит (2) были достаточно типичны, а среди васкулитов в постковидном периоде (8) лишь половина носила типичные черты классифицируемых АНЦА-васкулитов (3) или гигантоклеточного артериита (1), другие же не имели четкой определенности; они носили по преимуществу дермо-гиподермальный характер или, например, при «угадываемой» клинической картине АНЦА-ассоциируемого васкулита (когда наряду с кожным синдромом отмечалось поражение легких и ЛОР-органов) были АНЦА-негативными. Таким образом, известный факт возможности индуцирования вирусом SARS-CoV-2 иммунных нарушений связан в том числе с появлением неопределенных с точки зрения классификации клинических форм РЗ. Повторим, что рост числа НЗСТ, различных клинических и иммунологических «перекрестов» в 2023 г. требует специального анализа и, возможно, объясним с позиции доминирующей региональной точки зрения ревматологов.
Анализ историй болезни за указанные годы демонстрирует существенные преобразования, происшедшие в подходах к терапии с начала века, чем также можно объяснить в определенной мере изменение нозологической структуры, поскольку наблюдается смена приоритетов для госпитализации: в первую очередь госпитализируются не только и не просто тяжелые больные, но больные для индукционной (в том числе плановой), а также поддерживающей (плановой) терапии активными (в том числе ГИБП) препаратами. Не всегда повторная госпитализация — это рациональная тактика, которая по разным причинам связана с ограниченной возможностью терапии в условиях центра генно-инженерной терапии или дневного стационара, однако к ней приходится прибегать, учитывая региональные особенности. Изменение терапевтических подходов на региональном уровне отражает прогресс ревматологии в целом. Не детализируя, укажем произошедшие изменения на основании анализа историй болезни госпитализированных больных в 1998 и 2021, 2023 гг. (табл. 5). Внедрение новых эффективных препаратов, оптимизация лечения повлияли на важнейшие показатели работы отделения, в частности, привели к снижению такого показателя, как средний койко-день по всем нозологическим единицам и в целом по отделению с 19,9 в 1998 г. до 11,8, 9,9 и 11,4 в 2018, 2021 и 2023 гг. соответственно.

Заключение
Таким образом, за минувшую четверть века мы видим существенные сдвиги в нозологической структуре госпитализированных больных ревматологического профиля, отражающие тенденции, связанные с изменением окружающей социально-эпидемиологической ситуации и с переменами в организации ревматологической помощи. В ревматологическое отделение практически не поступают больные с острой ревматической лихорадкой и хронической ревматической болезнью сердца; резко сократилась госпитализация больных ОА, в меньшей мере — больных РА, значительно выросла доля больных с диффузными заболеваниями соединительной ткани, СпА и васкулитами. В свою очередь изменилась и нозологическая структура внутри этих групп: больные РеА стали редкостью, преобладают больные АС и особенно ПсА, увеличилась доля пациентов с болезнью Шегрена, АНЦА-васкулитами. Появились ранее не диагностировавшиеся недифференцированные формы артритов, соединительнотканных заболеваний, что позволяет допустить появление по крайней мере части из них вследствие инфицирования SARS-CoV-2 в период пандемии. За минувшую четверть века мы стали свидетелями появления новых методов диагностики, высокотехнологичных методов лечения в ревматологии, которые не только повлияли на сложившуюся в конце века ситуацию, но и стали предметом изучения и внедрения в другие области медицины, примером чего может служить использование достижений ревматологии в борьбе с коронавирусной инфекцией во время пандемии. По-видимому, определенную роль в развитии научной и практической ревматологии сыграло то, что первое десятилетие нового века, объявленное ВОЗ «Декадой болезней костей и суставов», привлекло большое внимание к проблеме РЗ. Наша региональная ситуация — отражение сложившейся картины в целом. Безусловно, в каждом регионе есть свои эпидемиологические и организационные нюансы, влияющие в том числе и на оказание специализированной стационарной помощи больным с РЗ, при этом обмен опытом будет полезен для ревматологов и организаторов здравоохранения.
Информация с rmj.ru





