Содержание статьи
Новые возможности терапии сочетанной генитальной вирусной инфекции
Ю. Н. Перламутров, доктор медицинских наук, профессор
Н. И. Чернова, кандидат медицинских наук, доцент
ГБОУ ВПО МГМСУ им. А. И. Евдокимова Минздравсоцразвития России, Москва
Актуальность проблемы сочетанной вирусной инфекции гениталий обусловлена чрезвычайно широким распространением. По данным ВОЗ в настоящее время большая часть сексуально активного населения инфицированы вирусами простого герпеса (ВПГ) и одним или более типами вирусов папилломы человека (ВПЧ), причем наблюдается выраженная тенденция к их неуклонному росту во всех возрастных группах [1]. Обострения генитального герпеса способствуют снижению системного и локального иммунитета, развитию хронических воспалительных заболеваний мочеполовой системы и как следствие прогрессированию папилломавирусной инфекции [3–6]. Кроме того, доказана роль герпетической инфекции в ускорении интеграции ВПЧ в геном клетки хозяина, что повышет риск онкопатологии полости рта, шейки матки, влагалища и прямой кишки [7]. Кроме того, частые рецидивы вирусных инфекций нарушают нормальную половую жизнь, нередко препятствуют созданию семьи, планированию беременности, приводя к неврастеническим и депрессивным состояниям [2, 3]. В связи с этим проблема терапии пациентов с генитальными вирусными инфекциями чрезвычайно актуальна. В течение многих лет ведутся поиски природных и синтетических соединений, которые могут оказывать противовирусное действие, с одновременной стимуляцией факторов специфической и неспецифической защиты организма [8]. Данным требованиям отвечает препарат природного происхождения — Ферровир, действующим веществом которого является дезоксирибонуклеонат натрия в комплексе с железом. Препарат активизирует противовирусный, противогрибковый и противомикробный иммунитет, воздействуя на клеточное и гуморальное звено иммунитета, способствует торможению репликации ДНК- и РНК-содержащих вирусов.
Целью настоящего исследования являлось определение эффективности и безопасности Ферровира в лечении пациентов с сочетанной герпетической и папилломавирусной инфекцией гениталий.
Материалы и методы
В исследование вошли 40 больных в возрасте от 20 до 50 лет с клиническими проявлениями герпетической и папилломавирусной инфекции гениталий.
Диагностика папилломавирусной и герпетической инфекций проводилась на основании:
- оценки субъективных и объективных симптомов заболевания;
- обнаружения ДНК ВПЧ и ВПГ при лабораторных исследованиях.
Визуальное исследование
Осмотр кожного покрова и видимых слизистых оболочек гениталий, перианальной области проводился при помощи лампы-лупы. Изучался характер высыпаний, их количество и локализация.
Лабораторные исследования
Верификация диагноза генитальной герпетической и папилломавирусной инфекции проводилась на основании генодиагностического исследования PCR real time (полимеразная цепная реакция в реальном времени) с определением вирусной нагрузки и типированием ДНК ВПЧ и ВПГ. Исследованию подвергался клинический материал с кожи и слизистых гениталий.
Всем пациентам проведено комплексное клинико-микробиологическое обследование, включающее микроскопическое исследование клинического материала, бактериологическое исследование патогенных и условно-патогенных микроорганизмов (с их количественным определением).
Исследованию подвергался клинический материал из уретры, влагалища, цервикального канала.
У всех больных изучались основные показатели интерферонового статуса. Исследованию подвергалась кровь из кубитальной вены до и через месяц после лечения.
Кратность обследования
На протяжении исследования проводилось 5 визитов, включающих: осмотр кожи и слизистых гениталий во время лечения (2 раза), далее через 10, 30 и 60 дней после лечения с лабораторным контролем (1-й, 10-й, 30-й день лечения).
Результаты
Средний возраст пациентов, принявших участие в исследовании, был 25 ± 3,5 лет. Давность рецидивов генитального герпеса 36 ± 8,5 месяца. Течение заболевания было типичным — сгруппированные везикулы на гиперемированном отечном основании, с локализацией в области больших половых губ, промежности у женщин, лобка, головки полового члена и крайней плоти у мужчин, сопровождавшихся зудом, жжением и покалыванием в области высыпаний, средней степени тяжести. При осмотре кожи и слизистых гениталий у всех больных отмечались клинические проявления папилломавирусной инфекции. Их визуальная характеристика позволила выделить остроконечные, папиллярные, папуловидные кондиломы, которые имели различную величину. Наиболее часто очаги папилломавирусной инфекции выявлялись у женщин в области влагалища, вульвы, наружного отверстия уретры, у мужчин — крайней плоти, венечной борозды, уздечки. Впервые подобные высыпания зафиксированы у 14 человек, 26 пациентам проводилась деструкция новообразований при помощи химических, хирургических методов. При осмотре в зеркалах 33 женщин, принявших участие в исследование, фиксировали увеличенное количество выделений; умеренную гиперемию и инфильтрацию слизистой влагалища и вульвы у всех больных, цервицит у 27.
Больные были разделены на две группы. В 1-й группе пациенты получали терапию препаратом Ферровир по 5 мл (15 мг/мл) раствора для внутримышечного введения 1 раз в сутки в течение 10 дней, 10 инъекций на курс. Во 2-й группе Ферровир назначали в режиме по 5 мл (15 мг/мл) раствора для внутримышечного введения 2 раза в сутки (утром и вечером) в течение 10 дней, 20 инъекций на курс.
В 1-ю группу вошли 12 женщин и 8 мужчин. На фоне применения Ферровира купирование зуда в области гениталий через 1–2 дня отмечали 11 больных, на 3–4 день лечения — 8 пациентов. Продолжительность рецидива уменьшилась в 1,5 раза по сравнению с данными до лечения (6,02 ± 0,4 дня) и составила в среднем 3,8 ± 0,51 дня (р < 0,05) у 15 человек. Применение Ферровира не повлияло на длительность рецидива у 5 пациентов. При исследовании соскобов из урогенитального тракта при помощи PCR real time через 3–4 недели после лечения ДНК ВПГ не обнаруживалась у 15 человек.
Таким образом, исходя из полученных данных, можно отметить, что эффективное лечение рецидива генитального герпеса Ферровиром наблюдалось у 75% исследуемых.
При проведении исследования было констатировано влияние Ферровира на течение папилломавирусной инфекции. В соскобах из урогенитального тракта при помощи PCR real time ДНК ВПЧ высокого канцерогенного риска в клинически значимом титре были обнаружены у всех больных, в количестве от 1 до 5 типов, низкого канцерогенного риска у 11. При визуальном осмотре количество элементов варьировало от 5 до 44. На 10-й день лечения Ферровиром констатировано уменьшение количества кондилом у 11 человек. Прогрессирования папилломавирусной инфекции не отмечалось ни в одном случае.
После удаления новообразований при помощи хирургического лазера на 21–23 день лечения ДНК ВПЧ не определялась у 15 больных.
Неспецифическую противовирусную защиту организма обеспечивает система интерферонов, которые выделяются в отдельную группу семейства цитокинов. Интерфероны — гетерогенный класс белков, продуцируемых в ответ на воздействие различных агентов (индукторов) и способных подавлять репродукцию широкого круга микроорганизмов.
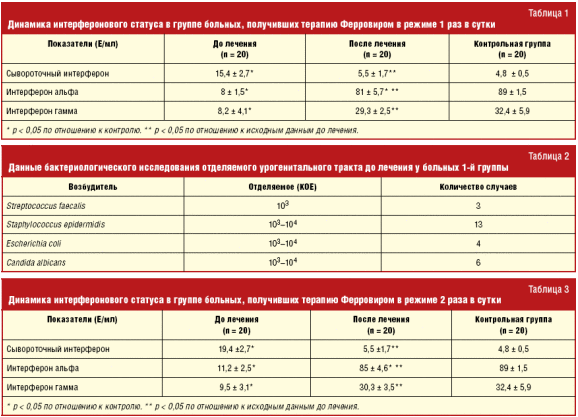
После проведения терапии Ферровиром выявлены достоверные изменения основных показателей системы интерферона (табл. 1).
Уровень сывороточного интерферона снизился до 5,5 ± 1,7 МЕ/мл, что достоверно отличалось от исходных показателей (15,4 ± 2,7 МЕ/мл) и соответствовало уровню интерферона лиц контрольной группы. Статистически значимые изменения отмечались и в продукции интерферона альфа и интерферона гамма. Значительно возросла продукция интерферона альфа по сравнению с исходными значениями. Уровень интерферона гамма стал достоверно выше исходных значений до лечения 30,3 ± 3,5 МЕ/мл и сравним с показателями лиц контрольной группы.
При бактериоскопическом и микроскопическом исследованиях отделяемого урогенитального тракта до лечения у всех больных первой группы зарегистрирована обильная грамвариабельная коккобацилярная флора, лейкоцитарная реакция в пределах 2–3–4 в поле зрения в отделяемом уретры, 10–15–25 в поле зрения во влагалище и от 20 до 50 цервикального канала. Данные бактериологического исследования представлены в табл. 2.
При микроскопическом исследовании материала через 10 дней после лечения нормализация микрофлоры отмечалась у 14 пациентов.
При бактериологическом обследовании более высокие количественные показатели для таких возбудителей, как Streptococcus fаecalis, Staphylococcus epidermidis, Candida albicans, отмечены у 6 больных 1-й группы.
Во 2-ю группу вошли 11 женщин и 9 мужчин. На фоне применения Ферровира в режиме 5 мл внутримышечно 2 раза в сутки купирование зуда и жжения на 2-й день отмечали 9 больных, на 3–4 день лечения — 7 пациентов. Продолжительность рецидива уменьшилась в 1,5–2 раза по сравнению с данными до лечения (6,47 ± 0,5 дня) и составила в среднем 3,2 ± 0,43 дня (р < 0,05). Применение Ферровира не повлияло на длительность клинических проявлений у 4 пациентов. При исследовании соскобов через 3–4 недели после лечения ДНК ВПГ не обнаруживалась у 16 человек.
Таким образом, терапия Ферровиром рецидивирующего генитального герпеса в режиме 2 раза в сутки была эффективной в 80% случаев.
На фоне применения препарата зарегистрирована положительная динамика в течении папилломавирусной инфекции. До лечения при изучении соскобов урогенитального тракта при помощи PCR real time ДНК ВПЧ высокого канцерогенного риска в клинически значимом титре были обнаружены у всех больных, низкого канцерогенного риска у 8, количество элементов варьировало от 7 до 54. В период наблюдения уменьшение клинических проявлений зарегистрировано у 14 человек, появления новых элементов не отмечали. Все больным была проведена деструкция новообразований при помощи хирургического лазера. Через 3–4 недели после удаления изучали соскобы из урогенитального тракта с целью определения ДНК ВПЧ, результаты были отрицательными у 16 больных.
При сравнении показателей интерферонового статуса до и после лечения отмечали регулирующее действие Ферровира, основанное на коррекции нарушенной продукции интерферонов.
Как видно из табл. 3, после применения Ферровира в режиме 2 инъекции в сутки снизился уровень сывороточного интерферона до 5,5 ± 1,7 МЕ/мл, что достоверно отличалось от исходных показателей (19,4 ± 2,7 МЕ/мл) и соответствовало уровню интерферона лиц контрольной группы. Статистически значимые изменения отмечались и в продукции интерферона альфа и интерферона гамма. Значительно возросла продукция интерферона альфа по сравнению с исходными значениями — 85 ± 4,6 МЕ/мл. Уровень интерферона гамма стал достоверно выше исходных значений до лечения 30,3 ± 3,5 МЕ/мл и сравним с показателями лиц контрольной группы.
При бактериоскопическом и микроскопическом исследованиях отделяемого урогенитального тракта до лечения у всех больных второй группы зарегистрирована обильная грамвариабельная коккобацилярная флора, лейкоцитарная реакция несколько превышала нормальные значения.
Бактериологическое исследование, проведенное всем наблюдавшимся больным, позволило подтвердить данные микроскопии.
В микроскопическом исследовании, проведенном через 10 дней после лечения, нормализация показателей отмечалась у 17 пациентов. При бактериологическом обследовании более высокие количественные показатели для таких возбудителей, как S. fаecalis, S. epidermidis, C. albicans, отмечены у 3 больных.
Переносимость терапии была хорошей у всех больных, аллергических реакций не зарегистрировано. У 4 человек отмечалась гиперемия в области введения препарата, у 7 пациентов — болезненность в момент инъекции. Перечисленные жалобы не являлись ярко выраженными, носили транзиторный характер, не нарушали работоспособность и общее самочувствие, что не явились поводом для отмены препарата.
Заключение
Результаты исследования демонстрируют регулирующее действие Ферровира, основанное на коррекции нарушенной продукции интерферонов и устранении агрессивного влияния вирусов на окружающие клетки. Показано, что препарат действует на патогенетические звенья развития вирусной инфекции, обеспечивая снижение вирусной нагрузки. Этот факт свидетельствует о целесообразности назначения Ферровира, в дополнение к традиционному этиосимптоматическому лечению. В комплексной терапии сочетанной герпетической и папилломавирусной инфекции гениталий наиболее комплаентно назначение Ферровира в виде внутримышечных инъекций 1 раз в сутки в течение 10 дней.
Литература
- Прилепская В. Н. Генитальные инфекции и патология шейки матки. Омск, 2004. С. 34–39.
- Konda K. A., Klausner J. D. The epidemiology of Herpes simplex virus type 2 infection in low-income urban populations in coastal Peru // Sex Transm Dis. 2005; 9: 534–541.
- Ramaswamy M., McDonald C. et al. The epidemiology of genital infection with Herpes simplex virus types 1 and 2 in genitourinary medicine attendees in inner London // Sex Transm Infect. 2005; 81 (4): 306–308.
- Гайдуков С. Н., Атласов В. О., Измайлов Р. М. и др. Патология шейки матки и эндометрия. Учебное пособие. СПб: Издание ГПМА, 2004. С. 44.
- Роговская С. И. Бактериальный вагиноз у женщин с папилломавирусной инфекцией гениталий // Гинекология. 2001.
- Рудакова Е. Б. Влагалищный дисбиоз и патология шейки матки // Патология шейки матки. Генитальные инфекции, 2006, № 1, с. 52–55.
- Киселев В. И., Киселев О. И. Вирусы папиломы человека в развитии рака шейки матки. СПб-М., 2003. С. 23.
- Ершов Ф. И. Система интерферона в норме и при патологии. М.: Медицина, 1996. С. 206.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







