Низкая степень плоскоклеточного интраэпителиального поражения шейки матки: терапевтические и патогенетические возможности активированной глицирризиновой кислоты
Введение
Папилломавирусная инфекция (ПВИ) на современном этапе развития общества является одной из самых распространенных инфекций, передающихся половым путем (количество инфицированных вирусом папилломы человека (ВПЧ) в мире за последнее 10 лет возросло более чем в 10 раз), с высокой контагиозностью [1–3]. Особенную актуальность проблемы распространенности ВПЧ среди населения обусловливает его способность к малигнизации пораженных им тканей, особенно это касается рака шейки матки (РШМ), являющегося 4-м наиболее распространенным видом рака у женщин
и 7-м в целом [2]. Отсутствие эффективных стратегий профилактики, скрининга и лечения предраковых поражений шейки матки — плоскоклеточных интраэпителиальных поражений (squamous intraepithelial lesion — SIL) является основной причиной высокого уровня заболеваемости РШМ [4]. Инфекция ВПЧ высокого канцерогенного риска (ВКР) (в основном 16 и 18 типов) является основным фактором риска развития РШМ, при этом онкогены ВПЧ Е6 и Е7, содержащиеся в этих типах ВПЧ, необходимы для канцерогенеза и инвазии [5, 6]. При нарушении функций ключевых клеточных опухолевых супрессоров (белков p53 и pRb) эти вирусные онкопротеины иммортализируют и трансформируют клетки человека, создавая основу для прогрессирования рака [7]. В связи с этим изучение факторов патогенеза цервикальных ВПЧ-поражений представляет особую актуальность.
Также в настоящее время крайне актуальным считается вопрос лечения ВПЧ-ассоциированных заболеваний шейки матки в зависимости от степени тяжести, тем более что этиотропной терапии данного заболевания не существует. Поиск новых химиопрофилактических и противоопухолевых средств, более эффективных, но менее токсичных, вызвал большой интерес к фитохимическим соединениям. Глицирризиновая кислота (глицирризин), получаемая из солодки, обладает противовоспалительными, антиоксидантными, противовирусными и противоопухолевыми свойствами [7, 8]. Было продемонстрировано, что метаболит глицирризина — 18β-глицирретиновая кислота вызывает апоптоз в раковых клетках шейки матки SiHa [9]. В исследовании A. Farooqui et al. (2017) систематизировано влияние глицирризина на линию раковых клеток шейки матки HeLa [10]. Было показано, что воздействие глицирризина снижало жизнеспособность раковых клеток шейки матки, с изменением их формы, уменьшением размера и отслоением от поверхности с образованием кластеров, т. е. глицирризин вызывал гибель клеток посредством апоптоза, что подтверждает аналогичные результаты других авторов [11]. Также A. Farooqui et al. подтверждено, что дозозависимая активация каспазы-8, -9 и -3 в клетках HeLa, обработанных глицирризином, может вызывать апоптотическую гибель клеток, действуя через рецептор на поверхности клетки, а также через митохондриальный путь [10]. Кроме того, было показано, что глицирризин индуцирует избыточную генерацию активных форм кислорода (АФК) в раковых клетках шейки матки, что ведет к дисфункции митохондрий и последующему апоптозу и остановке прогрессирования клеточного цикла клеток HeLa в фазе G0/G1 путем блокирования перехода из фазы G0/G1 в фазу S [10]. Таким образом, результаты проведенных независимых исследований позволили установить, что глицирризиновая кислота проявляет in vitro антипролиферативные и апоптотические свойства в отношении раковых клеток шейки матки, вызывая разрушение митохондриального мембранного потенциала, увеличение генерации АФК, активацию каспаз как внешнего, так и внутреннего пути гибели клеток, а также индукцию остановки клеточного цикла в фазе G0/G1.
Исходя из вышеизложенного, целью исследования явилась оценка эффективности локальной терапии активированной глицирризиновой кислотой (АГК) (в форме 0,1% спрея) у пациенток с низкой степенью плоскоклеточного интраэпителиального поражения шейки матки (low-grade squamous intraepithelial lesion — LSIL).
Материал и методы
Проведено сравнительное открытое исследование результатов лечения 76 женщин с низкой степенью плоскоклеточного интраэпителиального поражения 19–42 лет (средний возраст — 26,1±4,1 года) и 30 условно здоровых женщин, проходивших плановый медосмотр (группа цитобиохимического контроля) (средний возраст — 25,8±2,4 года). База исследований — кафедра акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России, женские консультации г. Краснодара. Диагноз LSIL устанавливался на основании клинико-микробиологического, кольпоскопического и цитологического обследования (жидкостная цитология — Pap smear test). Диагностику инфицированности различными типами ВПЧ проводили с помощью ПЦР (тест-система «АмплиСенс® ВПЧ ВКР генотип-титр-FL», Россия), позволяющей выявлять и генотипировать ВПЧ высокого канцерогенного риска: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59 типов с детекцией в режиме реального времени.
Окислительные процессы в слизистой шейки матки (определение NO, реактивных форм кислорода (супероксидрадикалы, O2—) и липидов (пероксидрадикалы, LOO—)) определяли методом электронного парамагнитного резонанса (ЭПР) (радиоспектрометр «РЭ-1307», Россия). Цитохимическую активность ферментов макрофагов слизистой шейки матки (кислой фосфатазы (КФ), миелопероксидазы (МПО) и неспецифической эстеразы (НЭ)) регистрировали по среднему цитохимическому показателю.
Пациенткам (n=76), которым на основании клинико-микробиологического исследования был поставлен диагноз LSIL, проведена топическая терапия препаратом глицирризиновой кислоты в виде вагинального 0,1% спрея, который применялся 5 р./сут интравагинально в течение 14 дней 1 раз в 6 мес. в течение 1 года. Клинико-микробиологическую эффективность лечения оценивали через 30 дней и 1 год после окончания терапии. Исследование про-/антиоксидантной системы и цитохимии макрофагов проводили через 10 дней и 1 год после окончания терапии глицирризиновой кислотой.
Полученные результаты обработаны методом вариационной статистики (критерий Фишера (F) для оценки непараметрических показателей групп малых выборок и Стьюдента (t) для независимых групп), с использованием программы Statistica 6,0.
Результаты и обсуждение
Выявлено, что основными вирусами, ответственными за патологию шейки матки в виде LSIL у 76 женщин, являются ВПЧ высокого канцерогенного риска (89,6%) (рис. 1). Из них основными типами ВПЧ являются 18 (51,3%) и 16 (27,7%). Также эпидемиологическое значение имеют другие типы высокоонкогенных вирусов, в частности 31 (5,3%) и 51 (5,3%).
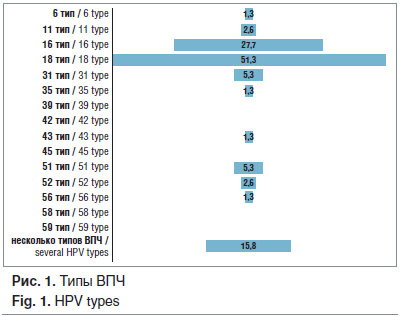
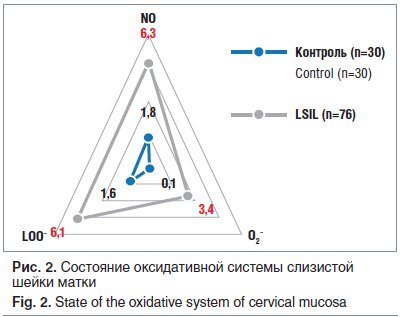
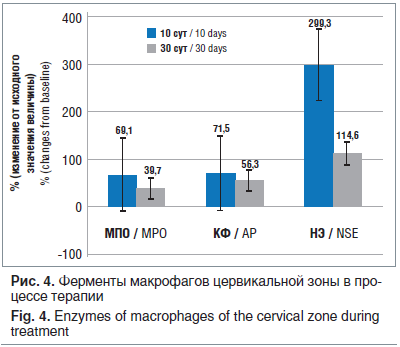
Патогенез любого паранеопластического процесса подразумевает изменения молекулярных и субклеточных механизмов: изменение транспорта электронов, активация образования генераторов свободных форм кислорода и пероксидрадикалов, снижение антиоксидантной активности клеток. Исследование оксидативного статуса цервикальной зоны показало, что при LSIL интенсивность ЭПР-сигнала пероксидрадикалов (LOO—) повышается в 3,8 раза, начинают регистрироваться супероксидрадикалы (О2—), практически отсутствующие в контрольной группе, возрастает в 3,5 раза интенсивность сигнала оксида азота (рис. 2). Что доказывает факт активизации образования свободнорадикальных форм кислорода с интенсификацией перекисного окисления липидов в эпителиоцитах шейки матки при реализации ПВИ, которые становятся факторами, нарушающими структуры клеточных мембран, метаболических процессов, и играют значительную роль в патогенезе перехода процесса в хроническую форму, и, возможно, в малигнизации процесса.
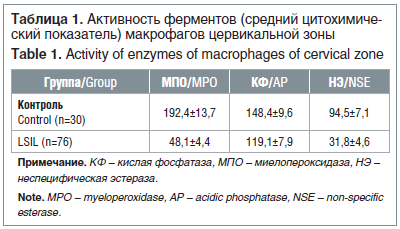
Неоспоримым фактом является то, что МПО в присутствии H2O2 имеет выраженные бактерицидные и противовирусные свойства, влияя на клетки, пораженные ВПЧ, таким образом, по количеству пероксидазоположительных макрофагов косвенно можно судить о микробицидной и цитотоксической активности слизистых, в т. ч. при специфическом воспалении, вызванном ВПЧ-агрессией.
Активность МПО, отражающей один из компонентов кислородзависимой бактерицидной системы макрофагов цервикальной зоны, при LSIL была в среднем в 3,9 раза ниже, а НЭ, отражающей субактивационные свойства макрофагов, — в 3,0 раза ниже (p<0,05), чем у пациенток группы контроля (табл. 1). Одним из специфических маркеров лизосом макрофагов является КФ, также отмечается корреляционная зависимость между активностью лизосомальной КФ и функциональной активностью макрофагов. При ПВИ сенсибилизированные лимфоциты в присутствии антигена могут выделять лимфокины, активирующие макрофаги, в результате чего изменяется их ферментативная активность, кроме того, сами папилломавирусы могут оказывать прямые иммунодепрессивные либо активирующие эффекты, изменяя функциональную активность фагоцитов. При этом активность КФ при LSIL практически не отличалась от соответствующего параметра контроля, тогда как выявляемая активность НЭ, коррелирующая с субактивационными характеристиками макрофагов, находилась на достоверно (p<0,05) более низком уровне.
Клиническая и цитобиохимическая эффективность
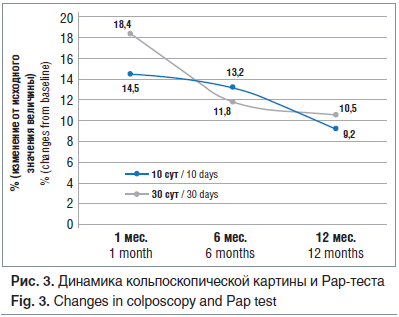
При оценке динамики кольпоскопической картины у женщин с LSIL выявлено, что через 30 дней после проведения терапии АГК картина, соответствующая норме, зарегистрирована у 85,5% пациенток.
В течение годичного мониторинга с профилактическим лечением АГК количество женщин с нормальной кольпоскопической картиной возросло до 90,8% (рис. 3). Аналогичная динамика выявлена и при проведении жидкостной цитологии (Pap smear test) в данные сроки: отсутствие койлоцитарной атипии в мазках через 1 мес. после окончания лечения выявлено у 81,6% пациенток, а в течение годичного мониторинга таких пациенток стало 89,5% (см. рис. 3).
В процессе терапии женщин с LSIL АГК были зарегистрированы изменения цервикальных окислительных процессов — интенсивность ЭПР сигнала LOO— снизилась в 3,8 раза (p<0,005), NO — в 2,4 раза, а О2— практически перестали регистрироваться (табл. 2). Через 1 год после окончания лечения не было определено существенной динамики по всем параметрам.
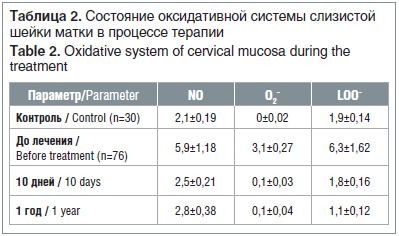
При лечении АГК (10-е и 30-е сут после окончания терапии) зарегистрировано достоверное повышение активности МПО в среднем на 54,4±5,9% (p<0,01), КФ — в среднем на 63,9±6,4% (р<0,01) и НЭ — в среднем более чем в 2 раза (p<0,001) (рис. 4).
Заключение
При анализе результатов исследований выявлено, что при поражении слизистой шейки матки ВПЧ активизируются оксидативные локальные системы, приводящие к нарушению молекулярных, субклеточных и клеточных структур, что играет существенную роль в патогенезе цервикальной неоплазии и в дальнейшем может инициировать малигнизацию пораженных тканей. Локальное применение АГК способствует нормализации активности ферментной системы макрофагов и оксидативных процессов цервикальной зоны, что в дальнейшем ведет к элиминации ВПЧ-пораженных клеток и деактивации неопластических процессов.
Сведения об авторах:
1Боровиков Игорь Олегович — д.м.н., доцент кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0001-8576-1359;
1Куценко Ирина Игоревна — д.м.н., заведующая кафедрой акушерства, гинекологии и перинатологии, ORCID iD 0000-0003-0938-8286;
1Горринг Хава Израиловна — аспирант кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0002-4039-5700;
1Рубинина Эдита Рубеновна — аспирант кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0002-7599-2257;
1,2Булгакова Вера Павловна — аспирант кафедры акушерства, гинекологии и перинатологии, ORCID iD 0000-0002-8388-8644.
1ФГБОУ ВО КубГМУ Минздрава России, 350063, Россия, г. Краснодар, ул. Митрофана Седина, д. 4.
2ООО «Клиника Екатерининская». 350063, Россия, г. Краснодар, ул. Героя Яцкова, д. 2/2.
Контактная информация: Боровиков Игорь Олегович, e-mail: bio2302@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 16.07.2019.
About the authors:
1Igor O. Borovikov — MD, PhD, assistant professor of the Department of Obstetrics, Gynecology, and Perinatology, ORCID iD 0000-0001-8576-1359;
1Irina I. Kutsenko — MD, PhD, Head of the Department of Obstetrics, Gynecology, and Perinatology, ORCID iD 0000-0003-0938-8286;
1Hava I. Gorring — MD, postgraduate student of the Department of Obstetrics, Gynecology, and Perinatology, ORCID iD 0000-0002-4039-5700;
1Edita R. Rubinina — MD, postgraduate student of the Department of Obstetrics, Gynecology, and Perinatology, ORCID iD 0000-0002-7599-2257;
1,2Vera P. Bulgakova — MD, postgraduate student of the Department of Obstetrics, Gynecology, and Perinatology, ORCID iD 0000-0002-8388-8644.
1Kuban State Medical University. 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation.
2LLC “Clinic Ekaterininskaya”. 2/2, Hero I.V. Yatskov str., Krasnodar, 350063, Russian Federation.
Contact information: Igor O. Borovikov, e-mail: bio2302@mail.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 16.07.2019.
Информация с rmj.ru





