Содержание статьи
- 1 Введение
- 2 Особенности применения НПВП в клинической практике
- 3 Риск развития нежелательных лекарственных реакций при использовании НПВП
- 4 Комбинация ибупрофен + парацетамол: особенности фармакокинетики, аспекты эффективности и безопасности применения
- 5 Безопасность применения комбинации ибупрофена и парацетамола
- 6 Заключение
Введение
Нестероидные противовоспалительные препараты (НПВП) относятся к наиболее часто используемым лекарственным средствам как среди рецептурных препаратов, так и среди средств безрецептурного отпуска, т. е. применяемых самими пациентами для самолечения без назначения врачом. Частота использования НПВП в клинической практике обусловлена спектром их фармакологических эффектов: обезболивающим, противовоспалительным, жаропонижающим, антиагрегационным (ацетилсалициловая кислота). Однако широкий спектр терапевтического действия и высокая клиническая эффективность имеют и обратную сторону: НПВП входят в группу лекарственных препаратов, наиболее часто вызывающих нежелательные лекарственные реакции (НЛР), связанные с токсическим действием, гиперчувствительностью, лекарственными и пищевыми взаимодействиями. Поэтому перед клиницистом стоит непростая задача: подбор НПВП для конкретного пациента.
Выбор лекарственного препарата осуществляется по определенному алгоритму.
Определение показания к применению лекарственного препарата, которое обусловлено клиническим диагнозом пациента: основное заболевание, наличие коморбидной патологии, осложнения, сопутствующие заболевания. Большое значение имеет оценка факторов риска развития осложнений лекарственной терапии: аллергологический анамнез; ранее выявлявшиеся симптомы непереносимости лекарственных препаратов; сопутствующая терапия, в т. ч. применение фитопрепаратов, витаминных препаратов, безрецептурных средств, БАДов; диетические пристрастия пациента, злоупотребление алкоголем, курение.
Определив показание («проблему» пациента), врач выбирает группу лекарственных препаратов и конкретный лекарственный препарат внутри этой группы, исходя из критериев эффективности, безопасности, стоимости и удобства применения.
Определившись с выбором конкретного лекарственного препарата, врач выбирает режим применения препарата: дозу, частоту применения, длительность терапии.
Врач объясняет пациенту в доступной форме, что с ним и почему появились беспокоящие его симптомы, предоставляет информацию о возможных немедикаментозных методах коррекции патологического состояния, объясняет пациенту, почему выбран этот лекарственный препарат и на что должен обращать внимание пациент при использовании данного препарата, при появлении каких симптомов он должен обратиться незамедлительно к врачу и даже прекратить прием препарата. Почти 50% случаев неэффективности фармакотерапии обусловлено низкой комплаентностью пациентов, поэтому так важно достижение сотрудничества с пациентом, соблюдение им регламента лекарственной терапии.
Сам врач в процессе лечения оценивает эффективность и безопасность проводимой фармакотерапии, решает вопрос о показаниях к назначению протективной терапии, прекращению/пролонгированию лечения при достижении поставленной цели или смене препарата при его неэффективности.
Выполнение этого алгоритма возможно только в случае, если врач хорошо знает показания к применению и клинико-фармакологические свойства выбранного лекарственного препарата.
Особенности применения НПВП в клинической практике
Как уже указывалось выше, основные фармакодинамические эффекты НПВП: анальгетический, противовоспалительный, жаропонижающий. Таким образом, препараты этой группы применяются при заболеваниях костно-мышечной системы, суставов, послеоперационной боли, головной боли напряжения, мигрени, дисменореи, почечной и печеночной коликах, синдроме хронической боли, простудных заболеваниях, лихорадке.
Эффективность лекарственного препарата определяется рядом факторов: механизмом действия, биодоступностью (процент от принятой дозы, поступивший в системный кровоток), особенностями метаболизма, концентрацией в крови и тканях организма, скоростью развития терапевтического эффекта и длительностью его удержания. Безопасность применения лекарственного препарата зависит от механизма действия и особенностей метаболизма, выведения препарата, его способности вступать в лекарственные взаимодействия.
Механизм действия НПВП обусловлен их способностью ингибировать фермент циклооксигеназу-2 (ЦОГ-2) в очаге воспаления (рис. 1). Именно ЦОГ-2 принимает участие в образовании провоспалительных простагландинов, которые потенцируют активность медиаторов воспаления (гистамина, серотонина, брадикинина), активирующих болевые рецепторы; участвуют в управлении активностью центра тепловой регуляции, способствуют клеточной пролиферации, мутагенезу и деструкции [1, 2]. При этом НПВП блокируют и циклооксигеназу-1 (ЦОГ-1), которая присутствует во всех органах и обеспечивает нормальные физиологические процессы (синтез защитной слизи желудка, некоторые этапы кроветворения, фильтрации и реабсорбции в почках). Существует также и «конститутивная» ЦОГ-2, которая в высоких концентрациях обнаруживается в головном мозге, костях, органах женской половой системы, почках, обеспечивая их нормальное функционирование.
![Рис. 1. Циклооксигеназный континуум [2] Рис. 1. Циклооксигеназный континуум [2]](https://medblog.su/wp-content/uploads/2020/04/nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
Дополнительными механизмами противовоспалительного действия НПВП являются:
ингибирование синтеза активности интерлейкина-1;
подавление функции нейтрофилов и взаимодействия лейкоцитов с эндотелием сосудов;
угнетение активации NF-kB (фактора транскрипции), регулирующего синтез «провоспалительных» медиаторов;
активация PPARs (peroxisoma proliferator activated receptors).
Снижение синтеза «полезных» простаноидов лежит в основе механизмов развития НЛР при использовании НПВП.
НПВП можно разделить на две группы: неселективные ингибиторы ЦОГ (ибупрофен, диклофенак, напроксен и т. д.) и селективные, ингибирующие преимущественно ЦОГ-2 (мелоксикам, нимесулид, коксибы). При использовании препаратов второй группы значительно реже развиваются НПВП-гастропатии и НПВП-энтеропатии, желудочно-кишечные кровотечения, но возрастает риск осложнений со стороны сердечно-сосудистой системы [1]. Эффект НПВП возрастает с увеличением дозы препарата, при этом при максимальных дозах избирательность действия селективных НПВП снижается (рис. 2) [3].
![Рис. 2. Зависимость между дозой диклофенака (Д), напроксена (Нап) и эторикоксиба (Это) и величиной эффекта при остеоартрите [3] Рис. 2. Зависимость между дозой диклофенака (Д), напроксена (Нап) и эторикоксиба (Это) и величиной эффекта при остеоартрите [3]](https://medblog.su/wp-content/uploads/2020/04/1586897670_495_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
Следует также отметить, что при использовании средних и высоких доз различных НПВП их эффективность сопоставима, что вытекает из результатов многоцентровых клинических исследований, в которых сравнивалось анальгетическое и противовоспалительное действие НПВП при травмах, операциях и заболеваниях опорно-двигательного аппарата. Так, при метаанализе данных 29 рандомизированных клинических исследований (n=18 000) оценивали эффективность различных НПВП при остеоартрите. Различия в выраженности снижения интенсивности боли (в миллиметрах визуальной аналоговой шкалы) между НПВП и плацебо составили: для напроксена 1000 мг/сут — 12,9 (95% доверительный интервал (ДИ) — 8,2–17,7), ибупрофена 2400 мг/сут — 9,0 (95% ДИ 5,0–13,1), диклофенака — 16,2 (95% ДИ 11,7–20,6), целекоксиба 200 мг — 14,7 (95% ДИ 12,1–17,3), эторикоксиба 30 мг — 14,2 (95% ДИ 12,6–16,8), эторикоксиба 60 мг — 16,2 (95% ДИ 12,7–19,8) [4].
Существует мнение, что внутривенное или внутримышечное введение лекарственного препарата обеспечивает более быстрый и выраженный терапевтический эффект, чем прием препарата внутрь. Однако это положение не подтверждается данными клинических исследований [5]. В систематическом обзоре 26 РКИ (n=2225) анализировали эффективность НПВП при парентеральном, ректальном, пероральном приеме. Показаниями для назначения НПВП были скелетно-мышечные заболевания, послеоперационная боль, дисменорея, почечная колика. Существенных различий в анальгетическом действии различных лекарственных форм НПВП не отмечено, за исключением почечной колики, при которой было показано достоверное преимущество внутривенного НПВП по сравнению с приемом внутрь [6].
Таким образом, можно сделать следующие выводы [1].
Все НПВП в адекватных противовоспалительных (средних и максимальных) дозах при длительном применении имеют равный обезболивающий потенциал (уровень доказательности 1a).
Эффективность НПВП зависит от дозы. Использование более высоких доз позволяет обеспечить более выраженное обезболивающее и противовоспалительное действие (уровень доказательности 1b).
Нет доказательств, что применение НПВП в виде инъекций или быстрорастворимых форм для приема внутрь имеет преимущество перед пероральными формами при проведении лечения более 1 дня (уровень доказательности 1b).
Риск развития нежелательных лекарственных реакций при использовании НПВП
Так как в терапевтических дозах эффективность НПВП сопоставима, то, выбирая НПВП для конкретного пациента, исходят из возможных рисков развития НЛР (табл. 1) [1]. Факторами риска развития НЛР при использовании НПВП являются: возраст старше 60 лет, избыточная масса тела, курение, язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе, венозные тромбозы и тромбоэмболии в анамнезе, ИБС, цереброваскулярная болезнь, периферический атеросклероз, артериальная гипертензия, нарушения липидного обмена, сахарный диабет, заболевания кишечника, печени, почек, крови, застойная сердечная недостаточность, хроническая алкогольная интоксикация, сочетанный прием лекарственных препаратов, взаимодействующих с НПВП, лактация. Для более дифференцированного выбора НПВП был предложен специальный алгоритм, который подразумевает назначение селективных НПВП пациентам с факторами риска развития осложнений со стороны ЖКТ и применение НПВП с менее выраженным токсическим действием в отношении сердечно-сосудистой системы у больных с высоким сердечно-сосудистым риском, а также назначение протективной терапии (табл. 2) [1].
![Таблица 1. Осложнения при приеме НПВП и их диагностика [1] Таблица 1. Осложнения при приеме НПВП и их диагностика [1]](https://medblog.su/wp-content/uploads/2020/04/1586897670_891_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
![Таблица 2. Алгоритм назначения НПВП [1] Таблица 2. Алгоритм назначения НПВП [1]](https://medblog.su/wp-content/uploads/2020/04/1586897670_231_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
Согласно российским рекомендациям по рациональному использованию НПВП:
основной метод профилактики развития НЛР при применении НПВП — учет факторов риска, их коррекция (при возможности) и назначение НПВП с более благоприятным профилем желудочно-кишечной (градация рекомендации А) и сердечно-сосудистой безопасности (градация рекомендации В);
дополнительным методом профилактики осложнений со стороны верхних отделов ЖКТ является назначение ингибиторов протонной помпы (ИПП) (градация рекомендации A);
дополнительным методом профилактики осложнений со стороны верхних отделов ЖКТ, тонкой и толстой кишки может быть назначение ребамипида (градация рекомендации В);
не существует эффективных медикаментозных методов нефро- и гепатопротекции для снижения риска НПВП-ассоциированных осложнений.
Комбинация ибупрофен + парацетамол: особенности фармакокинетики, аспекты эффективности и безопасности применения
На российском рынке широко распространены НПВП, содержащие ибупрофен, который был синтезирован в 1961 г. и до настоящего времени считается «золотым стандартом» анальгетика [6]. Он также является наиболее безопасным неселективным НПВП в отношении развития НПВП-гастропатий. Ибупрофен разрешен для безрецептурного применения и доступен в виде различных лекарственных форм. Так, в линейке препаратов под торговым знаком Нурофен® представлены таблетки, покрытые оболочкой; капсулы, содержащие жидкое действующее вещество, которое всасывается и достигает максимальной концентрации в крови быстрее, чем при приеме таблетированной формы. Выпускается ибупрофен в лекарственной форме суспензии, не содержащей сахара и спирта, для приема внутрь для детей в возрасте от 3 мес. до 12 лет.
Для ибупрофена, как и для большинства анальгетиков, быстрота и полнота наступления обезболивающего эффекта определяются временем достижения максимальной концентрации в плазме крови после перорального приема. Это значит, что лекарственные формы, обеспечивающие более быстрое всасывание, оказывают и более быстрый и выраженный терапевтический эффект. Ибупрофен содержится в составе лекарственных препаратов в виде слабой кислоты или солей. Известно, что соли, например натриевая соль ибупрофена, которая входит в состав ряда препаратов линейки Нурофен®, абсорбируются быстрее, чем ибупрофен в виде свободной кислоты. В исследовании P.V. Dewland et al. (2009) изучалась биодоступность ибупрофена после перорального введения двух его форм — кислотной и натриевой соли — здоровым добровольцам. Авторы установили, что скорость абсорбции натриевой соли ибупрофена, оцениваемая по времени достижения максимальной концентрации в плазме крови, значительно выше (т. е. он абсорбируется в 2 раза быстрее, чем кислотная форма), а сама концентрация его существенно больше. При этом не отмечено увеличение риска развития НЛР [7].
Для достижения быстрого наступления обезболивания целесообразно использовать лекарственные формы с более высокой скоростью абсорбции и, следовательно, более быстрым достижением максимальной концентрации в плазме. Moore et al. (2013) опубликовали систематический обзор, в котором было продемонстрировано значительное преимущество быстродействующих форм ибупрофена по сравнению со стандартными в обеспечении анальгетического эффекта. Авторы проанализировали результаты 30 клинических исследований с участием 1015 пациентов и наглядно показали, что при использовании быстродействующих форм ибупрофена максимальные концентрации в плазме крови достигаются в среднем за 50 мин, тогда как для стандартных форм — в пределах 90 мин. При этом анальгетический эффект не только наступает быстрее, но и сопровождается более выраженным обезболиванием в течение 6 ч. Выявлены строгие корреляции между более быстрой редукцией интенсивности боли в сроки 0–60 мин и более выраженным обезболиванием в пределах 0–6 ч. В целом эффективность быстродействующей формы ибупрофена в дозе 200 мг была такой же, как и стандартной его формы в дозе 400 мг, но при этом требовалось меньшее количество повторных прие-мов анальгетиков при сопоставимой безопасности фармакотерапии [8].
Препарат Нурофен® Интенсив является комбинацией ибупрофена 200 мг и парацетамола 500 мг, которые различаются по своему действию, что позволяет предположить, что при их комбинированном введении за счет особенностей механизмов действия двух составляющих анальгетический эффект суммируется. Ибупрофен является ингибитором ЦОГ-1 и ЦОГ-2; его обезболивающий эффект реализуется за счет ингибирующего действия на периферическом уровне, антипиретический — связан с центральным ингибированием синтеза простагландинов в гипоталамусе. Ибупрофен также ингибирует миграцию лейкоцитов в очаг воспаления и обратимо подавляет агрегацию тромбоцитов. Парацетамол является неселективным ингибитором ЦОГ-2, преимущественно в центральной нервной системе (ЦНС), стимулирует активность нисходящих путей серотонина, что приводит к купированию передачи болевого импульса в спинном мозге [9]; анальгетический эффект ацетаминофена связан с воздействием на каннабиноидную систему ЦНС [10–12].
Комбинация ибупрофен 200 мг + парацетамол 500 мг обладает более выраженным анальгетическим действием, чем монопрепараты ибупрофена и парацетамола в отдельности и даже комбинированные препараты, содержащие кодеин (рис. 3) [13]. Двойное слепое рандомизированное исследование, включавшее 678 участников, показало, что комбинация ибупрофен 200 мг + парацетамол 500 мг обеспечивает статистически значимо более эффективное обезболивание, чем комбинированные кодеинсодержащие препараты (р≤0,0001) [13].
![Рис. 3. Сравнение эффективности комбинации ибупрофена и парацетамола с комбинированными кодеинсодержащими препаратами [13] Рис. 3. Сравнение эффективности комбинации ибупрофена и парацетамола с комбинированными кодеинсодержащими препаратами [13]](https://medblog.su/wp-content/uploads/2020/04/1586897670_491_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
По данным Moor et al. (2013), коэффициент NNT (number-needed-to-treat — количество пациентов, которых надо пролечить, чтобы достигнуть запланированного эффекта), демонстрирующий эффективность выбранного лечения, для комбинации ибупрофен + парацетамол был самым низким. Таким образом, эффективность данной комбинации превосходила эффективность ряда других анальгетиков, в т. ч. содержащих кодеин (табл. 3) [14].
![Таблица 3. Сравнение анальгетического эффекта комбинации ибупрофен + парацетамол по показателю NNT с безрецептурными НПВП и ненаркотическими анальгетиками [14] Таблица 3. Сравнение анальгетического эффекта комбинации ибупрофен + парацетамол по показателю NNT с безрецептурными НПВП и ненаркотическими анальгетиками [14]](https://medblog.su/wp-content/uploads/2020/04/1586897670_360_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
Принимая во внимание тот факт, что парацетамол медленно растворяется в щелочной среде, но быстро — в кислой, тогда как ибупрофен — наоборот, их прием по отдельности приводит к тому, что их всасывание происходит в разных отделах ЖКТ: парацетамол — преимущественно в желудке, ибупрофен — в кишечнике. При производстве препарата Нурофен® Интенсив была применена современная технология SynchroTechTM [15], позволившая благодаря использованию уникальной капсульной мембраны оптимизировать растворение препарата с быстрым и одновременным высвобождением активных действующих веществ.
Tanner et al. (2010) показали, что tmax парацетамола при использовании комбинации парацетамола и ибупрофена было значительно ниже, чем при использовании только парацетамола (средняя разница 10 мин; р<0,05), в остальном фармакокинетические параметры парацетамола и ибупрофена были сопоставимыми с параметрами монопрепаратов или комбинации парацетамола и ибупрофена. Средние концентрации в плазме обоих препаратов также были выше после приема комбинации ибупрофена и парацетамола по сравнению с таковыми после приема ибупрофена или парацетамола в виде монопрепаратов. Средние уровни в плазме через 10 и 20 мин составляли 6,64 мкг/мл и 16,81 мкг/мл соответственно для ибупрофена при пероральном приеме комбинированного препарата по сравнению с 0,58 мкг/мл и 9,00 мкг/мл соответственно для монопрепарата. Для парацетамола средние уровни в плазме через 10 и 20 мин составляли 5,43 мкг/мл и 14,54 мкг/мл соответственно для комбинации по сравнению с 0,33 мкг/мл и 9,19 мкг/мл соответственно для монопрепарата (рис. 4) [16].
![Рис. 4. Фармакокинетические кривые «концентрация-время» ибупрофена (А) и парацетамола (В) в плазме крови здоровых добровольцев после однократного перорального приема ибупрофена, парацетамола или их фиксированной комбинации [16] Рис. 4. Фармакокинетические кривые «концентрация-время» ибупрофена (А) и парацетамола (В) в плазме крови здоровых добровольцев после однократного перорального приема ибупрофена, парацетамола или их фиксированной комбинации [16]](https://medblog.su/wp-content/uploads/2020/04/1586897670_6_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
Выраженный обезболивающий эффект при использовании комбинации ибупрофена и парацетамола развивался уже через 15 мин и достигал максимума через 40 мин с продолжительностью до 8 ч [16].
Безопасность применения комбинации ибупрофена и парацетамола
Выше уже отмечалось, что ибупрофен в среднетерапевтических дозах (600–1200 мг/сут) обладает низкой гастротоксичностью [17]. Парацетамол является анальгетиком центрального действия и не вызывает НПВП-гастропатии. В таблице 4 представлено сравнение активности ряда НПВП в отношении избирательности действия ЦОГ-1/ЦОГ-2.
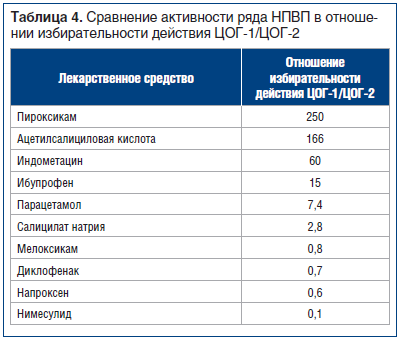
Если говорить о риске развития сердечно-сосудистых осложнений при использовании комбинации парацетамола и ибупрофена, то он также невысок (табл. 5) [18, 19]. Однако следует помнить, что ибупрофен снижает антитромбоцитарный эффект ацетилсалициловой кислоты и их сочетанный прием не рекомендован [20].
![Таблица 5. Риск развития сердечно-сосудистых осложнений при приеме НПВП [18] Таблица 5. Риск развития сердечно-сосудистых осложнений при приеме НПВП [18]](https://medblog.su/wp-content/uploads/2020/04/1586897670_839_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
Применение комбинации ибупрофена и парацетамола противопоказано: пригиперчувствительности к ибупрофену, парацетамолу или другим компонентам препарата, при одновременном применении других препаратов, содержащих парацетамол, при полном или неполном сочетании бронхиальной астмы, рецидивирующего полипоза носа и околоносовых пазух, при непереносимости ацетилсалициловой кислоты или других НПВП, эрозивно-язвенных заболеваниях органов ЖКТ, язвенных кровотечениях (в активной фазе или в анамнезе), при перфорации язвы ЖКТ, спровоцированной приемом НПВП, тяжелой сердечной недостаточности, тяжелой печеночной недостаточности или при заболеваниях печени в активной фазе. Комбинация ибупрофена и парацетамола не назначается пациентам с тяжелой почечной недостаточностью (клиренс креатинина менее 30 мл/мин), при подтвержденной гиперкалиемии, декомпенсированной сердечной недостаточности и в периоде проведения аортокоронарного шунтирования, при цереброваскулярных или иных кровотечениях, в III триместре беременности, при гемофилии и других нарушениях свертываемости крови и геморрагических диатезах, а также при генетическом отсутствии глюкозо-6-фосфатдегидрогеназы. Комбинация ибупрофена и парацетамола противопоказана лицам моложе 18 лет [9].
В целом комбинация ибупрофена и парацетамола хорошо переносится, НЛР редкие, как правило, нетяжелые и сравнимые по частоте с приемом плацебо (рис. 5) [13].
![Рис. 5. Частота развития НЛР при приеме комбинации ибупрофен + парацетамол, парацетамола, ибупрофена с кодеином и плацебо [13] Рис. 5. Частота развития НЛР при приеме комбинации ибупрофен + парацетамол, парацетамола, ибупрофена с кодеином и плацебо [13]](https://medblog.su/wp-content/uploads/2020/04/1586897670_801_nesteroidnye-protivovospalitelnye-preparaty-sobranie-klonov-ili-sodruzhestvo-yarkih-individualnostej-vzglyad-klinicheskogo-farmakologa-prohorovich-e-a.png)
Заключение
Таким образом, НПВП остаются одной из самых широко применяемых групп лекарственных препаратов. Выбор НПВП осуществляется исходя из индивидуальных особенностей пациента, имеющихся у него факторов риска развития осложнений лекарственной терапии. Пациент, регулярно принимающий НПВП, нуждается в наблюдении с целью раннего выявления развития НЛР. Комбинация ибупрофена с парацетамолом позволяет повысить терапевтический результат без увеличения риска развития побочных эффектов.
Благодарность
Автор и редакция благодарят компанию ООО «Рекитт Бенкизер Хэлскэр» (Россия) за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Информация с rmj.ru





