Некоторые клинико-иммунологические аспекты патогенеза атопического дерматита и роль толл-подобных рецепторов
Е. С. Снарская, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Атопический дерматит (АД) — хроническое воспалительное иммунозависимое состояние кожи, которое всегда усугубляется генетически наследуемым дефектом кожного барьера (потеря функции гена филаггрина) и высокой склонностью кожи к инфекциям [1, 2].
Мультифакториальность патогенетических аспектов АД обуславливает многообразие клинических проявлений АД от островоспалительных до эритематозно-лихеноидных мучительно зудящих высыпаний с преимущественной локализацией на лице, шее, зоне декольте и конечностях. Распространенность АД в промышленно развитых странах в течение последних десятилетий возросла у детей в 2 раза (с 15% до 30%), у взрослых — в 5 раз (с 2% до 10%) [3].
В современных условиях особенностью АД является его раннее начало (с рождения) и увеличение тяжелых, торпидных к традиционной терапии, часто инвалидизирующих форм заболевания, прежде всего за счет быстрого присоединения вторичной бактериальной и грибковой инфекции.
Установлено, что преобладающее влияние на характер течения АД оказывает колонизация кожи больных патогенными и условно-патогенными микроорганизмами и осложняется инфекциями, вызванными прежде всего токсигенными штаммами Staphylococcus aureus (у 90% пациентов с АД, колонизирует поврежденную и здоровую кожу, по сравнению с таковым у 5% общей популяции (здоровые люди)), грибами рода Malassezia, дрожжеподобными грибами рода Candida, мицелиарными дерматофитами, вирусом простого герпеса и др. [2]. В качестве фактора, индуцирующего формирование сочетанных форм АД и тяжелого варианта его течения, может выступать эндотоксин грамотрицательных бактерий желудочно-кишечного тракта, имеющий высокую степень токсичности для человека. Продукты метаболизма бактерий, грибов или вирусных белков представляют собой суперантигены, вызывающие неспецифическую активацию Т-клеток. Число Т-клеток, взаимодействующих с суперантигенами, почти в 100 раз превосходит число Т-клеток, взаимодействующих с обычным антигеном, при этом CD4+ Т-клетки выделяют большое число цитокинов, способных оказать токсическое действие на организм хозяина [4].
Изучение характера ответа врожденного иммунитета организма на инфекцию и его способности активировать адаптивные возможности иммунной системы позволяет по-новому оценить тактику микроорганизмов, ускользающих от иммунного контроля, и осветить новые аспекты патогенеза АД, а значит, и расставить приоритеты в терапевтической тактике [5].
Известно, что микробная инфекция может оказывать провоцирующее влияние в манифестации целого ряда аллергодерматозов, значительно осложняя течение, что особенно наглядно при АД.
Сегодня проводятся исследования механизмов реализации врожденного иммунитета, выявляющих роль определенного вида паттерн-распознающих рецепторов — толл-подобных рецепторов (TLR) (англ. Toll-like receptor; от нем. toll — замечательный) барьерных органов (кожи и слизистой) в патогенезе атопического дерматита. В настоящее время известно более 13 разновидностей TLR, каждый из которых способен распознавать свой «образ», характерный для определенных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней [5, 6]. Исследования TLR выявили их ключевую роль в детекции патогенных микроорганизмов, вторгающихся в барьерные ткани человека, и реализации ранних механизмов врожденного иммунитета [6, 7].
В эпидермисе TLR экспрессируются на эпителиоцитах, кератиноцитах, клетках Лангерганса, принимая непосредственное участие в формировании антимикробного ответа. При АД пептидогликаны клеточной стенки S. aureus индуцируют продукцию кератиноцитами медиаторов воспаления и комплекса провоспалительных цитокинов, стимулирующих большинство этапов воспаления. В ходе изучения экспрессии TLR при АД установлено, что именно дисфункция в сигналах TLR 2-го типа (TLR2) является причиной стафилококковой персистенции у пациентов, являющейся результатом нарушения индукции антимикробных пептидов [5–7]. Подобно другим иммунокомпетентным заболеваниям, патофизиология АД вовлекает Th2-тип иммунного ответа, а чрезмерная активация Th2-профиля цитокинов, поддерживаемая TLR, приводит к перевесу провоспалительных цитокинов и инициации хронизации процесса с увеличением аутоиммунного компонента [7, 8]. Таким образом, TLR активируют не только врожденный, но и адаптивный иммунитет.
Ослабление функций TLR2 у пациентов с АД способствует распространению высыпаний и может являться причиной рецидивов стафилококковой инфекции.
Сенсибилизация к липофильным грибам рода Malassezia furfur также является одним из важных факторов в патогенезе АД, особенно если учесть типичную локализацию высыпаний при АД — кожа лица, шеи, зоны декольте. Установлено, что воспаление, вызванное дрожжевыми грибами разновидности Malassezia, активирует те же рецепторы — TLR2.
Кератиноциты, инфицированные M. furfur, активизируются, экспрессируют молекулы адгезии, хемокины, которые способствуют хемотаксису эозинофилов и Th2-лимфоцитов, приводя к хронизации дерматоза [7, 9].
Кератиноциты обладают способностью отвечать на любые бактериальные, грибковые или вирусные патогены, повреждающие роговой слой, вырабатывая два важных класса эндогенных пептидов: бета-дефенсинов и кателицидинов. Бета-дефенсин 1 (hBD1) экспрессируется в норме, экспрессия бета-дефенсина 2 (hBD2) повышается при антигенной стимуляции [9]. Исследования in vitro выявили связь между высвобождением бета-дефенсина 2 и уничтожением S. aureus [7, 8], что демонстрирует важность роли hBD2 на первых этапах защиты от этого микроорганизма.
Таким образом, выявленные нарушения в сигнальном пути TLR2-рецепции и уровне высвобождения бета-дефенсина 2 являются важными и, возможно, определяющими звеньями в сложном многоступенчатом механизме патогенеза АД [7, 9]. Отсюда становится очевидным, что активация и восстановление TLR2-опосредованных реакций у больных с АД способствует профилактике присоединения вторичной инфекции. Несмотря на то, что точная роль TLR2 в патофизиологии АД сегодня находится в стадии более детального изучения, значение дисфунции TLR2 в патогенезе развития тяжелых форм дерматоза уже очевидно.
Создание активных препаратов, способных модулировать немедленный иммунный ответ, основанный на TLR-регуляции, может выявить новые пути в патогенетически обоснованном лечении хронических воспалительных заболеваний кожи, осложненных микроорганизмами, такими S. aureus или M. furfur [5, 7, 8].
Разработана серия средств лечебного ухода Гамма Cu-Zn+, содержащих инновационный эксклюзивный TLR2-Regul Complex, который получен путем соединения экстракта растения семейства Umbelliferae с синтетическим липидом. In vivo показано, что комплекс способен модулировать ответ TLR 2-го типа в коже при воспалении, вызванном S. aureus и M. furfur, а также увеличивать продукцию бета-дефенсинов при воспалении, вызванном S. aureus [6, 7].
Гамма Cu-Zn+ (гель, крем и спрей) преднаначена для гигиены и ухода за раздраженной, атопичной кожей с высоким риском вторичного инфицирования у новорожденных, детей и взрослых.
Все средства ухода Cu-Zn+ оздоравливают, успокаивают и уменьшают раздражение кожи, вызванное пролиферацией бактерий, благодаря синергическому действию запатентованного комплекса TLR2-Regul Complex, глюконатов меди и цинка и Термальной воде Урьяж. Входящие в состав продуктов медь (Cu) и цинк (Zn) оздоравливают, нормализуя баланс микрофлоры эпидермиса.
Гель Cu-Zn+ очищает и оздоравливает кожу благодаря ультрамягкой очищающей основе без мыла и консервантов. Применяется для лица и тела в качестве ежедневного гигиенического ухода.
Крем Cu-Zn+ успокаивает, восстанавливает барьерную функцию кожи. Обладает маслянистой текстурой, не содержит консервантов. Предназначен для ухода за раздраженной атопичной кожей лица и тела (трещины ягодичных зон).
Спрей Cu-Zn+ успокаивает, оздоравливает, абсорбирует избыток влаги и подсушивает мокнущие участки и зоны мацерации (складки кожи, подмышечные впадины, локтевые и подколенные сгибы, ягодичные зоны).
Все препараты, содержащие TLR2-Regul complex, способны быстро регулировать процесс воспаления, вызванный микроорганизмами S. aureus или M. furfur, путем модуляции ответа TLR2 в коже, который направлен на ограничение их роста и размножения и рекомендуется в комплексной терапии хронических дерматозов, осложненных вторичной инфекцией, в частности атопического дерматита [5–7].

Под нашим наблюдением находилось 15 пациентов в возрасте от 18 до 38 лет, из них 8 мужчин и 7 женщин c диагнозом «атопический дерматит средней степени тяжести течения» со среднегрупповым показателем дерматологического индекса шкалы симптомов (ДИШС) 18,3 ± 2,3. Из клинических особенностей исследуемой группы пациентов следует отметить преобладающую локализацию типичных поражений на коже задней поверхности шеи, в аурикулярных и периаурикулярных зонах (рис. 1), локтевых и коленных сгибах, на сгибательных поверхностях лучезапястных суставов, тыле кистей в виде зудящих эритематозно-лихеноидных высыпаний и участками поражения кожи с мокнутием и трещинами.
Все пациенты получали терапию, предусмотренную стандартами, а в качестве базового ухода пациентам были предложены средства лаборатории Урьяж Гамма Cu-Zn+ с TLR2-Regul Complex.
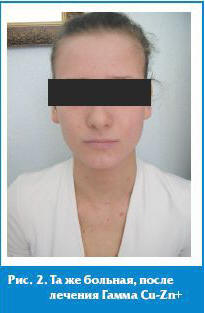
Через 7 дней регулярного применения средств линии отмечена устойчивая положительная динамика в виде эпителизации участков мокнутия и раздражения кожи, через 14 дней — нормализация цвета и качества кожи, отсутствие признаков инфицирования (рис. 2). Общеклиническая оценка результатов констатирована нами как значительное улучшение, приводящее к выраженной клинической ремиссии, при этом средний показатель ДИШС через 3 недели составил 6,3 ± 1,4, что констатирует регресс более 65% клинических проявлений. Таким образом, результаты исследования подтверждают эффективность инновационных средств Гаммы Cu-Zn+ с TLR2-Regul Complex в топической терапии атопического дерматита, патогенетически обладающего высоким риском инфицирования, и могут быть использованы в составе комплексной терапии АД.
Литература
- Кожные и венерические болезни: справочник / Под ред. О. Л. Иванова. М.: ОАО «Издательство «Медицина», 2007. С. 28–29.
- Кочергин Н. Г., Черникова Е. А., Билалова У. Г. и др. Атопический дерматит открытых участков и малассезиозная инфекция // Росс. журн. кож. и вен. болезней. 2011. № 2, с. 31–33.
- Ольшамовская А. О., Бабкин А. В., Грашин Р. А. и др. Биохимические показатели крови, коррелирующие с тяжестью течения атопического дерматита // Российский журн. кож. и вен. болезней. 2012, № 1. С. 35–37.
- Бурместер Г. Р., Пецуро H. P. Наглядная иммунология / Пер. с англ. под ред. проф. Л. В. Козлова. М.: Бином, 200. С. 46.
- Снарская Е. С., Кряжева С. С., Лавров А. А. Роль толл-подобных рецепторов (TLR) активаторов врожденного иммунитета в патогенезе ряда дерматозов // Росс. журн. кож. и вен. болезней. 2012, № 2, с. 9–12.
- Ionescu M. A., Baroni A. S, Brambilla L. E. // Ital. Dermatol. Venerol. 2011, 146 (3), p. 182–189.
- Ionescu M. A. Lecture at Russian Dermatology Congress, Saint Petersburg, October 3, 2011.
- Катунина О. Р., Резайкина А. В., Клыхалова О. И. Роль распознающих рецепторов в инициации иммунного воспаления в коже больных псориазом // Вестник дерматологии и венерологии. 2010, № 5, с. 84–91.
- Сорокина Е. В., Масюкова С. А. Роль толл-подобных рецепторов в патогенезе некоторых дерматозов // Клиническая дерматология и венерол. 2011, № 5, с. 13–17.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru



