Введение
Нейроваскулярный конфликт (НВК) — это сдавление черепного нерва сосудом. Компрессии может быть подвергнут любой черепной нерв [1]. Самый известный НВК ассоциирован с классической невралгией тройничного нерва, симптомы, патогенез и этиология которой широко освещены в научной литературе [2]. Реже встречается НВК, обусловленный вовлечением двигательной порции тройничного нерва, протекающий с гемимастикаторным спазмом (ГМС) или его сочетанием с гемиатрофией лица (синдром Парри — Ромберга). При этом сосудами, контактирующими с корешком тройничного нерва, являются верхняя мозжечковая артерия или передняя нижняя мозжечковая артерия [3].
Представляем клиническое наблюдение пациента с компрессией двигательной порции тройничного нерва, дебютом в виде ГМС с последующей гемиатрофией лица.
Клиническое наблюдение
Пациент Р., 26 лет, обратился на амбулаторный прием примерно через год от начала заболевания с жалобами на стягивающие, труднопереносимые боли (9–10 баллов по визуальной аналоговой шкале (ВАШ)) в околоушной области слева, иногда в подбородочной зоне с той же стороны без иррадиации. Болям предшествовал спазм жевательных мышц. В момент спазма сжимались челюсти с неоднократным прикусыванием языка. Иногда во время приступа челюсть смещалась вправо. Боль в височно-нижнечелюстном суставе не возникала. Приступы продолжались несколько секунд. Вне приступа боли не беспокоили. Частота приступов варьировала от 20 до 30 раз в день. Приступ мог быть спровоцирован разговором, жеванием, но мог возникнуть и в покое. Больной избегал разговоров и приема пищи, требующей жевания. Частота и характер приступов за истекший промежуток времени (до момента обращения) не изменились. Отметил, что «похудела левая половина лица», но, когда это случилось, точно сказать не мог, утверждал, что спустя длительный промежуток времени после возникновения первых приступов. За месяц до обращения в области виска слева выпали волосы на участках в виде двух округлых пятен диаметром около 2 см. Слева в теменно-лобной области на волосистой части головы и на подбородке появились глубокие полосы длиной 2,5 см, а также участки облысения. В связи с продолжающимися приступами боли и предположением стоматологической патологии были удалены зубы мудрости, был назначен линкомицин сроком на 3 нед. Описанные пароксизмы исчезли, на участках облысения стали расти волосы, исчезли «рубцы» на лбу. На подбородке они приобрели меньшую протяженность и стали менее глубокими. Однако «похудание лица увеличилось», появились участки, прикосновение к которым могло вызвать боль и сжатие челюстей. Однако оно не было сильным и боли были терпимыми (5–6 баллов по ВАШ). Хронические заболевания отрицал.
Объективно: высокого роста, правильного телосложения с хорошо развитой мускулатурой. Неубедительная анизокория S<=D, зрачковые реакции живые. Точки выхода тройничного нерва безболезненны, чувствительность на лице не нарушена, роговичные рефлексы живые. Нижняя челюсть занимает срединное положение. Движения нижней челюсти в полном объеме, неубедительное снижение силы левых крыловидных мышц, мандибулярный рефлекс оживлен, пальпебральный и назопальпебральный рефлексы обычной живости. Гипотрофия височной и жевательной мышц слева. Язык при высовывании несколько отклоняется влево, в полости рта располагается по средней линии, движения языком не ограничены, сила мышц языка достаточная, неубедительная гипотрофия левой половины языка. Слева менее выражен цвет радужки. Температура, цвет, влажность кожи лица слева и справа одинаковые. Участки облысения на левом виске, гипотрофия тканей височной и щечной областей в околоушной зоне слева (рис. 1А). Белесоватые пятна размером с рублевую монету со снижением оволосения в области подбородка и губы слева (рис. 1B). На подбородке слева 2 рубцевидных западения, напоминающих рубец после пореза ножом, длиной 1,5 см, глубиной около 3 мм. Вокруг и в самом «рубце» — уменьшение оволосения, без изменения цвета кожи, уплотнения или трофических изменений тканей. При пальпации жевательной и височной мышц слева обнаруживаются гипотрофия, а также болезненные триггерные точки, раздражение которых непостоянно сопровождается сокращением жевательных мышц, возникновением терпимой боли (3–4 балла по ВАШ). При этом происходит сближение челюстей без их сжатия. Движения нижней челюстью становятся невозможными, и в этих случаях больной прекращает разговор. Приступ длится 2–4 с, не сопровождаясь «болевым поведением» и вегетативной реакцией. В спазм включаются только левые височная и жевательная мышцы (отклонения челюсти не происходит). При высовывании языка появляется болезненный мышечный валик в субментальной области (сокращение переднего брюшка двубрюшной мышцы) слева. При произвольном сжатии челюсти аналогичный валик возникает в жевательной мышце слева.
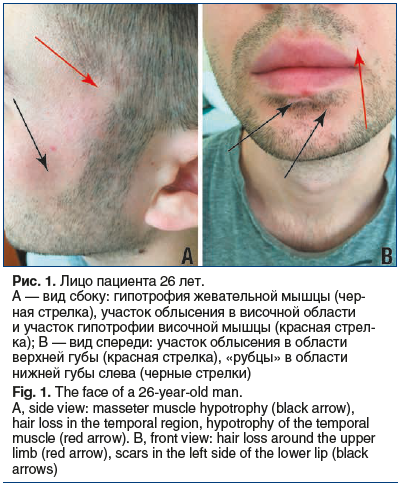
Результаты лабораторных исследований патологии не выявили. МРТ головного мозга с исследованием черепно-мозговых нервов на высокопольном аппарате (3,0 Тс): в режиме FIESTA выявлено прилежание мелкого сосуда к корешку тройничного нерва слева без его смещения (рис. 2). При проведении игольчатой электромиографии левой жевательной мышцы происходит ее спазм с образованием большого количества потенциалов двигательных единиц (чего не наблюдается при электромиографии мышцы противоположной стороны и нежевательных мышц).
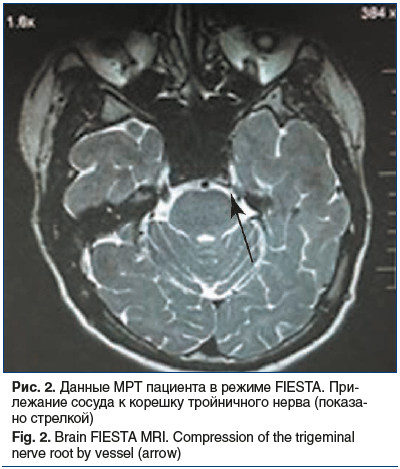
На основании данных нейровизуализации, клинической картины заболевания выставлен диагноз: «Нейроваскулярный конфликт слева, обусловленный сосудистой компрессией двигательной порции корешка тройничного нерва с развитием гемимастикаторного спазма и лицевой гемиатрофии (синдром Парри — Ромберга) с умеренно выраженными нейротрофическими нарушениями». В связи со спонтанным регрессом болевого синдрома от предложенного нейрохирургического вмешательства пациент отказался.
Обсуждение
Нами представлена история болезни пациента, заболевание которого началось с кратковременных крайне болезненных спазмов жевательных мышц, сопровождающихся сжатием челюсти с непостоянным прикусыванием языка, перемещением челюсти в сторону. В дальнейшем развилась гемигипотрофия жевательных мышц, появились участки облысения в виде пятен, глубоких борозд на подбородке и лобно-теменной области слева, сравнимых с глубоким порезом ножом. Нарастание гипотрофии мышц левой половины лица совпало с исчезновением описанных приступов, появлением триггерных зон, раздражение которых провоцировало возникновение локального спазма мышц с образованием в пальпируемых мышцах умеренно болезненных мышечных валиков и непостоянного почти безболевого сближения челюстей.
Спазмы жевательной мускулатуры, вызываемые движениями (речь, жевание), сжимание и смещение челюсти во время спазма, их сила и неожиданность (прикусывание языка), односторонность пароксизмов позволили диагностировать у больного гемимастикаторный спазм (ГМС) — синдром, проявляющийся непроизвольными односторонними сокращениями жевательных мышц [4]. ГМС впервые описан Гауэрсом в 1897 г. и обозначен им как «спазм жевательной мускулатуры Ромберга». Заболевание встречается довольно редко. За период с 1980 по 2013 г. в литературе описано 36 случаев ГМС, а в исследовании, проведенном в 2010–2015 гг. в клинике двигательных расстройств, среди 215 пациентов с гемифациальным спазмом был только один пациент с ГМС [5]. ГМС в большинстве случаев сочетается с гемиатрофией лица. Как единственное проявление заболевания или как дебютирующий синдром является казуистикой.
В ГМС может вовлекаться одна или нескольких жевательных мышц, но, как правило, не затрагиваются мышцы, открывающие рот [3, 4, 6]. При этом в мышцах, вовлеченных в спазм, в большинстве случаев не обнаруживают трофических изменений. Ряд авторов описывают гипертрофию или гипотрофию жевательных мышц при ГМС [7]. В нашем наблюдении в тяжелый пароксизм включались все мышцы, в том числе и крыловидные (боковое смещение челюсти), и переднее брюшко двубрюшной мышцы (образование валика в субментальной зоне), определялась гипотрофия височной и жевательной мышц.
Боль при ГМС тупая, продолжительная, ноющая, связана с мышечным спазмом. Диагностическими клиническими критериями боли при ГМС выступают: тупой характер боли, отсутствие стреляющей боли, курковых зон, совпадение болевых пароксизмов с мышечным спазмом, прекращение болевых ощущений вместе с прекращением спазма [4]. В противоположность этому при раздражении чувствительных волокон корешка тройничного нерва боль кратковременная, простреливающая. Признаком поражения чувствительной порции тройничного нерва является также выпадение роговичного рефлекса при сохранности мандибулярного и, по данным миографии, отсутствие аксонального повреждения двигательных волокон тройничного нерва [4, 6].
Боль у нашего пациента на первых этапах заболевания была труднопереносимой, локализованной, без зон иррадиации, что не характерно для классической тригеминальной невралгии, ассоциированной с поражением чувствительной порции корешка тройничного нерва. Интактность чувствительных волокон подтверждалась сохранностью роговичных рефлексов. Болевой синдром у пациента соответствовал и клиническим критериям боли при ГМС.
Верификация в нашем наблюдении по результатам нейровизуализации НВК в области корешка тройничного нерва делает маловероятным объяснение ГМС другой локализацией этого конфликта. Хотя при поиске причин ГМС необходимо иметь в виду, что он может быть вызван очаговой демиелинизацией моторных волокон тройничного нерва после выхода III ветви тройничного нерва из полости черепа в нижневисочную ямку и прохождения ее между латеральным крыловидным отростком и поверхностью черепа. Компримирующее воздействие при этом оказывает увеличенная в размере латеральная крыловидная мышца или прилегающий к нерву сосуд [7].
Локальность боли (преаурикулярная область), ее характеристика, ассоциация со спазмом жевательных мышц позволяют связать болевые ощущения пациента именно с мышечным спазмом. Связь боли со спазмом жевательных мышц при ГМС подчеркивают многие авторы [4, 8]. У одной из трех описанных R.G. Auger et al. больных в период ГМС возникали чрезвычайно тяжелые боли [4], причем спазм развивался только в медиальной крыловидной мышце, у двух других пациентов с менее выраженными болевыми пароксизмами спазм охватывал височную и жевательную мышцы.
Между латеральной и медиальной крыловидными мышцами располагается сhorda tympani, конечной ветвью которой является n. lingualis, крыловидный отдел верхнечелюстной артерии, включающий а. massеterica, глубокие переднюю и заднюю aa. temporalеs, a. buccalis, кровоснабжающие соответствующие мышцы и нервы, в их числе и n. lingualis. Надо полагать, что причиной боли в нашем наблюдении стала ишемизация соответствующих структур, связанная с воздействием спазмированных мышц на сосуды. В пользу данного предположения свидетельствует динамика ГМС: в первые месяцы заболевания спазм распространялся не только на височную и жевательную мышцы, но и на крыловидные мышцы, что создавало условия для компрессии сосудов и нервов, проходящих между латеральной и медиальной крыловидными мышцами. В последующем из реализации спазма были исключены крыловидные мышцы, сам спазм стал менее выраженным, что клинически проявлялось в сближении челюстей во время пароксизма без их сжатия, отсутствии смещения челюсти и регрессе болевых ощущений. Надо полагать, что имевшийся у пациента НВК служил пусковым фактором для развития клинической картины заболевания.
С течением времени у больного на стороне ГМС развились нейротрофические нарушения, расцененные нами как проявления гемиатрофии лица в рамках синдрома Парри — Ромберга, при котором основным симптомом является гипотрофия одной из половин лица, обусловленная нарушением трофических процессов в коже, подкожной клетчатке, мышечной и костной ткани. Возможна также умеренно выраженная гипотрофия жевательной мускулатуры и мышц соответствующей половины языка без нарушения их функций, появление участков выпадения волос, «рубцов», развитие ГМС [9]. Прогрессирующая гемиатрофия лица может быть как самостоятельной нозологией, так и синдромом других заболеваний — сирингомиелии, склеродермии, спинной сухотки, опухоли, аневризмы сосудов, НВК [10]. Происхождение гемиатрофии связывают с очаговыми процессами в коре головного мозга, поражением гипоталамуса, системы тройничного нерва, с патологией симпатического отдела вегетативной нервной системы, в частности верхнего симпатического узла [11]. Гемиатрофия лица, как правило, опережает возникновение ГМС. У нашего пациента наблюдалась обратная динамика. Подобное развитие патологического процесса описано в работе [12]. Авторы у наблюдаемой ими пациентки отмечали атрофию языка. У нашего пациента обнаруживалась негрубо выраженная гипотрофия левой половины языка с отклонением его влево при высовывании, при этом не наблюдалось слабости мышц языка и не изменялась его подвижность.
Восстановление роста волос на ранее облысевших участках, уменьшение длины «рубцов» после прекращения тяжелых пароксизмов ГМС позволяют предположить, что формирование нейротрофических нарушений на лице и возникновение труднопереносимых болей у больного во время тяжелого ГМС связаны единым механизмом — воздействием спазмированной мышцы на симпатические волокна, сопровождающие сосуды. Значимость выключения симпатической иннервации лица в развитии гемифациальной атрофии подтверждается экспериментом, проведенным L.A. Resende et al. [13]. Авторы наблюдали развитие гемифациальной атрофии у животных спустя некоторое время после симпатэктомии. Эти результаты позволяют нам заключить, что в патогенезе синдрома Парри — Ромберга имеет значение нарушение функционирования симпатической нервной системы. Косвенным доказательством вовлечения в процесс ее периферического отдела в нашем наблюдении являются по аналогии с симптоматикой, наблюдаемой при стенозирующих процессах в каротидной системе [14], деколорация радужки, наличие участков облысения и неубедительный миоз слева.
Для нашего наблюдения, мы полагаем, приемлем следующий вариант патогенетического механизма ГМС — формирование двигательной системы с низким порогом возбудимости под влиянием импульсов, генерируемых в эктопическом очаге при НВК. Подтверждением этому служит наличие у пациента НВК и ассоциация пароксизмов спазмов с пусковыми факторами, такими как жевание, сжатие челюстей, пальпация мышц и др. Болевые пароксизмы и лицевая гемиатрофия объясняются ишемизацией тканей и симпатических волокон компримируемых спазмированными мышцами сосудов в местах их прохождения между мышцами.
Рубцы, изменение цвета радужки, гипотрофия языка, гемиатрофия лица, отсутствие патологии со стороны внутренних органов — эти признаки сближали заболевание нашего пациента с вариантами локализованной склеродермии (ЛС) — «склеродермией по типу удара саблей» и вариантом, протекающим с «прогрессирующей гемиатрофией лица» (синдромом Парри — Ромберга). В отличие от системной склеродермии локализованная (очаговая) склеродермия не поражает внутренние органы [15]. У нашего пациента патологии со стороны внутренних органов не обнаружено. ЛС проходит стадии отека, индурации и атрофии, имеет вид плотного тяжа склерозированной кожи, на котором отсутствует рост волос, что обозначается как «удар саблей». Со временем поверхность очага сглаживается, формируется западение, обусловленное атрофией кожи, мышц и костной ткани. У нашего пациента подобной динамики со стороны «рубцов» не наблюдалось — в тканях, окружающих рубец, отсутствовали местные изменения, с улучшением состояния больного размеры «рубцов» уменьшились.
В описываемом нами случае для ЛС, протекающей с «прогрессирующей гемиатрофией лица», был нетипичным характер нейротрофических изменений лица. При ЛС гемиатрофия лица характеризуется прогрессирующей атрофией половины лица, проявляющейся преимущественно дистрофическими изменениями кожи, подкожной клетчатки, мышц и костей лицевого скелета, возможны различные неврологические нарушения, включая эпилепсию [15, 16]. В нашем наблюдении отсутствовали трофические изменения кожи, подкожной клетчатки и костей. Со стороны радужки у пациента фиксировалась деколорация, при ЛС прослеживается гиперхромия. Кроме того, при ЛС изменение цвета радужки нередко сочетается с птозом века и ретробульбарными болями, чего не наблюдалось в описываемом нами случае. Приведенные данные позволили нам исключить у пациента варианты ЛС в качестве причины развития синдрома Парри — Ромберга.
Непроизвольные движения нижней челюсти, имеющие место у пациента, обязывали, особенно на начальных этапах заболевания, когда отсутствовали нейротрофические изменения лица, исключить оромандибулярную дистонию. Участие в спазме всей группы мышц, обеспечивающих движения нижней челюсти, интактность в непроизвольном движении других мышц лица и языка, наличие моторных триггерных зон, боль, сопровождающая спазм, регресс симптоматики также исключали в нашем наблюдении оромандибулярную дистонию. Для последней характерны приступы с включением в непроизвольное движение не только жевательной и крыловидных мышц (височная мышца, как правило, не включается), но и других (двубрюшной, языка, щечной), использование больным корригирующих жестов, динамичность и непредсказуемость движений. Кроме того, течение оромандибулярной дистонии имеет прогрессирующий характер с быстрым формированием функционального дефекта, снижающего трудоспособность [17].
Лечение ГМС проводится с применением карбамазепина, инъекций ботулотоксина или проведением микроваскулярной декомпрессии [3]. Информации о спонтанном регрессе ГМС в доступной нам литературе не представлено. Однако описана возможность спонтанного регресса симптомов у пациентов с классической невралгией тройничного нерва, которая объясняется ремиелинизацией нервных волокон [18]. Видимо, именно этим можно объяснить изменение у нашего пациента характера пароксизмов и факторов, запускающих приступ.
Заключение
Особенностью представленного нами наблюдения редкой формы НВК с компрессией двигательной порции корешка тройничного нерва является необычность клинических проявлений, таких как сочетание ГМС с синдромом Парри — Ромберга, динамика самого процесса (дебют заболевания с ГМС с последующим развитием гемиатрофии лица и спонтанный регресс заболевания), участие в реализации ГМС не только часто описываемых жевательной и височной мышц, но и крыловидных, спазм которых, с нашей точки зрения, имел решающее значение в развитии болевых пароксизмов и нейротрофических нарушений тканей лица. Предложена концепция, объясняющая возникновение ГМС, его клинических проявлений и гемиатрофии лица, которую можно рассматривать как один из вариантов механизма развития описанной патологии. Приведенные данные могут быть полезны врачам, сталкивающимся с лицевыми болями и двигательными расстройствами лица.
Сведения об авторах:
Матвеева Татьяна Всеволодовна — д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, г. Казань, ул. Бутлерова, д. 49.
Казанцев Александр Юрьевич — врач-невролог, ассистент кафедры неврологии, нейрохирургии и медицинской генетики ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, г. Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0001-9800-9940.
Алескерова Айшен Бахман кызы — врач-невролог ФКУЗ «МСЧ МВД России по Республике Татарстан»; 420111, Россия, Республика Татарстан, г. Казань, ул. Лобачевского, д. 13.
Гайфутдинов Рустем Талгатович — к.м.н., доцент кафедры неврологии, нейрохирургии и медицинской генетики ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, г. Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0001-5591-7148.
Контактная информация: Казанцев Александр Юрьевич, e-mail: engine90@bk.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 12.01.2021.
Поступила после рецензирования 04.02.2021.
Принята в печать 03.03.2021.
About the authors:
Tatyana V. Matveeva — Dr. Sc. (Med.), professor of the Department of Neurology, Neurosurgery, & Medical Genetics, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation.
Aleksandr Yu. Kazantsev — neurologist, assistant of the Department of Neurology, Neurosurgery, & Medical Genetics, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation; ORCID iD 0000-0001-9800-9940.
Aishen B. Aleskerova — neurologist, Medical Wing of the Ministry of Internal Affairs in the Republic of Tatarstan; 13, Lobachevski str., Kazan, 420111, Russian Federation.
Rustem T. Gaifutdinov — C. Sc. (Med.), associate professor of the Department of Neurology, Neurosurgery, & Medical Genetics, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation; ORCID iD 0000-0001-5591-7148.
Contact information: Aleksandr Yu. Kazantsev, e-mail: engine90@bk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 12.01.2021.
Revised 04.02.2021.
Accepted 03.03.2021.
.
Информация с rmj.ru






