Хроническая ишемия головного мозга (ХИГМ) является важной междисциплинарной проблемой, т. к. представляет собой один из наиболее распространенных синдромов в клинической неврологии. В отечественной литературе ХИГМ может иметь название «дисциркуляторная энцефалопатия» [1]. В зарубежной литературе ХИГМ рассматривается с позиции проявления когнитивной дисфункции — сосудистых когнитивных расстройств (СКР) [2].
У лиц пожилого возраста ХИГМ, приводящая к структурным и функциональным изменениям белого и серого вещества, наряду с нейродегенеративными заболеваниями головного мозга, является основной причиной развития когнитивных нарушений [3]. По данным отечественных и зарубежных источников, когнитивные нарушения, вызванные цереброваскулярными причинами, выявляются у 5–22% пожилых людей [4, 5]. На протяжении многих лет пристальное внимание ученых было приковано к изучению тяжелых когнитивных расстройств — сосудистой деменции и болезни Альцгеймера. Сейчас большое внимание уделяется умеренным (додементным) нарушениям когнитивной сферы, определяемым как начальная стадия сосудистой деменции и деменции альцгеймеровского типа [6].
СКР делятся на три типа: 1) не достигающие степени деменции; 2) сосудистая деменция; 3) смешанный тип — деменция альцгеймеровского типа в сочетании с цереброваскулярным заболеванием [7].
При СКР в большей степени страдают регуляторные функции (когнитивный контроль, планирование, исполнительная деятельность), скорость мыслительных процессов, внимание, в отличие от когнитивных нарушений нейродегенеративного характера, где на первое место выходят мнестические расстройства [8]. Ведущую роль в патогенезе СКР играет поражение глубинных отделов белого вещества головного мозга и базальных ганглиев, что приводит к нарушению связей лобных долей головного мозга и подкорковых структур [9]. Согласно классификации академика РАМН Н.Н. Яхно (2005), выделяют тяжелые, умеренные и легкие когнитивные нарушения [10].
Тяжелыми когнитивными нарушениями называют моно- и полифункциональные расстройства когнитивных функций, которые вызывают профессиональную, социальную и бытовую дезадаптацию. Подобные нарушения носят чаще всего прогрессирующий характер. Распространенность тяжелых когнитивных нарушений различного генеза варьирует от 3 до 20% [11]. Сосудистая деменция является второй наиболее распространенной причиной деменции у взрослых после болезни Альцгеймера. Согласно различным критериям включения в структуру общей деменции сосудистая деменция составляет от 4,5 до 39% [12]. Умеренные когнитивные нарушения представляют собой моно- и полифункциональные расстройства когнитивных функций, которые выходят за рамки среднестатистической возрастной нормы, но не вызывают дезадаптацию.
К нейропептидным (нейротрофическим) препаратам относится Церебролизин. Препарат обладает мультимодальным регуляторным действием на мозговой метаболизм, нейропротективными свойствами и уникальной нейрон-специфической активностью, сходной с активностью фактора роста нервов [14].
Содержание статьи
Исследования эффективности Церебролизина при когнитивных нарушениях сосудистого генеза
Данный обзор посвящен клиническим исследованиям эффективности Церебролизина при лечении различных форм когнитивных нарушений сосудистого и нейродегенеративного генеза. Церебролизин повышает эффективность ассоциативных процессов в мозге, улучшает оперативную память, внимание, стабилизирует эмоциональный фон, а также способствует регрессу двигательных и экстрапирамидных расстройств. Интерес к нейротрофическому действию Церебролизина возник после опубликования Sommer H. и Quandt J. (1973) результатов исследования на мозге молодых крыс, которые показали, что препарат способствует активации и пролиферации глиальных клеток и ранней дифференцировке кортикальных структур головного мозга [15].
В 1991 г. Верещагин Н.В. и соавт. [16], используя двойной слепой метод, изучали эффективность Церебролизина у больных с мультиинфарктной деменцией. В исследовании приняли участие 60 больных, которые получали 15 мл препарата на 100 мл физиологического раствора в течение
28 дней. После курса терапии у пациентов отмечено улучшение абстрактного мышления и памяти по результатам теста Арнольда — Кольмана, положительная динамика ЭЭГ.
Результаты китайского многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования (Xiao S. et al., 1999) подтвердили эффективность применения препарата Церебролизин у пациентов с когнитивными нарушениями на фоне ХИГМ. В исследовании участвовали 148 пациентов в возрасте от 55 до 85 лет. Церебролизин применяли инфузионно по 30 мл 1 р./день 5 дней (с понедельника по пятницу) в течение 4 нед. Результаты оценивали с использованием Краткой шкалы оценки психического статуса MMSE, Шкалы общего клинического впечатления (CGI), Шкалы депрессии Гамильтона, Шкалы активности повседневной жизни. У пациентов, получавших Церебролизин, показано статистически значимое улучшение по шкале MMSE (на 2,7 балла от исходного уровня), а также по другим оценочным шкалам. Частота нежелательных явлений, вызванных Церебролизином, была низкой (5%) и сопоставимой с таковой при применении плацебо (8%) [12].
В период с апреля 2008 г. по сентябрь 2010 г. Muresanu D.F. et al. провели рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование по изучению эффективности применения препарата Церебролизин у пациентов в раннем восстановительном периоде инсульта. В данном исследовании изучали не только влияние Церебролизина на двигательные нарушения, но и на сосудистые когнитивные нарушения в восстановительном периоде острого нарушения мозгового кровообращения (ОНМК). В исследовании участвовали 208 пациентов, которые получали Церебролизин (30 мл/сут) или плацебо (физиологический раствор) 1 р./день в течение 21 дня, с началом лечения не раньше 24 ч и не позже 72 ч после начала инсульта. Результаты когнитивного восстановления оценивали по Шкале тяжести инсульта (NIHSS), индексу Бартела, степени афазии (Goodglass and Kaplan Communication Scale). Церебролизин оказал благотворное влияние на функцию и общий результат у пациентов в раннем восстановительном периоде инсульта. Его безопасность была сопоставима с безопасностью плацебо, что свидетельствует о благоприятном соотношении пользы и риска [17].
Этой же группой ученых было проведено трехмесячное исследование влияния Церебролизина на когнитивные функции и замедление ЭЭГ у пациентов с сосудистой деменцией. В двойной слепой фазе исследования участвовали 33 пациента с легкой и умеренно тяжелой сосудистой деменцией (по данным NINDS-AIREN). Пациенты получали препарат Церебролизин (10 или 30 мл) или плацебо (физиологический раствор) 5 дней в неделю в течение 4 нед. Нейропсихологические оценки (ADAS-cog+) и записи количественной ЭЭГ (qEEG) были сделаны в начале, на 4-й и 16-й нед. На 16-й нед. лечения у пациентов основной группы, получавших Церебролизин в дозах 10 и 30 мл, отмечено улучшение по шкале ADAS-cog+, а у получавших Церебролизин в дозе 30 мл уменьшилось отклонение от нормы qEEG (p
Результаты рандомизированного двойного слепого плацебо-контролируемого многоцентрового исследования (Ghekht A.B. et al., 2011), проведенного на кафедре неврологии и нейрохирургии ФГБОУ ВО РНИМУ им. Н.И. Пирогова в Москве, также показали эффективность применения препарата Церебролизин у 242 пациентов с СКР. Результаты оценивали по шкале ADAS-cog+ и Шкале общего клинического впечатления (CIBIC+) через 24 нед. лечения. Больные получали 20 инфузий Церебролизина по 20 мл внутривенно. На 24-й нед. показатель Шкалы оценки болезни Альцгеймера — когнитивной подшкалы (ADAS-Cog+) улучшился на 10,6 балла в группе Церебролизина по сравнению с улучшением на 4,4 балла в группе контроля. Результаты оценки шкалы CIBIC+ (CIBIC-plus — Clinician’s Interview Based Impression of Change plus Caregiver Input) показали среднее улучшение на 2,84 балла в группе лечения и на 3,68 балла в группе плацебо. Таким образом, данные исследования продемонстрировали положительный эффект препарата в восстановлении когнитивных функций у больных с СКР [19].
Исследование австрийских ученых Ladurner G. et al. (2005) подтвердило эффективность применения препарата Церебролизин у пациентов с когнитивными нарушениями после ОНМК. Пациенты с острым инсультом в течение 24 ч от начала инсульта получали плацебо (n=68) или Церебролизин (n=78) по 50 мл/день в течение 21 дня. Обе группы получали сопутствующее лечение: ацетилсалициловую кислоту 250 мг/день и пентоксифиллин 300 мг/день. Состояние когнитивной функции больных оценивали по шкале MMSE, Канадской неврологической шкале, индексу Бартела. У пациентов, принимавших Церебролизин, наблюдалось значительное улучшение когнитивной функции по шкале MMSE в отличие от группы плацебо. Результаты показывают, что нейротрофическое лечение Церебролизином безопасно и хорошо переносится пациентами с острым инсультом [20].
Данные описанных выше исследований представлены в таблице 1.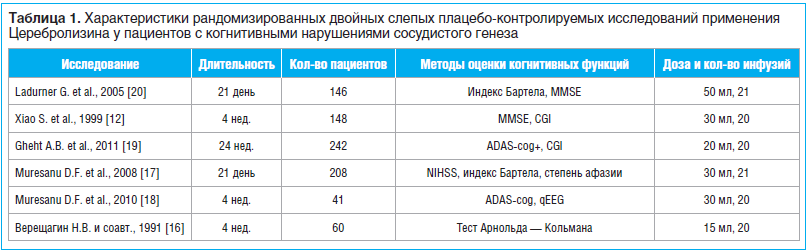
Исследования эффективности Церебролизина при когнитивных нарушениях нейродегенеративного генеза
Исследования показали, что у пациентов с сосудистой патологией применение Церебролизина эффективно не только при когнитивных нарушениях, но и при нейродегенеративных заболеваниях головного мозга (табл. 2).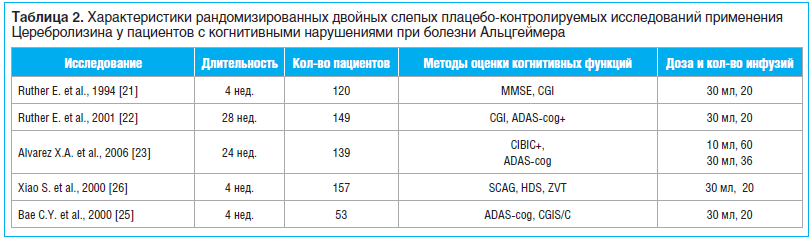
Немецкие ученые университета Георга Августа (Ruther Е. et al., 1994) провели исследование, показывающее эффективность терапии Церебролизином у больных с деменцией альцгеймеровского типа. В исследовании участвовали 120 пациентов с деменцией от легкой до умеренной степени тяжести по GDS (Global Deterioration Scale — Общая шкала нарушений). Диагноз был подтвержден по шкале Хачинского и результатам компьютерной томографии черепа. Основная группа получала Церебролизин (30 мл в 100 мл физиологического раствора в/в) 5 дней в неделю в течение 4 нед. В качестве плацебо использовали физиологический раствор (130 мл). Степень когнитивных нарушений оценивали по шкалам MMSE, CGI [21]. Клинически значимое улучшение по оценочным шкалам отмечалось у 61,7% пациентов основной группы непосредственно после терапии и в отдаленном периоде (через 6 мес. после окончания лечения).
В 2001 г. в 9 исследовательских центрах, больницах и амбулаторных учреждениях Германии и Австрии было проведено семимесячное рандомизированное двойное слепое плацебо-контролируемое параллельное исследование (Ruther Е. et al., 2001) с включением 149 пациентов в возрасте 50–85 лет. Пациенты были распределены на две группы: с терапией Церебролизином 30 мл (n=76) и с применением плацебо (n=73). Все пациенты имели диагноз вероятной болезни Альцгеймера в соответствии с критериями NINCDS-ADRDA (Mc-Khannetal, 1984), от 14 до 24 баллов по шкале MMSE. Пациенты получали инфузии Церебролизина 30 мл или плацебо в течение 4 нед. В качестве первичных показателей эффективности брали оценку по Шкале оценки болезни Альцгеймера — когнитивный домен (ADAS-cog) (Rosenetal, 1984) и оценку по шкале CGI (Guy, 1976; CIPS, 1986). Показатели вторичного исхода включали короткий синдромальный тест (SKT) (Erzigkeit, 1989), Шкалу оценки депрессии Монтгомери — Асберга (MADR-S) (Montgomery, 1979), подраздел повседневной активности Нюрнбергской возрастной шкалы (NAI) (Oswald, 1980) и поведенческие подразделы шкал ADAS, ADAS-noncog (Rosenetal, 1984).
У пациентов, получавших Церебролизин, после окончания активного лечения было установлено значительное преимущество по шкале CGI в отличие от пациентов, получавших плацебо. Среднее различие в лечении составило 0,42 балла по шкале CGI (P=0,004) в пользу Церебролизина. В отношении шкалы ADAS-cog значительный терапевтический эффект Церебролизина наблюдался через 16 нед. Полученные данные демонстрируют эффективность лечения Церебролизином при умеренной деменции альцгеймеровского типа [22].
24-недельное двойное слепое плацебо-контролируемое исследование применения Церебролизина у пациентов с болезнью Альцгеймера легкой и средней степени тяжести проведено в Испании в 2006 г. (Álvarez Х.А. et al., 2006). В рамках этого исследования 139 пациентов с умеренной и легкой деменцией Альцгеймера были разделены на 3 группы и получали препарат в дозах 10, 30 и 60 мл соответственно, 5 дней в неделю в течение первых 4 нед., а затем по 2 инфузии в неделю в течение 8 нед. Влияние на познавательную способность и клинические общие впечатления оценивали через 4, 12 и 24 нед. после начала инфузии с использованием шкал CIBIC+ и модифицированной шкалы ADAS-cog. На 24-й нед. отмечалось значительное улучшение когнитивных показателей по ADAS-cog у пациентов, получавших Церебролизин в дозах 10, 30 мл [23, 24].
В многоцентровом двойном слепом плацебо-контролируемом исследовании Bae C.Y. et al. в 2000 г. изучали применение Церебролизина у 53 пациентов с болезнью Альцгеймера. Испытуемой группе (n=34) назначали Церебролизин в дозе 30 мл в/в 1 р./сут 5 дней в неделю в течение 4 нед. Контрольная группа (n=19) получала плацебо. В качестве первичных переменных для статистического анализа использовали шкалы ADAS-cog и CGIS/C. В качестве вторичных переменных применяли шкалу MMSE. После 4 нед. лечения группа Церебролизина демонстрировала значительные улучшения по шкалам ADAS-cog, CGIS/C и MMSE в отличие от контрольной группы [25].
В многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном в Китае (Xiao et al., 2000), было выявлено достоверно более значимое влияние Церебролизина в дозе 30 мл/сут (5 дней в неделю) на когнитивные функции у пациентов с болезнью Альцгеймера слабой и средней тяжести. В исследовании участвовали 157 пациентов в возрасте от 55 до 85 лет. Результаты оценивали по шкале MMSE, Гериатрической шкале клинической оценки Сандоз (SCAG), Шкале Гамильтона для оценки депрессии (HDRS), Nuremberg Activities Inventory (NAI), повседневной активности, модифицированной Trail Making Test (ZVT). Пациенты, получавшие Церебролизин, демонстрировали статистически значимое (p
Заключение
Обзор представленных выше исследований демонстрирует эффективность нейропептидного препарата Церебролизин (в дозе от 10 до 30 мл не менее 20 инфузий) в терапии умеренных когнитивных нарушений и легкой деменции сосудистого и нейродегенеративного генеза.
Для более четкого определения места Церебролизина в лечении болезни Альцгеймера и сосудистой деменции необходимы дальнейшие исследования, большей продолжительности и с более глубоким изучением применения Церебролизина в сочетании с ингибиторами холинэстеразы [27].
Информация с rmj.ru






