Неалкогольная жировая болезнь печени: возможности диагностики
Содержание статьи
Актуальность
На протяжении последних лет неалкогольная жировая болезнь печени (НАЖБП) является самой частой формой хронической диффузной патологии печени повсеместно. Так, ее распространенность в мире за 20-летний период увеличилась вдвое и на сегодняшний день, по данным различных авторов, составляет более 40% среди населения развитых стран, в то время как количество других хронических заболеваний печени (ХЗП) значимо не изменилось. В Российской Федерации НАЖБП занимает лидирующее место среди заболеваний внутренних органов, достигая 37,1%. У 95% пациентов НАЖБП диагностируется на фоне морбидного ожирения, однако в 9% случаев заболевание встречается у лиц с нормальным индексом массы тела. Также в работах российских исследователей последних лет показана высокая распространенность сердечно-сосудистых факторов риска у больных НАЖБП, среди которых выделяют: дислипидемию — 75,9%, артериальную гипертензию (АГ) — 69,9%, гиперхолестеринемию — 68,8% и пр. Известно, что подобные факторы риска выступают основными причинами смерти пациентов с НАЖБП. Другая характерная ее особенность — длительное и бессимптомное течение [1–6].
Поскольку НАЖБП является междисциплинарной проблемой, то знания о ней необходимы в повседневной практике не только гепатологам, гастроэнтерологам, терапевтам, но и кардиологам, эндокринологам, а также врачам смежных специальностей, что определяет высокую потребность унифицированных стандартов по диагностике, лечению и профилактике данной патологии для практикующих врачей. Так, своевременная диагностика клинических проявлений НАЖБП и ассоциированных с ней состояний принципиально важна, поскольку зачастую на начальных этапах развития болезнь носит потенциально обратимый характер [3].
НАЖБП как фактор риска развития сердечно-сосудистых осложнений
На сегодняшний день помимо традиционных факторов риска развития сердечно-сосудистых осложнений (ССО) НАЖБП, таких как ожирение, сахарный диабет (СД), метаболический синдром и пр., выделяют новые, или замещающие факторы: увеличение толщины перикардиального жира, эндотелиальная и митохондриальная дисфункции, утолщение комплекса интима-медиа, повышенный уровень С-реактивного белка, пол, возраст, АГ, гиперлипидемия и курение. Упомянутые факторы, по современным представлениям, не меньше ассоциированы с риском развития сердечно-сосудистых заболеваний, чем традиционные, что определяет НАЖБП как предиктор развития ССО независимо от других факторов риска. В связи с этим круг заболеваний, который формирует НАЖБП, заметно расширяется и включает не только стеатоз, стеатогепатит, фиброз и цирроз печени (ЦП), но и АГ, ишемическую болезнь сердца, инфаркт миокарда и сердечную недостаточность [4, 7–11].
Такие разнообразные клинические проявления НАЖБП являются определяющими факторами полиморбидности, что способствует поздней диагностике этого заболевания [3, 10, 12, 13].
Диагностика НАЖБП
Для диагностики заболевания необходимо использовать все доступные методы, включающие: тщательный расспрос пациента, осмотр, исследование крови (общий и биохимический анализы, тест ФиброМакс, теломерный тест), инструментальные исследования (13С-метацетин дыхательный тест, УЗИ, эластография, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), биопсия), что позволяет верифицировать гепатомегалию, косвенно оценить степень стеатоза печени и зарегистрировать формирование портальной гипертензии [3, 15, 17–19].
Клинические данные
Как правило, на стадии стеатоза клинические проявления и жалобы отсутствуют. На стадии стеатогепатита отмечаются жалобы неспецифического характера, такие как: слабость, утомляемость, дискомфорт и тяжесть в правом подреберье без четкой связи с приемом пищи, по интенсивности не коррелирующие со степенью активности процесса. На стадии фиброза клинические проявления опосредованы возникновением спленомегалии (анемии, лейкопении, тромбоцитопении), развитием портальной гипертензии, что, в свою очередь, затрудняет диагностику. Не исключены кровотечения из варикозно расширенных вен пищевода, что зачастую рассматривается как проявление ЦП. Только на стадии ЦП появляются симптомы, указывающие на развитие печеночно-клеточной недостаточности, портальной гипертензии, проявляющиеся увеличением размера живота, отеками, расширением вен пищевода и желудка, умеренной желтухой, повышенной кровоточивостью и т. д. [3, 9, 10, 18, 19].
Клиническое и биохимическое исследование крови
Изменения показателей клинического и биохимического исследований крови также являются неспецифичными. Как правило, у пациентов со стеатозом они соответствуют референсным значениям. Однако при нормальном уровне трансаминаз не исключена вероятность некротически воспалительных изменений в печени. И напротив, степень их активности не имеет достоверной связи с выраженностью стеатогепатита и/или фиброза печени. Так, у пациентов с неалкогольным стеатогепатитом (НАСГ) отмечаются повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) у 50–90% больных, щелочной фосфатазы и гамма-глутамилтранспептидазы (ГГТ) у 30–60%, дислипидемия — у 12–17%, гипергликемия (нарушение толерантности к глюкозе или СД 2 типа) — у 60–65%, гипоальбуминемия и гипербилирубинемия — у 12–18%. Для оценки метаболических факторов риска, помимо определения липидного профиля и уровня глюкозы крови, целесообразна оценка уровня мочевой кислоты и определение индекса инсулинорезистентности (HOMA-IR) [8, 14, 17–19].
На этапе формирования ЦП наблюдается преобладание АСТ над АЛТ, а также определяются лабораторные признаки нарушения белково-синтетической функции печени за счет снижения уровня общего белка, альбумина, холестерина, холинэстеразы и протромбинового индекса. Кроме того, возможны нарушения метаболизма железа за счет повышения уровня ферритина и насыщения трансферрина сыворотки, не связанные с наследственным гемохроматозом [18, 19].
Одним из маркеров НАЖБП может быть содержание в сыворотке крови фрагментов белка филамента цитокератина-18, образующегося при апоптозе в результате его расщепления активированными каспазами гепатоцитов. Повышение уровня фрагментов цитокератина-18 специфично для стеатогепатита, что позволяет дифференцировать его от стеатоза [18, 19].
Неинвазивные диагностические тесты
С целью верификации степени выраженности некротически-воспалительных изменений на фоне ХЗП как альтернатива биопсии печени разработан расчетный неинвазивный диагностический тест ФиброМакс. Он основан на ряде биохимических показателей крови: уровня альфа2-макроглобулина, гаптоглобина, аполипопротеина А1, ГГТ, общего билирубина и включает оценку активности процесса, определение стадии фиброза и тяжести стеатоза и стеатогепатита (табл. 1). Исследование выполняют строго натощак, рекомендуется не принимать пищу за 8–12 ч до забора крови. В направлении на анализ указывают антропометрические параметры пациента: возраст, пол, рост (м) и вес (кг). В течение 2 дней перед исследованием нельзя есть жареную, копченую, жирную пищу и употреблять алкоголь. За 12 ч до проведения теста должна быть ограничена физическая активность и исключено курение [3, 14, 19, 22].
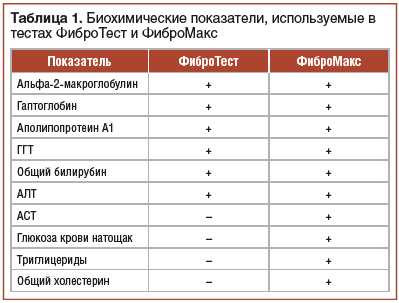
Тест ФиброМакс представляет собой сочетание 5 расчетных алгоритмов, направленных на диагностику:
степени тяжести фиброза печени с переводом в систему METAVIR (F0, фиброз — F1, F2, F3, ЦП — F4) — ФиброТест (FibroTest);
степени некротически-воспалительного процесса (А0, А1, А2, А3) — АктиТест (ActiTest);
стеатоза печени — СтеатоТест (SteatoTest);
тяжелого алкогольного стеатогепатита у лиц, употребляющих алкоголь в чрезмерном количестве, — АшТест (AshTest);
НАСГ у пациентов с избыточной массой тела, резистентностью к инсулину, гиперлипидемией, а также больных СД — НашТест (NashTest).
Все результаты теста находятся в пределах от нуля до единицы. Показатель зависит от тяжести заболевания — уровня активности ActiTest. Результаты переведены в систему METAVIR: FibroTest F0–F4, ActiTest А0–А3, SteatoTest S0–S3 (4), NashTest N0–N2, AshTest Н0–Н3.
Для показателей ФиброТеста и АктиТеста используется общий принцип. Если значение находится в зеленой зоне, то фиброз печени отсутствует или его выраженность минимальна, в желтой и оранжевой зонах — умеренно выраженный фиброз, в красной зоне — выраженный фиброз.
СтеатоТест отражает степень стеатоза — жирового перерождения печени. Интерпретация по цветовой диаграмме проводится аналогично: зеленая зона — стеатоза нет, оранжевая (желтая) — минимальный или умеренный стеатоз, красная — стеатозом поражено 33–100% гепатоцитов.
АшТест и НашТест — интерпретируются аналогично предыдущим тестам.
Преимуществами тестов ФиброМакс и ФиброТест являются возможность количественной и качественной оценки стадий фиброза печени, стеатоза, стеатогепатита, активности некротически-воспалительного процесса, а также возможность диагностики алкогольного стеатогепатита [1, 8, 9, 13].
На сегодняшний день существуют и другие расчетные тесты, также используемые для оценки выраженности фиброза: шкала BARD, шкала фиброза при НАЖБП (NAFLD fibrosis score), FIB 4 и APRI, результаты которых рассчитываются при помощи онлайн-калькуляторов. Однако результаты этих тестов недостаточно точны и информативны, требуется дальнейшее подтверждение диагноза. Для диагностики НАЖБП также используют тест ФиброМетр, содержащий прямые и непрямые маркеры фиброза. ФиброМетр позволяет дифференцировать умеренный фиброз (F1–F2) от выраженного фиброза (F3) и от ЦП (F4). Его результат определяют 5 показателей биохимического и клинического анализов крови: альфа-2-макроглобулин, ГГТ, мочевина, протромбиновый индекс (%), тромбоциты, которые определяют выраженность фиброза при помощи дискриминантной функции [3, 14, 17, 19, 21, 22].
Среди неинвазивных методов определения функциональной активности печени, а именно ее функционального резерва, сегодня используют 13С-метацетин дыхательный тест.Он основан на способности ферментной системы гепатоцитов (цитохром Р450 1А2) метаболизировать вещества, меченные стабильным изотопом углерода (13С), что позволяет дифференцировать НАЖБП и НАСГ, а такжеопределять степень фиброза печени [17, 22].
Инструментальные методы диагностики НАЖБП
Наибольшее распространение в диагностике НАЖБП ввиду доступности получило УЗИ, которое может быть единственным методом, позволяющим заподозрить стеатоз печени, особенно при наличии у больного факторов риска развития НАЖБП. УЗИ печени позволяет верифицировать наличие гепатомегалии, косвенно оценить степень выраженности стеатоза печени, а также выявить признаки формирования портальной гипертензии. Признаками НАЖБП при УЗИ являются: диффузное увеличение печеночной паренхимы (при этом эхогенность печени выше, чем почек), нечеткость сосудистого рисунка и дистальное затухание эхосигнала. Если содержание жира в печени превышает 30%, этот метод характеризуется высокой диагностической точностью в выявлении НАЖБП. Так, согласно методике, предложенной С.С. Бацковым, в зависимости от выраженности эхографических признаков (наличия гепатомегалии и спленомегалии, визуализации печеночных вен, дистального затухания звука, оценки гиперэхогенности паренхимы печени, визуализации диафрагмального контура, оценки ангиоархитектоники печеночных вен, диаметра воротной вены) выделяют 4 степени стеатоза. К сожалению, УЗИ не позволяет с большой долей вероятности дифференцировать жировой гепатоз от НАСГ или определить степень фиброза печени [3, 17–19, 23].
Для выявления стадии фиброза используют эластометрию, или фибросканирование. Методика основана на определении скорости распространения в ткани печени упругой волны, характеризующейся низкой частотой и малой амплитудой. УЗ-сигналы измеряют скорость распространения упругой волны в печени, которая прямо пропорциональна жесткости среды. Чем больше плотность печени, тем ниже эластичность и выше скорость распространения волны. Среди недостатков методики — отсутствие возможности оценки выраженности некротически-воспалительного процесса, малая информативность у пациентов с избытком подкожного жирового слоя, трудности оценки стеатоза и фиброза на ранних стадиях развития [3, 17–19, 23].
Также в диагностике НАЖБП широко применяют КТ и МРТ. КТ печени направлена на косвенную оценку степени стеатоза. В целом при диффузных поражениях печени КТ менее информативна, чем УЗИ, однако она является методом выбора для верификации поражений печени. Основными признаками НАЖБП при КТ являются: снижение рентгенологической плотности печени на 3–5 HU (норма 50–75 HU); более высокая рентгенологическая плотность селезенки, чем печени, а также внутрипеченочных сосудов, воротной и нижней полой вен по сравнению с плотностью печеночной ткани; пересечение нормальными кровеносными сосудами печени зон пониженной рентгеноконтрастности, что является характерным признаком очаговой жировой дистрофии. МРТ печени с использованием фазового контрастного препарата позволяет оценить количественное содержание жировой ткани. Очаги снижения интенсивности сигнала на Т1-взвешенных изображениях могут свидетельствовать о локальном накоплении жира в печени. Однако МРТ редко используется в клинической практике из-за высокой стоимости и длительности выполнения исследования [3, 17–19, 23].
Гистоморфологическое исследование биоптатов печени
Полноценно о переходе стеатоза печени в НАСГ нельзя судить, опираясь лишь на жалобы, результаты лабораторных исследований и лучевой диагностики. В связи с этим по-прежнему «золотым стандартом» и надежным инструментом для верификации стеатоза и НАСГ считается гистоморфологическое исследование биоптатов печени. Проведение биопсии печени может быть необходимым для установления альтернативного диагноза НАЖБП. Пункционная биопсия печени проводится с целью оценки некротически-воспалительной активности заболевания, степени стеатоза, стадии и распространенности фиброза печени, а также для контроля эффективности лекарственной терапии. Для морфологической оценки активности, степени стеатоза и стадии фиброза печени у больных НАЖБП используется система, предложенная Е. Brunt (1999 г.) [3, 18, 19].
Выделяют 2 типа морфологической картины стеатоза: крупнокапельное и мелкокапельное ожирение. У больных НАЖБП чаще встречается крупнокапельное ожирение, для которого характерно наличие одной большой вакуоли жира в гепатоците, оттесняющей его ядро к периферии клетки. Реже наблюдается мелкокапельное ожирение с характерным наличием множества мелких вакуолей жира вокруг ядра гепатоцита, которое сохраняет центральное положение в клетке. Зачастую отмечаются признаки того и другого типа ожирения. Морфологическая картина НАСГ характеризуется наличием крупнокапельной жировой дистрофии гепатоцитов, преимущественно в 3-й зоне ацинуса, имеющей вид крупных одиночных липидных капель в цитоплазме со смещением ядра к периферии клетки. Проявления жировой дистрофии часто сочетаются с баллонной дистрофией гепатоцитов. Воспалительная реакция, как правило, мягкая, представлена преимущественно внутридольковыми инфильтратами, более выраженными, чем инфильтрация портальных трактов, состоящими из полиморфноядерных лейкоцитов, лимфоцитов и мононуклеарных фагоцитов. Тельца Мэллори обнаруживаются не во всех случаях и в количестве меньшем, чем при алкогольном гепатите [5, 24].
В ранней стадии выявляется перисинусоидальный и/или перицеллюлярный фиброз в 3-й зоне ацинуса, который в дальнейшем может прогрессировать с образованием септ и формированием ЦП. Кроме того, для НАСГ характерны наличие жировых кист, «оптически пустых» ядер гепатоцитов, липогранулем, мегамитохондрий в гепатоцитах, небольшое отложение железа в 1-й зоне ацинуса. Достоверная связь между содержанием железа в печени при НАЖБП, степенью гистологической активности и стадией фиброза не установлена. Важно, что IV стадия фиброза печени (по системе E. Brunt — ЦП) сопровождается значительным уменьшением содержания жира в гепатоцитах при сохранении баллонной дистрофии. При прогрессировании процесса возможно изменение соотношения лобулярного и портального воспаления, что значительно затрудняет диагностику НАСГ с исходом в ЦП [18, 19, 24].
Изучение длины теломер
В последние годы появились научные работы по изучению длины теломер в прогнозе течения ХЗП. Теломеры — концевые участки хромосом, которые состоят из повторяющихся последовательностей нуклеотидов. При каждом делении клетки происходит непрерывное укорочение теломер, что ограничивает количество клеточных делений стволовых клеток человека и влияет на способность регенерации систем органов в процессе старения и течения хронических заболеваний. Возникло предположение, что укорочение теломер может быть генетическим фактором быстрого развития фиброза и ЦП. Исследования длины теломер у пациентов с заболеваниями печени различной этиологии продемонстрировали постепенное сокращение их длины в гепатоцитах по мере прогрессирования заболевания и развития фиброза. Подобные изменения можно рассматривать как прогностический признак формирования ЦП. Теломерный тест можно использовать для составления прогноза не только течения заболевания, но и времени ответа на проводимую терапию [19, 25, 26].
Заключение
Подводя итог обзора основных методов диагностики НАЖБП, необходимо отметить, что на сегодняшний день отсутствует унифицированный способ верификации этого заболевания. Поскольку НАЖБП присуща полиморбидность, то для формулировки полноценного клинического диагноза необходимо проведение комплексного обследования, включающего несколько разноплановых методов диагностики, как клинико-лабораторных, так и инструментальных. Своевременное выявление факторов риска, способствующих развитию заболевания, и своевременная диагностика НАЖБП позволят подобрать оптимальные варианты терапии и профилактики, препятствующие дальнейшему прогрессированию патологии печени и ассоциированных с ней состояний.
Информация с rmj.ru





