Содержание статьи
Введение
Распространенность фибрилляции предсердий (ФП) / трепетания предсердий (ТП) во всем мире давно приобрела пандемический характер. Цели ее лечения сфокусированы как на улучшении качества жизни пациентов, так и, в первую очередь, на прогнозе их жизни. В клинических рекомендациях Минздрава России и Европейского общества кардиологов 2020 г. по лечению ФП борьба за достижение синусового ритма фигурирует как сугубо симптоматическое лечение [1, 2]. Эта концепция обоснована рядом исследований, продемонстрировавших равноценность стратегий «контроля ритма» и «контроля частоты» в отношении влияния на прогноз пациентов с ФП [3–7]. Однако результаты крупного проспективного многоцентрового исследования EAST-AFNET убедительно доказали преимущество ранней (в течение 1 года после постановки диагноза ФП) стратегии «контроля ритма» по влиянию на сердечно-сосудистую смертность, риск острого нарушения мозгового кровообращения, госпитализаций в связи с острым коронарным синдромом и декомпенсацией хронической сердечной недостаточности [8].
По всей видимости, использование более эффективных и безопасных антиаритмических препаратов могло бы еще в большей степени склонить чашу весов в пользу подхода «контроля ритма» как метода, позволяющего достигать большей толерантности к нагрузкам, особенно у молодых пациентов, лучшего качества жизни, и при этом благоприятно влиять на ее прогноз.
В последние годы в фокусе исследовательских разработок находятся антиаритмические препараты III класса. Их действие противоположно процессам, имеющим место при электрическом ремоделировании предсердий на фоне ФП, а именно укорочению их эффективного рефрактерного периода (ЭРП). Замедление реполяризации миокарда желудочков под действием препаратов этого класса проявляется на электрокардиограмме (ЭКГ) удлинением интервала QT/QTc, что потенциально сопряжено с возрастанием риска полиморфной желудочковой тахикардии типа «пируэт» или Torsade de pointes (TdP). Соотношение эффективности в купировании и предотвращении возникновения ФП/ТП и безопасности в отношении провокации TdP большинства доступных антиаритмических препаратов (ААП) III класса не представляется удовлетворительным.
Кавутилид
Около 20 лет назад во Всесоюзном научно-исследовательском химико-фармацевтическом институте (ВНИХФИ) им. С. Орджоникидзе было получено соединение 1-n-фторфенил-1-n-нитробензоиламина-2-(N-этилперидил-4)-этана гидрохлорид (±)N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамида гидрохлорид [9] (рис. 1), которое различные этапы доклинических испытаний проходило под названием РГ-2, фениридин, фазу I клинических испытаний (КИ) — как фениридин, фазы II и III — как ниферидил и в 2014 г. было зарегистрировано в Государственном реестре лекарственных средств под торговым наименованием Рефралон®.
![Рис. 1. Химическая формула 1-n-фторфенил-1-n-нитро- бензоиламина-2-(N-этилперидил-4)-этана гидрохлорид (±) N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамида гидрохлорида Рис. 1. Химическая формула 1-n-фторфенил-1-n-нитро- бензоиламина-2-(N-этилперидил-4)-этана гидрохлорид (±) N-1[-(4-фторфенил)-2-(1-этил-4-пиперидил)-этил]-4-нитробензамида гидрохлорида](https://medblog.su/wp-content/uploads/2023/12/Nakoplennyj-opyt-i-novye-perspektivy-primeneniya-antiaritmicheskogo-preparata-kavutilid.png)
В 2023 г. комиссия Всемирной организации здравоохранения рекомендовала присвоение данному препарату международного непатентованного названия «кавутилид» (cavutilide).
Доклинические исследования кавутилида
Доклинические испытания препарата были выполнены в лаборатории электрофизиологии сердца ФГБУ РКНПК под руководством академика Л.В. Розенштрауха.
Кавутилид значительно увеличивал длительность потенциала действия за счет замедления конечной фазы реполяризации в предсердиях, при этом в диапазоне исследованных концентраций не изменял потенциала покоя и амплитуды потенциала действия. Лекарственное средство подавляло калиевый ток задержанного выпрямления Ik и снижало входящий кальциевый ток большой проводимости IСа, L, вызывая незначительное снижение частоты синусового ритма (СР) [10, 11]. Кавутилид не влиял на кратковременный выходящий ток Ito и калиевый ток аномального выпрямления IK1. Кроме того, препарат оказывал антихолинергическое действие, что может иметь особое значение при ФП, связанной с активацией парасимпатических влияний на сердце. В диапазоне доз от 20 до 40 мкг/кг лекарственное средство незначительно удлиняло интервал QT, однако при увеличении дозы до 80 мкг/кг дальнейшего увеличения интервала QT не происходило [11, 12]. Кавутилид в дозах 20 и 40 мкг/кг не влиял на скорость проведения возбуждения по предсердиям, атриовентрикулярному (АВ) узлу и системе Гиса — Пуркинье, не изменял продолжительность интервала PQ и комплекса QRS [13].
Было показано превосходство кавутилида над другими ААП III класса, а именно его доза, при которой начинал изменяться порог фибрилляции, была в 100 раз меньше, чем у сематилида (не зарегистрирован в РФ), в 25 раз меньше, чем у нитрофенилдиэтиламинопентилбензамида (нибентан), и сопоставима с дофетилидом (не зарегистрирован в РФ). Отмечена дозозависимая эффективность кавутилида в купировании и предотвращении ФП [14]. Зафиксировано неодинаковое действие лекарственного средства в пределах предсердий: оно в большей степени удлиняло рефрактерные периоды волокон муфт легочных вен в сравнении с волокнами предсердий [15]. Роль устьев легочных вен как важнейших факторов запуска и поддержания ФП в настоящее время достаточно прочно обоснована [16, 17], и направленное действие кавутилида на эти области указывает на его высокий антиаритмический потенциал при ФП.
Кавутилид не проявлял аллергизирующих свойств, был не канцерогенен, не обладал мутагенными и тератогенными свойствами и эмбриотоксическим действием, что предполагало возможность для его выпуска не только в инъекционной, но и в таблетированной лекарственной форме для длительного применения [9, 18]. Полученные в экспериментальном исследовании данные позволили предположить, что в диапазоне доз от 5 до 40 мкг/кг внутривенно (а это исключительно низкие дозы) лекарственное средство должно проявлять антиаритмическое действие при ФП у человека [10, 14], будучи при этом в достаточной степени безопасным.
Клинические испытания кавутилида
Описанные результаты были подтверждены в ходе I фазы клинических исследований. Во время внутрисердечного электрофизиологического исследования (ЭФИ) проводилось введение кавутилида пациентам без органической патологии сердца в/в в дозах 5–20 мкг/кг. Не выявлено существенных изменений автоматической функции синусового узла (СУ), предсердной и предсердно-желудочковой проводимости, продолжительности интервалов PQ и QRS. При использовании в дозах 5 или 10 мкг/кг рефрактерность предсердий и желудочков существенно не изменилась. При введении 15 или 20 мкг/кг кавутилида отмечалось существенное увеличение рефрактерных периодов предсердий и желудочков. Причем, как и в доклинических испытаниях, ЭРП правого желудочка изменялся в меньшей степени (на 22,6%) по сравнению с ЭРП обоих предсердий (на 29% в правом и на 38% в левом). Одновременно отмечен прирост продолжительности интервала QT на ЭКГ на 22%, а у половины пациентов зарегистрирована U-волна. Отмечено слабовыраженное урежение сердечного ритма только при введении 20 мкг/кг кавутилида. Препарат в исследуемых дозах 5–20 мкг/кг хорошо переносился, не выявлено побочных, в том числе проаритмических, эффектов, влияния на АД [19].
II фаза КИ была выполнена в ФГБУ РКНПК Минздрава России. В нее было включено 40 пациентов с персистирующей формой ФП/ТП (со средней продолжительностью эпизода аритмии 4,9±4,5 мес. (от 2 нед. до 12 мес.)) и без органической патологии сердца, нарушений проводимости сердца, стандартных противопоказаний к назначению ААП III класса и проведению медикаментозной кардиоверсии. Исследование было выполнено как открытое нерандомизированное (сравнение «до — после») клиническое испытание без группы сравнения. Введение кавутилида происходило в виде 3 последовательных болюсов по 10 мкг/кг массы тела пациента каждый. Следующий болюс вводился при сохранении ФП/ТП по истечении 15 мин после введения предыдущего при исключении противопоказаний, преимущественно на ЭКГ (рис. 2).
![Рис. 2. Трехэтапная схема введения кавутилида внутривенно [23] Рис. 2. Трехэтапная схема введения кавутилида внутривенно [23]](https://medblog.su/wp-content/uploads/2023/12/1703098304_563_Nakoplennyj-opyt-i-novye-perspektivy-primeneniya-antiaritmicheskogo-preparata-kavutilid.png)
Антиаритмическая эффективность кавутилида составила: в дозе 10 мкг/кг — 55%, в дозе до 20 мкг/кг — 70%, в дозе до 30 мкг/кг — 90%. Удлинение интервала QTс более 500 мс после купирования аритмии зарегистрировано у 16,7% пациентов. Случаев TdP не отмечено [20].
Отдельным разделом II фазы клинических испытаний препарата было изучение его эффективности в купировании и предотвращении индукции наджелудочковых тахикардий в условиях внутрисердечного ЭФИ. В исследование включено 30 пациентов. Эффективность болюса 20 мкг/кг кавутилида в купировании АВ-узловой реципрокной тахикардии составила 85,7%, а в предотвращении ее индукции — 100%. Кавутилид купировал пароксизмальную ортодромную реципрокную тахикардию при WPW-синдроме в 72,7% случаев и предупреждал ее индукцию в 84,6% [21]. Под действием кавутилида отмечалось небольшое увеличение длительности среднего сердечного цикла без изменения времени восстановления функции СУ и развития синусовой брадикардии. Зарегистрировано снижение «точки Венкебаха» АВ-узла на 20%. Влияние препарата на эффективный, относительный и функциональный рефрактерные периоды миокарда обоих предсердий в 2 раза превосходило таковое на параметры миокарда верхушки правого желудочка. У больных синдромом WPW кавутилид существенно (в среднем на 30%) увеличил рефрактерность добавочных путей проведения. Препарат не вызывал изменения скорости проведения возбуждения по тканям сердца, не изменял величину интервала PQ и комплекса QRS на фоне СР. У всех пациентов отмечалось увеличение длительности интервалов QT и QTc в среднем на 25,02 и 21,61%. У 1 пациента после введения препарата регистрировалась частая желудочковая экстрасистолия и неустойчивые эпизоды TdP. Также введение кавутилида приводило к возрастанию рефрактерности системы Гиса — Пуркинье, это проявлялось в виде частотно-зависимого увеличения продолжительности комплекса QRS. Таким образом, было показано, что кавутилид в дозе 20 мкг/кг эффективно купирует не только ФП/ТП, но и пароксизмальные наджелудочковые тахикардии (НЖТ) [22].
Дизайн III фазы КИ в 2011–2013 гг. был аналогичен таковому II фазы, однако в исследовании принимали участие еще 2 клинических центра в Москве и Санкт-Петербурге, также в исследование включались больные ишемической болезнью сердца, с инфарктом в анамнезе, умеренно сниженной фракцией выброса левого желудочка (до 40%), недостаточностью кровообращения I–II ФК. В исследование было включено 132 пациента, медиана продолжительности текущего эпизода ФП/ТП составила 3 [1,5; 6] мес. (данные представлены как Me [Q1; Q3]). Результаты исследования подтвердили данные, полученные в ходе II фазы испытаний. Введение кавутилида в дозах 10–30 мкг/кг позволило восстановить СР у 85% включенных пациентов. Эффективность препарата при ТП составила 95%, а при ФП — 82%. У 47% пациентов для купирования аритмии понадобился 1 болюс препарата, у 15% — 2 болюса, у 23% пациентов СР был восстановлен после введения 3 болюсов кавутилида, у 15% купирования аритмии не произошло. Восстановление СР в 83% случаев происходило в первый час после введения препарата, в 17% случаев в срок до 24 ч.
Среди всех пациентов с ФП медиана времени до купирования аритмии составила 16 (7–52) мин, а у пациентов с ТП — 12 (8–19) мин. Средняя доза, необходимая для купирования ФП, составила 18±10 мкг/кг и существенно превысила среднюю эффективную дозу в отношении восстановления СР при ТП — 13±5 мкг/кг [23–25]. Высокая для ААП III класса эффективность кавутилида в купировании ТП, по всей видимости, связана с существенным увеличением рефрактерности предсердий, достаточным для прерывания аритмий, как с коротким возбудимым «окном» (ФП), так и с длинным (ТП).
На рисунке 2 представлена трехэтапная схема введения кавутилида [23].
Продолжительность интервала QT после восстановления СР превысила 500 мс у 9% пациентов, которым был введен 1 болюс кавутилида, у 22% больных после 2 болюсов препарата и у 11,5% после введения его максимальной дозы [25]. При оценке динамики интервалов QT и QTc по данным суточного мониторирования ЭКГ по Холтеру (ХМЭКГ) после введения кавутилида было показано, что препарат вызывает умеренное удлинение интервалов QT и QTc, более выраженное в случае использования доз 20 и 30 мкг/кг. При введении минимальной дозы 10 мкг/кг снижение продолжительности интервала QT до нормальных значений происходит к 3 ч, а в случае использования 20 и 30 мкг/кг — только к 22 ч наблюдения. Длительность интервала QTc после введения 1 болюса препарата нормализуется к 21 ч после введения, а при использовании 2 или 3 болюсов величина QTc не достигает нормальных значений до конца суток мониторирования.
У 8,3% пациентов зарегистрированы пробежки желудочковой тахикардии после введения кавутилида, при этом в 1,5% случаев речь шла о бессимптомных неустойчивых эпизодах TdP, не требовавших проведения электрической кардиоверсии (ЭКВ). У 2 пациентов отмечено увеличение общего количества желудочковых экстрасистол по данным ХМЭКГ после введения препарата. Нарушения функции СУ в виде пауз более 3 с или брадикардии с частотой сердечных сокращений менее 50 в 1 мин при купировании аритмии регистрировались у 10 пациентов, у 9 из них были бессимптомными: у 4 (6,5%) из 62 пациентов после дозы 10 мкг/кг кавутилида, у 2 (10%) из 20 пациентов после 20 мкг/кг, у 4 (13%) из 30 пациентов, получивших 30 мкг/кг. Данные нежелательные явления расценены как постконверсионная дисфункция СУ, которая нередко имеет место и после купирования персистирующей аритмии посредством ЭКВ.
Характерным ЭКГ-проявлением фармакодинамических эффектов кавутилида является появление частотно-зависимого расширения (аберрации) комплексов QRS на фоне ФП/ТП или, после купирования аритмии, в эктопических наджелудочковых сокращениях. Как уже было доказано в ходе II фазы испытаний, этот феномен не является проявлением проаритмического действия препарата или предвестником его развития. Частота его регистрации составляет 71–90% [20–25]. После введения кавутилида в большей части случаев отмечается переход высокочастотной хаотичной предсердной активности (волн f) при ФП в более регулярную и низкочастотную — ТП. Это явление часто предшествует купированию аритмии [23].
В 2014 г. препарат под торговым названием Рефралон® был внесен в Государственный реестр лекарственных средств, а после этого — в Клинические рекомендации по диагностике и лечению ФП Минздрава России (2020 г., пересмотр в 2023 г.) [1], а также Евразийской ассоциации кардиологов [26].
Пострегистрационный опыт применения кавутилида
Пострегистрационный опыт использования препарата был оценен в ретроспективном многоцентровом когортном исследовании, суммировавшем результаты использования препарата в 2014–2019 гг. и включившем 727 больных. Одной из задач исследования было сравнение эффективности и безопасности кавутилида при использовании его в НМИЦ кардиологии (в качестве первичного клинического центра, имеющего максимальный опыт применения препарата) и результатов, полученных в 7 других центрах в 6 городах РФ в условиях рутинной клинической практики [27, 28]. Была продемонстрирована абсолютная сопоставимость по эффективности и безопасности применения кавутилида в НМИЦ кардиологии и других центрах, даже с некоторым преимуществом последних. Так, медикаментозная кардиоверсия (МКВ) была эффективна у 402 (89%) из 451 пациента первичного центра и у 264 (96%) из 276 пациентов остальных медицинских центров. При этом эффективность 1 и 3 болюсов в группе 7 клинических центров достоверно превышала таковую в первичном центре (рис. 3).
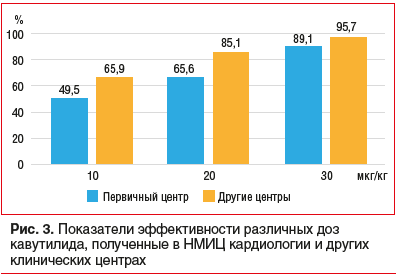
Важным аспектом кардиоверсии, помимо собственно факта купирования аритмии, является отсутствие ранних (в течение первых суток) ее рецидивов. У больных первичного центра ранние рецидивы ФП/ТП зарегистрированы у 29 (7,2%) из 402 пациентов и были устойчивыми (не купировались по истечении суток наблюдения) у 12 (3%) из 402 пациентов. Среди пациентов других стационаров рецидив аритмии после успешной МКВ возникал у 9 (3,4%) из 264 больных, аритмия через 24 ч от начала введения кавутилида сохранялась у 4 (1,5%) из 264 больных. Эти показатели достоверно не отличались в группах НМИЦ кардиологии и других центров [27].
При анализе безопасности использования кавутилида существенных различий по всем исследуемым показателям выявлено не было. Паузы длительностью >3,0 с зарегистрированы у 24 (5%) из 451, а брадикардия — у 37 (8%) из 451 пациента НМИЦ кардиологии, для других центров соответствующие показатели составили 4% (у 11 из 276 лиц) и 6% (у 17 из 276). Среди всех больных у 1,7% (n=12) впоследствии был диагностирован синдром слабости СУ, им была выполнена имплантация электрокардиостимулятора. Удлинение интервала QT более 500 мс отмечалось у 21,1% (n=95) пациентов первичного центра и у 15,6% (n=43) в других центрах. TdP была зарегистрирована у 2 (n=9) и 1,1% (n=3) пациентов первичного центра и остальных центров соответственно. В 0,5% случаев требовалось проведение электрической кардиоверсии для купирования TdP [28].
С учетом крайне недостаточной эффективности доступных антиаритмических препаратов в купировании персистирующей формы ФП/ТП основным используемым с этой целью методом, признанным «золотым стандартом», длительное время оставалась только ЭКВ. Она позволяет мгновенно купировать аритмию длительностью более 7 сут в 70–90% случаев [29], однако ее проведение сопровождается всеми рисками, связанными с потребностью во в/в седации, электротравмой сердца, необходимостью обеспечения безопасной работы имплантированных устройств у части пациентов и риском ранних рецидивов аритмии в отсутствие профилактической антиаритмической терапии. В 2018 г. опубликованы результаты небольшого рандомизированного исследования по сравнению эффективности и безопасности ЭКВ и МКВ кавутилидом у пациентов с персистирующей формой ФП/ТП [30, 31]. В каждую группу было включено по 30 пациентов. СР был восстановлен у 27 (90%) из 30 больных посредством ЭКВ и у 28 (93,3%) из 30 больных введением кавутилида. В группе ЭКВ зарегистрирован рецидив аритмии у 1 больного, у всех больных группы МКВ сохранялся стойкий СР до конца суток наблюдения. После восстановления СР кавутилидом у 23,3% (7 из 30) зарегистрировано удлинение интервала QT>500 мс, а среди пациентов, подвергнутых ЭКВ, — у 3,3% (1 из 30) случаев, различия были достоверны. В обеих группах в 3,3% случаев после восстановления СР отмечалась бессимптомная синусовая брадикардия, не потребовавшая какого-либо вмешательства. Паузы более 3 с, TdP и другие значимые нежелательные явления не зарегистрированы ни в одной из групп. Таким образом, продемонстрировано отсутствие различий в эффективности и безопасности ЭКВ или медикаментозной кардиоверсии кавутилидом в купировании персистирующей формы ФП/ТП. Ожидаемое более частое удлинение интервала QT при использовании ААП III класса указывает на необходимость соблюдения мер предосторожности и наблюдения за пациентами во время и после его введения.
Отдельно в рамках указанной работы проводилась оценка влияния метода восстановления СР на параметры внутрисердечной гемодинамики по данным трансторакальной и чреспищеводной эхокардиографии [32]. Было показано, что показатели, отражающие механическую функцию левого предсердия и его ушка, снижаются при МКВ в меньшей степени, чем после ЭКВ. Тем не менее единственный тромб в ушке левого предсердия выявлен при проведении чреспищеводной эхокардиографии после купирования аритмии кавутилидом. Это еще раз доказывает, что феномен «оглушенных» предсердий имеет место после любого варианта восстановления СР, обусловлен в первую очередь самим фактом длительного персистирования ФП/ТП и лишь усугубляется электрической травмой сердца при ЭКВ.
Закономерным результатом проведенных исследований явилось включение кавутилида в Клинические рекомендации Минздрава России в 2020 г. с рекомендацией использования для купирования ФП любой продолжительности, в том числе персистирующей и длительно персистирующей, и как альтернатива плановой ЭКВ [1], а также в Стандарт оказания медицинской помощи пациентам ФП.
Эффективность ЭКВ снижается при увеличении транс-торакального сопротивления, в частности, при бронхолегочной патологии, ожирении. Так, при массе тела, превышающей 100 кг, ЭКВ позволяет купировать ФП лишь в 25% случаев [33, 34]. В связи с этим в Евразийских клинических рекомендациях по профилактике и лечению сердечно-сосудистых заболеваний у больных с ожирением 2022 г. при необходимости восстановления СР у пациентов с избыточной массой тела и ФП предлагается рассматривать кавутилид в качестве средства первой линии [35].
В ходе III фазы КИ кавутилида было отмечено, что препарат в 75% случаев купировал персистирующую ФП у пациентов с неэффективной ЭКВ, выполненной ранее по поводу текущего эпизода аритмии. Выполненные после этого 2 небольших исследования, включавшие 12 и 26 пациентов с предшествующей неэффективной попыткой ЭКВ с целью купирования текущего эпизода ФП/ТП, продемонстрировали эффект кавутилида в восстановлении СР в 100 и 84,6% случаев соответственно у этой непростой категории больных [36, 37].
Дальнейшие исследования кавутилида были направлены на применение препарата у больных с пароксизмальной формой ФП и использование меньших доз с целью повышения безопасности МКВ. Предшествующий опыт его использования демонстрировал купирование персистирующей ФП/ТП до 60% случаев дозой 10 мкг/кг. В части случаев восстановление СР отмечалось в течение первых минут от начала введения первой дозы, т. е. до полной реализации ее антиаритмической активности. В связи с этим была разработана 4-этапная схема введения препарата (5 мкг/кг — 5 мкг/кг — 10 мкг/кг — 10 мкг/кг), в соответствии с которой общая введенная доза 30 мкг/кг не противоречит существующей инструкции по применению кавутилида. Уже первые результаты использования модифицированного протокола МКВ продемонстрировали успешное купирование персистирующей формы ФП/ТП минимальной дозой 5 мкг/кг в 33% случаев, а при пароксизмальной форме аритмии — в 60% случаев. Эффективность максимальной дозы 30 мкг/кг при персистирующей форме ФП/ТП составила 93%, а при пароксизмальной форме (20 пациентов) — 100% (рис. 4) [38].
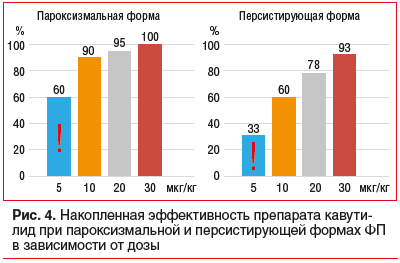
У 16% больных зарегистрировано удлинение интервала QTc более 500 мс, но не было отмечено ни одного случая развития какого-либо варианта желудочкового проаритмогенного действия препарата. Полученные данные доказывают, что 4-этапная схема введения кавутилида позволяет восстановить СР с использованием меньших доз у большего количества больных с сопутствующим снижением проаритмических рисков и без увеличения числа ранних рецидивов ФП/ТП. Кроме того, использование малых доз в 5 мкг/кг, сопровождающееся меньшей степенью удлинения интервала QT (в 1% случаев превышающей 500 мс) и быстрой его нормализацией, позволяет сократить время пребывания пациента в условиях палаты интенсивного наблюдения (ПИН) и рассмотреть вопрос о более раннем назначении поддерживающей противорецидивной антиаритмической терапии [39]. На модифицированный способ в/в введения кавутилида получен патент № 2 728 715(13) C1 [40].
Обнадеживающие результаты вышеприведенного исследования сподвигли ученых на проведение рандомизированного исследования по сравнению МКВ кавутилидом и амиодароном при пароксизмальной форме ФП/ТП. Показано, что эффективность даже минимальной дозы кавутилида 5 мкг/кг (56,7%) достоверно не отличается от максимальной эффективности амиодарона в дозе до 1200 мг/сут (57,1%). А введение кавутилида в максимальной дозе 30 мкг/кг позволяло восстановить СР у 96,7% больных, что почти вдвое превысило эффективность амиодарона. Принципиально важны и сроки достижения эффекта, и, соответственно, пребывания в ПИН и назначения поддерживающей антиаритмической терапии. Медиана времени до купирования ФП после введения кавутилида составила 14 [7; 24] мин, а в группе амиодарона — 600 [120; 1440] мин (p<0,001). Группы достоверно не различались по частоте увеличения продолжительности интервала QT, развития брадиаритмий и гипотонии. Не было зарегистрировано случаев TdP. Таким образом, введение кавутилида по сравнению с амиодароном позволяло значительно чаще и быстрее добиться восстановления СР у больных с устойчивыми пароксизмами ФП/ТП [41].
После купирования аритмии вторым важнейшим моментом в стратегии «контроля ритма» является удержание СР средствами антиаритмической терапии. Немаловажную роль играют сроки начала этой терапии, решение о которых обязательно учитывает аспекты межлекарственного взаимодействия. С целью оценки безопасности раннего назначения противорецидивной терапии после МКВ кавутилидом выполнено исследование, включавшее 247 больных, разделенных на группы раннего (в течение 24 ч) и отсроченного назначения ААП 1C класса и соталола. Частота возникновения нежелательных эффектов, как и частота ранних рецидивов аритмии, достоверно не различались между группами. Однако продолжительность госпитализации была достоверно меньше в группе раннего назначения ААП [39].
Ввиду все возрастающей распространенности методов интервенционного лечения ФП/ТП отдельный интерес представляют особенности купирования и профилактики приступов ФП/ТП после выполнения аблации устьев легочных вен, в том числе в «остром периоде», в течение 3 мес. после вмешательства, когда вероятность рецидива аритмии является максимальной. Недавнее исследование по оценке эффективности применения кавутилида у пациентов с эпизодами ФП/ТП после радиочастотной или криоаблации легочных вен показало, что использование 4-этапной схемы введения кавутилида позволило восстановить СР у 94,8%. При этом у пациентов с приступами ФП/ТП, возникшими в «острый период» после аблации, эффективность МКВ составила 97%, а при эпизодах аритмии, имевших место по истечении 3 мес. после вмешательства, — 92%. Рецидивы ФП/ТП после успешной МКВ отмечены только в течение «острого периода» в 12% случаев [42].
Кавутилид в таблетированной форме
Следующим логичным шагом стало планирование и выполнение работ по созданию таблетированной формы препарата. В ходе доклинических испытаний показано, что влияние кавутилида на электрофизиологические параметры сердца при внутрижелудочном применении у экспериментальных животных происходит значительно медленнее по сравнению с в/в введением и сохраняется дольше. При этом происходит накопление препарата, которое приводит к стабилизации его эффекта, но не к функциональной кумуляции. Продемонстрировано, что, как и при в/в введении, препарат не влияет на основные функции и системы организма, не мутагенен, не канцерогенен, не эмбриотоксичен и не тератогенен. Отнесен к умеренно токсичным соединениям. Были рассчитаны дозы от 1 до 6 мг для безопасного исследования на здоровых добровольцах при приеме внутрь.
В ходе I фазы КИ оценивали безопасность и переносимость, а также фармакокинетические параметры кавутилида, таблетки, в дозах 1, 2, 4 или 6 мг при однократном приеме внутрь, а также в дозе 2 мг ежедневно при многократном приеме до 10 дней [43]. Для расчета абсолютной биодоступности была включена когорта в/в введения дозы 1 мг. Как и на доклинической стадии, были обнаружены значительные фармакодинамические и фармакокинетические различия при применении кавутилида в/в и внутрь. При парентеральном введении препарата его концентрация в крови и продолжительность интервалов QT/QTc стремительно возрастают сразу после введения и быстро снижаются в течение получаса. В когортах однократного приема стойкое статистически значимое увеличение продолжительности интервалов QT и QTc отмечалось только при использовании максимальной дозы 6 мг. А при многократном приеме 2 мг кавутилида достоверное, хотя и небольшое увеличение продолжительности интервалов QT/QТc происходит начиная с первых 1–3 ч приема и достигает максимума к 9–10-м суткам приема. Максимальный прирост величины QT и QTc составляет 40–43 мс для QT и 35–47 мс для QTc соответственно. Эти изменения, составляющие 10–12% от исходных значений, можно расценивать как клинически значимые и допустимые. Во всех когортах перорального приема длительность интервалов QT/QTc не превышала границ референсных значений в течение всего периода наблюдения. Доказано, что к 8–10-му дню приема кавутилида в дозе 2 мг/сут достигается стационарное состояние — равновесие между процессами всасывания и элиминации лекарственного препарата. Эти данные подтверждаются динамикой фармакокинетических и электрокардиографических параметров. В рамках проведенного исследования не зарегистрировано развития эпизодов нарушения АВ- и внутрижелудочковой проводимости под действием кавутилида, а также эпизодов его аритмогенного действия. Не отмечено стойкого значимого изменения ЧСС ни в одной из групп дозирования. Также не выявлено влияния кавутилида на жизненно важные показатели и анализы крови и мочи на фоне и по окончании приема препарата. Таким образом, по результатам проведенных исследований сделан вывод, что лекарственный препарат кавутилид, таблетки, в исследованных дозировках при его однократном и многократном приеме здоровыми добровольцами натощак обладает приемлемым профилем безопасности и хорошо переносится, что предполагает дальнейшее исследование его безопасности и эффективности в предотвращении приступов ФП/ТП в рамках II фазы КИ. Планируется многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование с целью предотвращения рецидивов ФП/ТП после купирования их персистирующей формы.
Заключение
Подводя итог всему вышесказанному, можно утверждать, что в РФ создан уникальный ААП III класса, эффективность использования которого с целью восстановления СР у пациентов с ФП/ТП сопоставима с эффективностью ЭКВ и существенно превосходит эффективность доступных ААП. Результаты I фазы КИ кавутилида, описавшие фармакокинетический профиль препарата, определив режим его дозирования и подтвердив безопасность его применения, послужили основой формирования протокола II фазы КИ у пациентов с персистирующей формой ФП/ТП после восстановления СР. Есть все основания полагать, что успешное завершение этого исследования откроет принципиально новые перспективы противоаритмического лечения этой сложной и самой массовой категории среди больных, страдающих нарушениями ритма сердца.
Источник финансирования
Работа выполнена в рамках Государственного задания № 122091300024-0.
Информация с rmj.ru