Содержание статьи
Введение
Ведущими клиническими проявлениями новой коронавирусной инфекции COVID-19 являются вирусное повреждение легких (вирусная пневмония) и острый респираторный дистресс-синдром (ОРДС) с развитием острой дыхательной недостаточности (ОДН) [1, 2].
Повреждение легких при COVID-19 связывают с неконтролируемой активацией иммунной системы, подобной той, которая наблюдается при гемофагоцитарном лимфогистиоцитозе [3] или синдроме высвобождения цитокинов при сепсисе [4]. В тяжелых случаях COVID-19 истощение Т-клеток, повышение уровня интерлейкинов (ИЛ) -6, -10, фактора некроза опухоли альфа (ФНО-α) приводит к развитию «цитокинового шторма» [5] и вызывает значительное повреждение ткани легких [6]. Также в патогенный каскад болезни вовлечены такие цитокины, как ИЛ-1β, -8, -12, интерферон-гамма-индуцибельный белок (human interferon-inducible protein 10, IP10), воспалительный белок макрофагов 1A (macrophage inflammatory protein 1A, MIP1A) и хемоаттрактантный белок моноци-тов 1 (monocyte chemotactic protein 1, MCP1).
Доказано, что связывание вируса SARS-CoV-2 с толл-подобным рецептором (Toll-like receptor, TLR) индуцирует высвобождение про-ИЛ-1β, который расщепляется на активный зрелый ИЛ-1β, опосредующий воспаление легких с последующим развитием фиброза [7, 8].
Повышение содержания ИЛ-6, основного цитокина, вызывающего воспаление при COVID-19, способствует развитию митохондриального окислительного стресса и дисбаланса в системе оксиданты/антиоксиданты. Окислительно-восстановительный дисбаланс в клетках альвеолярного эпителия, их апоптоз, усиление воспаления и, как следствие, нарушение газообмена вызывают и местное повышение уровня ангиотензина 2 после инактивации ангиотензинпревращающего фермента 2 вирусом SARS-CoV-2 [9, 10].
Оксиданты активируют транскрипционные факторы и передачу клеточного сигнала, инициируют экспрессию провоспалительных генов, приводя к выраженному воспалению в легочной ткани и системному воспалению [11, 12]. Эндогенная недостаточность основного внутриклеточного антиоксиданта — глутатиона и повышение содержания глутатионредуктазы могут приводить к серьезным проявлениям COVID-19 и летальному исходу [9, 10]. Согласно накопленным литературным данным ослабление оксидативного стресса может уменьшать повреждение легких [10].
Потребность в безопасном и эффективном лечении становится все более актуальной из-за высоких показателей смертности от COVID-19, наблюдаемых во всем мире. Выбор лекарственных средств (ЛС) для схем лечения COVID-19 основывается на данных об их эффективности и безопасности, механизме действия и потенциальных взаимодействиях. Также учитывается способность ЛС усиливать физиологический ответ человеческого организма на воспаление, их потенциал способствовать гомеостазу клинических маркеров воспаления, а также возможность действовать на ранних стадиях заболевания. Фармакологическая активность N-ацетилцистеина (N-acetylcysteine, NAC) и потенциально возможное действие в подавлении прогрессирования COVID-19 делают его многообещающим терапевтическим средством при COVID-19 [13].
NAC подавляет окислительный стресс, выступая в качестве проницаемого для клеток аминокислотного предшественника глутатиона и разрывая дисульфидные связи внутри ангиотензинпревращающего фермента 2 — клеточного рецептора для SARS-CoV-2 [12]. Кроме того, NAC подавляет формирование провоспалительных цитокинов, таких как ИЛ-8 и ФНО-α [13]. В многочисленных исследованиях было показано, что NAC с успехом может использоваться при различных заболеваниях легких [14]. Протективные эффекты NAC при ОРДС продемонстрированы во многих экспериментальных и клинических исследованиях [1].
Благодаря механизму действия, направленному на увеличение глутатиона, улучшение ответа Т-лимфоцитов и модулирование воспаления, NAC может выступать в качестве потенциального ЛС при лечении COVID-19 [6, 15]. Принимая во внимание наличие системного воспаления, следует отметить, что NAC может также защищать от вызванного окислительным стрессом эндотелиального повреждения, которое активирует высокотромботический подтип синдрома диссеминированного внутрисосудистого свертывания, наблюдаемого при COVID-19 [16].
В связи с этим целью настоящего исследования стала оценка эффективности NAC в комплексном лечении среднетяжелой COVID-ассоциированной пневмонии.
Материал и методы
В исследование включены взрослые пациенты (n=46) со среднетяжелой COVID-ассоциированной пневмонией КТ 2-й степени. Пациенты находились на лечении в COVID-госпитале, функционирующем на базе Университетской клинической больницы № 4 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России.
Наличие COVID-19 подтверждалось лабораторными исследованиями (мазок на РНК вируса SARS-CoV-2 из верхних дыхательных путей методом ПЦР) и/или клинико-рентгенологически (наличие характерной клинической картины и характерных признаков полисегментарной вирусной пневмонии COVID-19). При постановке диагноза и назначении лечения COVID-ассоциированной пневмонии руководствовались временными методическими рекомендациями «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» Минздрава России, версия 9, 26.10.2020 [1].
Критериями включения в исследования были: температура тела >38 °C, частота дыхательных движений (ЧДД) >22/мин, одышка при физических нагрузках, изменения при КТ, типичные для вирусного поражения (объем поражения средний (25–50%), КТ 2-й степени), насыщение крови кислородом (SpO2) <95%, содержание С-реактивного белка (СРБ) в сыворотке крови >10 мг/л.
Критерии исключения из исследования: несоответствие критериям включения, неспособность соблюдения пациентом условий протокола; отказ пациента от исследования.
У всех больных оценивались демографические показатели, индекс массы тела (ИМТ), альтернативный индекс оксигенации (SpO2/FiO2 — отношение насыщения крови кислородом к фракции вдыхаемого кислорода), симптомы заболевания, данные объективного, лабораторного (общий анализ крови, СРБ, коагулограмма) и инструментального (КТ органов грудной клетки) исследований, сопутствующие заболевания. Для выявления дыхательной недостаточности (ДН) и оценки выраженности гипоксемии использовалась пульсоксиметрия с измерением насыщения крови кислородом.
ДН определялась в соответствии с классификацией по степени тяжести, основанной на показателях пульсоксиметрии (SpO2). Для оценки питательного статуса пациентов использовался ИМТ, который рассчитывался по общепринятой формуле: ИМТ = масса тела (кг) / рост (м2). Индекс оксигенации SpO2/FiO2 рассчитывался по формуле:
SpO2 / 21 + 3 × скорость потока кислорода [17].
Пульсоксиметрия проводилась с помощью пульсоксиметра серии MD300C (Armed, Россия). КТ легких проводилась на спиральном компьютерном томографе Aquillion TSX-101A (Toshiba Medical Medical Systems, Япония), толщина среза — 1 мм, при поступлении и через 10 дней от начала лечения.
Количественное определение СРБ в сыворотке крови определяли латексным иммунотурбидиметрическим методом (анализатор Beckman Coulter, США, серия AU, с использованием реагентов CRP Latex, Россия) в 1-й, 3-й и 10-й день наблюдения.
Фибриноген определялся в плазме крови (анализатор АСК 2–01 «Астра») с использованием наборов НПО «Ренам», Россия. Д-димеры определяли методом микролатексной агглютинации с фотометрической регистрацией реакции (иммунотурбидиметрия), с использованием наборов «РеДимер-латекс», тест НПО «Ренам», Россия.
Всего в исследовании принимали участие 46 человек, медианный возраст которых составил 57 (51; 71) лет, ИМТ — 30 (27,1; 32,3) кг/м2, длительность заболевания до госпитализации — 7 (6; 8) дней, температура на момент госпитализации составляла 37,5 (37,1; 37,8) °С.
Случайным образом были сформированы 2 группы исследования. 1-я группа (контроль, n=22) получала стандартное лечение [1]: гидроксихлорохин 200 мг, 800 мг/сут в 1-й день, 400 мг/сут 2–7-й дни; азитромицин 500 мг/сут 5 дней, эноксапарин натрия 0,4 мг/сут подкожно, дексаметазон 8–12 мг/сут, при СРБ ≥60 мг/л — тоцилизумаб 400 мг/сут. Пациенты 2-й группы (n=24) дополнительно получали NAC (Флуимуцил, Швейцария) 1200–1500 мг/сут внутривенно капельно № 8–10. NAC назначался одновременно с началом стандартной терапии.
Статистическая обработка данных проводилась с использованием пакета прикладных программ IBM SPSS Statistics, version 22 (лицензия 20160413–1). Описательная статистика исходных количественных признаков представлена медианой и интерквартильным размахом. Помимо исходных признаков анализировалась разность изменения каждого показателя (разница до и после лечения) и интенсивность темпа изменения показателя (разность изменения относительно исходного уровня, выраженная в процентах). Описательная статистика разности и интенсивности изменений представлена средним и стандартным отклонением. Сравнение двух независимых выборок (группа NAC и контрольная группа) по количественному показателю проводилось с применением критерия Манна — Уитни (U), зависимых (до — после лечения) — критерием Вилкоксона для связанных выборок (W). Сравнение трех независимых выборок по количественному показателю (в разные моменты исследования) проводилось критерием Фридмана, апостериорные сравнения проводились критерием Немени. Оценку различий срока госпитализации пациентов (койко-дней в стационаре) 2 групп проводили с использованием техники Каплана — Мейера и критерия Тарона — Вэра.
Результаты исследования
Исследуемые группы были сопоставимы по всем рас-сматриваемым показателям: возрасту — 57 (46; 58) и 66 (52; 71) лет, p=0,08; индексу массы тела (ИМТ) — 28,8 (26,4; 31,2) и 31,2 (28,5; 32,3) кг/м2, р=0,07; длительности заболевания до госпитализации — 7 (6; 8) и 7,5 (6; 9) дня, р=0,37; длительности лихорадки — 9 (7; 10) и 9,5 (9; 10) дня, р=0,28; в т. ч. по ЧДД (p=0,11), ЧСС (p=0,11), уровню SpO2 (p=0,42), индексу оксигенации (SpO2/FiO2) (p=0,39), концентрации СРБ (p=0,08), уровню фибриногена (p=0,07) и объему поражения легких по данным КТ (p=0,06) (табл. 1).
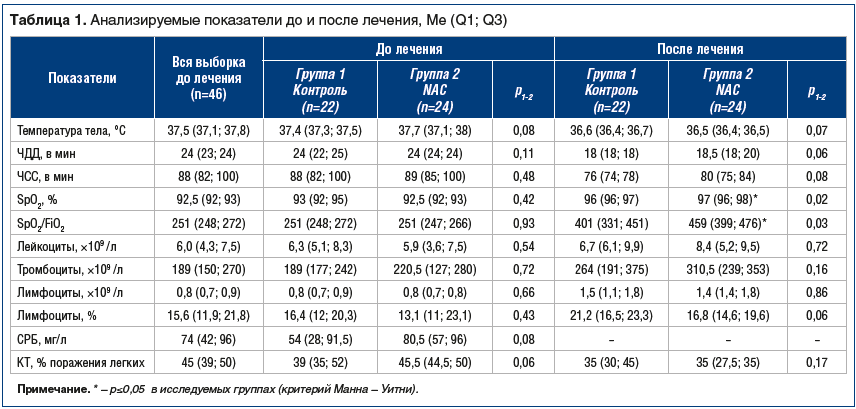
В результате лечения все рассматриваемые показатели, за исключением уровня лейкоцитов, продемонстрировали статистически значимое изменение в обеих группах. Но стоит отметить, что в ходе анализа были выявлены межгрупповые различия в интенсивности изменения ряда показателей (табл. 1). В частности, уровень SpO2 вырос в группе контроля в среднем у каждого пациента на 3±1,5% от исходного уровня, изменение статистически значимо (p<0,001), в то же время прирост показателя в группе NAC составил в среднем 4,6±1,1% (p<0,001), разница между темпами прироста статистически значима (p=0,001). В результате разной интенсивности прироста SpO2 после лечения у пациентов группы NAC стал статистически значимо выше, чем в группе контроля, — 97 (96; 98)% против 96 (96; 97)% (p=0,02).
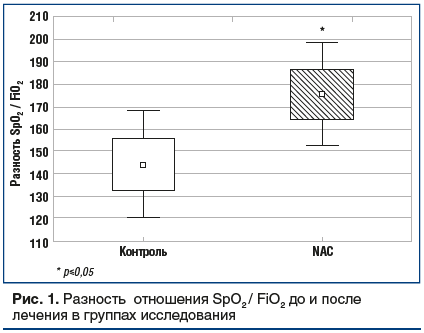
Индекс оксигенации (SpO2/FiO2) вырос в среднем на 88±16,6% от исходного уровня у пациентов группы NAC (p<0,001) и на 70±28,9% в группе пациентов со стандартным лечением (p<0,001), разница между темпами прироста статистически значима (p=0,04). В результате после лечения SpO2/FiO2 у пациентов группы NAC стал статистически значимо выше, чем в контрольной группе (p=0,03).
Разность прироста индекса оксигенации у пациентов группы NAC статистически значимо выше, чем в группе контроля, — 175±54,3 против 144±54,4 (p=0,02) (рис. 1).
В результате лечения объем поражения легких, по данным КТ (относительно исходного уровня), значимо уменьшился в обеих группах (p<0,001). Средний темп изменения данного показателя (разница между показателем после и до лечения, выраженная в % от значений показателя до лечения) в исследуемых группах составил 31±8,3% и 17±6,2% соответственно, различия статистически значимы (p<0,001).
Обращает на себя внимание статистически значимое различие разности уменьшения объема поражения легких по данным КТ (p<0,001), данные представлены на рисунке 2.

Был проведен анализ течения воспалительного процесса на основе концентрации СРБ. Изначально сопоставимый в группах исследования уровень СРБ демонстрирует статистически значимое (p=0,002) снижение на 3-й день лечения только в группе NAC — с 81 (57; 96) мг/л до 44 (40; 57) мг/л. На 10-й день лечения отмечается статистически значимое снижение уровня СРБ в обеих группах исследования, значения показателя составляют 6 (4; 13) мг/л в группе контроля (снижение статистически значимо относительно 1-го дня — p<0,001 и 3-го дня — p<0,001) и 5 (2; 6) мг/л в группе NAC (снижение статистически значимо относительно 1-го дня — p<0,001 и 3-го дня — p=0,002). Между группами исследования не выявлено статистически значимых различий уровня СРБ ни в один из периодов исследования, но отмечается статистически значимо более интенсивный, чем в группе контроля, темп снижения уровня СРБ в группе NAC на 10-й день относительно 1-го дня — 90±10,2% против 82±13,9% (p=0,03).
Анализ сроков госпитализации пациентов (числа койко-дней в стационаре) показал, что добавление Флуимуцила к стандартной терапии статистически значимо снижает длительность госпитализации (p<0,001). В группе пациентов, получавших только стандартную терапию, медиана койко-дней в стационаре составила 13 (11; 16) дней, тогда как в группе получавших препарат — 11 (10; 12) дней.
Обсуждение
В проведенном нами исследовании на фоне лечения все рассматриваемые показатели, за исключением уровня лейкоцитов, продемонстрировали статистически значимое изменение в обеих группах. Но стоит отметить, что в ходе анализа были выявлены межгрупповые различия в интенсивности изменения ряда показателей.
В частности, показатель насыщения крови кислородом после лечения у пациентов группы NAC стал статистически значимо выше, чем в группе контроля. Соответственно, после лечения индекс оксигенации у пациентов группы NAC стал также статистически значимо выше, чем в группе пациентов, получавших стандартное лечение. Статистически значимой была разница увеличения данного показателя.
Обращает на себя внимание характер изменения объема поражения легких по данным КТ после проведенной терапии. Исследование показало, что средний темп уменьшения объема поражения легких был статистически значимо выше в группе пациентов, дополнительно получавших NAC. Статистически значимой в этой группе была также разница снижения данного показателя.
Между группами исследования не выявлено статистически значимых различий уровня СРБ ни в один из периодов исследования, но отмечается статистически значимо более интенсивный, чем в группе контроля, темп снижения уровня СРБ в группе NAC.
Анализ сроков госпитализации пациентов (числа койко-дней в стационаре) показал, что добавление Флуимуцила к стандартной терапии статистически значимо снижает длительность госпитализации.
В исследованиях NAC проявил активность в различных потенциальных терапевтических путях-мишенях, вовлеченных в патофизиологию инфекции SARS-CoV-2. Патогенными факторами SARS-CoV-2, на которые мог бы оказать влияние NAC, являются: истощение Т-лимфоцитов, которое проявляется в снижении количества и функциональной способности клеток CD4+ и CD8+; провоспалительное состояние через увеличение ФНО-α, ИЛ-1, -18 и модуляция вирусной активности вследствие увеличения содержания глутатиона [12].
Согласно результатам рандомизированного контролируемого исследования NAC связывается с глутамином и глицином, образуя мощный антиоксидант, известный как глутатион, который, как было показано, противодействует воспалительной реакции при внебольничной пневмонии [15, 16]. Добавление NAC в лечение пациентов с внебольничной пневмонией снизило концентрацию малонового диальдегида, супероксиддисмутазы, общую антиоксидантную активность, уровень ФНО-α. Авторами сделан вывод, что лечение NAC может помочь уменьшить окислительное и воспалительное повреждение у пациентов с пневмонией [15]. В другом исследовании было обнаружено, что NAC снижает уровень ИЛ-6-зависимого СРБ при пневмонии, вызванной гриппом AH1N1 [18].
Применение NAC способствует уменьшению активности воспаления в легочной ткани. На фоне лечения NAC происходит увеличение содержания нейтрофилов в периферической крови на фоне уменьшения их представительства в ткани респираторного тракта, снижения активности фактора транскрипции NF-κB в клетках респираторного тракта и снижения концентрации эозинофильных катионных белков в мокроте [14].
Известно, что NAC предотвращает действие трансформирующего фактора роста β1 (Transforming growth factor β1, TGF-β1), которое способствует эпителиально-мезенхимальной трансдифференцировке и индуцирует фиброзирование. Показано, что NAC уменьшает активность TGF-β1-индуцированной продукции фибронектина, сосудистого эндотелиального фактора роста и коллагена. Также NAC подавляет фосфорилирование фактора Smad 2/3, препятствует димеризации мономеров TGF-β1, ингибирует функционирование TGF-β1-индуцированного гена-репортера [19].
В исследовании Н. Ibrahim (2020) NAC вводили 9 пациентам с тяжелой формой COVID-19 и дыхательной недостаточностью. На фоне лечения NAC отмечены клиническое улучшение, заметное снижение уровня СРБ у всех пациентов и уровня ферритина у 9 из 10 пациентов. Авторы предположили, что механизм действия NAC может включать блокаду вирусной инфекции и развивающегося «цитокинового шторма», что требует последующих подтверждающих исследований в рамках контролируемых клинических испытаний [12].
В то же время в двойном слепом рандомизированном плацебо-контролируемом одноцентровом исследовании, проведенном в Бразилии, изучено влияние высоких доз NAC на потребность в искусственной вентиляции легких и ее длительность, поступление в отделение интенсивной терапии, время, проведенное в этом отделении, и смертность. Результаты исследования показали, что прием NAC в высоких дозах не повлиял на развитие тяжелого течения COVID-19 и на изучаемые показатели [20].
С учетом вышеизложенного необходимы дальнейшие исследования для оценки эффективности NAC при COVID-19.
Заключение
Включение NAC в комплексное лечение среднетяжелой COVID-ассоциированной пневмонии привело к статистически значимому повышению насыщения крови кислородом, индекса оксигенации, различию разности увеличения индекса оксигенации, более высокому темпу уменьшения объема поражения легких и межгрупповому различию разности уменьшения данного показателя. Также отмечены статистически значимо более интенсивный, чем в группе контроля, темп снижения уровня СРБ и сокращение длительности госпитализации в группе NAC. Таким образом, результаты проведенного исследования свидетельствуют о целесообразности включения NAC в комплексное лечение среднетяжелой COVID- ассоциированной пневмонии.
Благодарность
Редакция благодарит компанию ООО «Замбон Фарма» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru