Микробиоценоз верхних отделов пищеварительного тракта у детей с гастроэзофагеальной рефлюксной болезнью и хроническим гастродуоденитом
Ю.С. Апенченко, В.М. Червинец, И.И. Иванова, Н.В. Басалаева, Беляева Е.А.
Тверская государственная медицинская академия
Рассматривается микробный спектр слизистой оболочки пищевода и желудка детей с гастроэзофагеальной рефлюксной болезнью и хроническим гастродуоденитом. У пациентов с заболеваниями верхних отделов пищеварительного тракта условно-патогенные микроорганизмы выделяются чаще, их штаммы обладают факторами агрессии и цитотоксичностью. У детей с рефлюксной болезнью микробный пейзаж в пищеводе шире как в количественном, так и в видовом отношении по сравнению не только со здоровыми подростками, но и с детьми с изолированным гастродуоденитом.
Ключевые слова: микрофлора, пищеварительный тракт, дети, гастроэзофагеальная рефлюксная болезнь, хронический гастродуоденит
Болезни органов пищеварительной системы в структуре соматической патологии у детей занимают одно из ведущих мест. По некоторым данным, их распространенность превышает 400‰ [6]. На рост гастроэнтерологических заболеваний влияют особенности современного образа жизни и питания, стрессы, неблагоприятная экологическая обстановка, в определенной мере – широкое внедрение ультразвукового и эндоскопического методов диагностики. В настоящее время отмечаются уменьшение частоты выявляемости язвенной болезни и гастродуоденитов и рост частоты заболеваний пищевода [6]. К ним в первую очередь относится гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
ГЭРБ – хроническое рецидивирующее заболевание, в основе которого лежит патологический гастроэзофагеальный рефлюкс (ГЭР), отличающийся от физиологического прежде всего продолжительностью, частотой и наличием клинической симптоматики. По данным многоцентрового эпидемиологического исследования МЭГРЕ, распространенность ГЭРБ в популяции составляет 13,3% [4].
Одним из нерешенных аспектов проблемы ГЭРБ является сочетание ее с инфицированностью Helicobacter pylori, причем высказываются противоположные точки зрения: H. pylory способствует возникновению ГЭРБ, и H. pylori способствует предупреждению ГЭРБ. По данным Н. O’Connor, хеликобактерная инфекция, вызывая гиперсекрецию, может способствовать развитию ГЭРБ, тем не менее эпидемиологические исследования не подтверждают это [10]. Ц.Г. Масевич и И.А. Лосева, обследовав группу больных, у которых H. pylori определялся на слизистой оболочке не только желудка, но и пищевода, выявили у них более выраженные эндоскопические изменения в пищеводе [5]. Предположение о протективной роли H. pylori относительно развития ГЭРБ основано на эпидемиологических данных о том, что рефлюксная болезнь при хеликобактерной инфекции встречается реже, чем у неинфицированных пациентов. Возможно, это связано не только с выработкой аммиака в результате инфицирования. Чем больше выраженность воспаления в теле желудка, тем чаще атрофия, ниже секреция кислоты и меньше вероятность развития ГЭРБ, и наоборот [9].
Микробиоценоз верхних отделов пищеварительного тракта состоит не только из H. pylori. Несмотря на то что традиционно постулируется скудность мукозной микрофлоры гастродуоденальной зоны из-за бактерицидного действия желудочного сока, В. М. Червинец, С. Н. Базлов и соавт. выделили различные микроорганизмы из биоптатов слизистой оболочки у 90% здоровых лиц. При обострении язвенной болезни из биоптатов периульцерозной зоны выделялось большее количество микроорганизмов, всегда в сочетаниях с цитотоксичностью [1, 7].
Обнаружен определенный микробиоценоз желудка у детей с хроническим гастродуоденитом (ХГД), причем микробный пейзаж был разным при H. pylori-ассоциированном гастродуодените и гастродуодените без инфекции H. pylori [3]. Изменяются спектр и количество микроорганизмов и у больных эзофагитами [8].
Материалы и методы. Предпринята попытка оценить микробный спектр верхних отделов пищеварительного тракта у детей с ГЭРБ и ХГД. Для изучения особенностей микробиоценоза слизистой оболочки обследовано 45 детей в возрасте от 15 до 18 лет.
Все обследованные разделены на 3 группы. В 1-ю группу вошло 14 детей с ГЭРБ, во 2-ю группу – 13 детей с ХГД и в 3-ю группу (контрольную) – 18 здоровых добровольцев без заболеваний верхних отелов пищеварительного тракта. У всех получено информированное согласие на проведение исследования.
Помимо клинико-анамнестического метода исследования, использовались возможности инструментальной и лабораторной диагностики: детям проводились 24-часовая рН-метрия, эзофагогастродуоденоскопия (ЭГДС), микробиологическое исследование биоптатов слизистой оболочки верхних отделов пищеварительного тракта.
Суточный мониторинг рН выполняли с помощью портативного прибора Гастроскан-24 в условиях свободной активности обследуемого с последующей дешифровкой записи на персональном компьютере с помощью программы «Исток-Система». Во время исследования дети вели дневник с указанием возникающих жалоб, времени приема пищи и медикаментов, сна, горизонтального и вертикального положения тела.
Для оценки кислых ГЭР использовали общепринятые показатели, предложенные DeMeester: процент времени с рН в пищеводе менее 4 (в том числе в горизонтальном и вертикальном положении тела), общее число рефлюксов за сутки, число рефлюксов продолжительностью более 5 мин, длительность наиболее продолжительного рефлюкса. На основании этих данных рассчитывался интегративный показатель DeMeester.
ГЭР расценивался как физиологический, если забросы были непродолжительными, возникали не более 46 раз в сутки, в основном после еды, в вертикальном положении. Характеризующие их цифровые показатели были в пределах нормы по demeester.
Если время, в течение которого в пищеводе регистрировался рН менее 4,0, превышало 4,2% от общего времени исследования (более 1 ч за сутки), или общее число кислых забросов было больше 46 в сутки, делалось заключение о наличии патологического кислого ГЭР.
ЭГДС проводилась для оценки состояния слизистой оболочки верхних отделов пищеварительного тракта и определения наличия эзофагита, гастродуоденита.
Диагноз ГЭРБ и ХГД ставился на основании характерных клинических проявлений: жалоб пациентов, объективного статуса и результатов инструментального обследования.
Микробная обсемененность верхних отделов пищеварительного тракта определялась в биоптатах слизистой оболочки нижней трети пищевода и тела желудка, взятых при ЭГДС. Биопсийный материал помещали в транспортную среду portagerm-pylori (ВВL®), предназначенную для сохранения H. pylori, а также в транспортную среду Амиес. Время транспортировки в лабораторию составляло от 30 мин до 2 ч.
Посевы культивировали соответственно в аэробных, анаэробных и микроаэрофильных условиях с использованием микроанаэростатов (BBL®) и газогенераторных пакетов Gas pack plus (ВВГ®) и campy Рак plus (BBL®) в течение 24–72 ч при 37°C. Идентификацию бактерий осуществляли с помощью идентификационных АРi-систем («Bio merieux»).
Количество бактерий определяли путем подсчета колониеобразующих единиц на 1 г биоптата (КОЕ/г) с учетом массы биоптата и разведения [2, 7].
Протеолитические ферменты у микроорганизмов выявляли по наличию зон просветления вокруг колоний при посеве на среды с казеином. Цитотоксичность микроорганизмов определяли путем инкубации тестируемых штаммов с культурой клеток Нeр-2. Степень выраженности цитотоксичности учитывали по изменению характера монослоя в виде отслоения клеток, изменения их морфологии, наличию деструкции [7].
Значимость различий определялась по критерию углового преобразования Фишера.
Результаты и обсуждение. По результатам ЭГДС у всех детей 1-й и 2-й группы определялся поверхностный гастрит и дуоденит. Катаральный эзофагит выявлен у 50% детей с ГЭРБ и у 46,2% детей без ГЭРБ.
Микробиоценоз пищевода. Из слизистой оболочки пищевода у детей с ГЭРБ выделялись представители 13 родов микроорганизмов, у детей без ГЭРБ – 8 родов, у здоровых подростков – 10 родов. Микроорганизмы определялись в ассоциации из 3–7 культур у детей с ХГД и из 3–5 культур у здоровых лиц. Чаще сочетались стафилококки, стрептококки, лактобациллы. У детей с ГЭРБ к этому сочетанию нередко присоединялись сарцины, у детей без ГЭРБ – бактероиды.
У всех детей с ГЭРБ из слизистой оболочки пищевода выделялись стафилококки, стрептококки и бактероиды, у половины и более – лактобациллы, энтеробактерии и грибы рода candida. Сарцины, бациллы и актиномицеты обнаруживали только у детей с ГЭРБ. Наиболее часто среди представителей микробиоценоза пищевода у детей с ХГД выявляли стафилококки, стрептококки и лактобациллы. В группе контроля более половины детей выделяли только H. pylori (табл. 1).
Таблица 1. Частота выделения (в %) микроорганизмов из слизистой оболочки пищевода обследованных детей
| Микроорганизм | 1-я группа (n = 14) | 2-я группа (n = 13) | 3-я группа (n = 18) |
| Staphylococcus sp. | 100 | 100 | 100 |
| Streptococcus sp. | 100** | 69,2 | 50,0 |
| Helicobacter pylori | 0** | 0** | 61,1 |
| Lactobacillus sp. | 64,3 | 76,9* | 38,9 |
| Enterobacteriaceae | 50,0* | 30,8 | 22,2 |
| Bacteroides sp. | 100** | 38,5 | 27,8 |
| Candida sp. | 50,0** | 30,8** | 0 |
| Veillonella sp. | 21,4 | 23,1 | 11,1 |
| Sarcina sp. | 35,7** | 0 | 0 |
| Stomatococcus sp. | 28,6 | 30,8 | 27,8 |
| Bacillus sp. | 14,3* | 0 | 0 |
| Actinomyces sp. | 14,3* | 0 | 0 |
| Corynebacterium sp. | 14,3 | 0 | 11,1 |
| Neisseria sp. | 14,3 | 0 | 11,1 |
Примечание . Здесь и в табл. 2 разница статистически значима по сравнению с контрольной группой: * – p < 0,05, ** – p < 0,001.
Несмотря на то что стафилококки выделены у 100% детей, в том числе у всех здоровых, у пациентов с ГЭРБ отмечена активность факторов агрессии у этих микроорганизмов (гемолизин, лецитиназа). Гемолитические стрептококки выявлялись только у детей с ГЭРБ (см. рисунок).
У здоровых подростков из слизистой оболочки пищевода не выделялись микроорганизмы, обладающие цитотоксичностью. Среди подростков с ГЭРБ и ХГД цитотоксичностью обладали 100% стрептококков, 74,1% грибов рода candida, 62,9% стафилококков и 55,6% H. pylori.
H. pylori обладает уреазной активностью, что лежит в основе главных методов диагностики этой инфекции в гастроэнтерологии. В данном исследовании уреазная активность стрептококков выявлена у половины детей с ГЭРБ и ХГД, уреазная активность стафилококков – почти у 60% детей с ГЭРБ и ХГД и у половины здоровых подростков, уреазная активность грибов рода candida – у 1/3 детей с ГЭРБ и ХГД. Время проявления уреазной активности различных микроорганизмов различалось: у h. pylori оно составляло 20–30 мин, у других микроорганизмов – 12–24 ч, у стафилококков с гемолитической активностью – 1,5–2 ч.
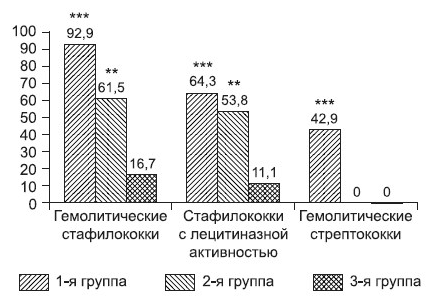
Активность факторов агрессии микроорганизмов, выделенных из слизистой оболочки обследованных детей.
Разница статистически значима по сравнению с контрольной группой: ** – р < 0,01, *** – р < 0,001.
Таблица 2. Частота выделения (в %) микроорганизмов из слизистой оболочки тела желудка обследованных детей
| Микроорганизм | 1-я группа (n = 14) | 2 группа (n = 13) | 3 группа (n = 18) |
| Staphtylococcus sp. | 100** | 100** | 61,1 |
| Streptococcus sp. | 100*4 | 76,9* | 44,4 |
| Helicobacter pylori | 14,3 | 0** | 33,3 |
| Lactobacillus sp. | 42,9 | 46,2 | 44,4 |
| Enterobacteriaceae | 35,7 | 15,4 | 22,2 |
| Bacteroides sp. | 85,7** | 53,8* | 16,7 |
| Candida sp. | 21,4 | 23,1 | 27,8 |
| Micrococcus sp. | 28,6 | 46,2 | 22,2 |
| Sarcina sp. | 57,1** | 15,4 | 5,6 |
| Stomatococcus sp. | 35,7** | 0 | 0 |
| Bacilus sp. | 21,4 | 15,4 | 22,2 |
| Actinomyces sp. | 14,3 | 7,7 | 5,6 |
| Corynebacterium sp. | 14,3 | 30,8 | 27,8 |
| Neisseria sp. | 21,4 | 7,7 | 5,6 |
Количество микроорганизмов у детей с ГЭРБ и ХГД было больше по сравнению с группой контроля и в ряде случаев составляло 4 lg КОЕ/г и более. Это касалось в частности, стафилококков, стрептококков, вейлонелл, энтеробактерий, бактероидов и грибов рода candida. Количество стафилококков, вейлонелл, сарцин, бактероидов, грибов candida, актиномицетов больше у детей с ГЭРБ по сравнению не только с группой контроля, но и со 2-й группой.
Микробиоценоз желудка. Исследование биоптатов слизистой оболочки тела желудка показало, что у всех подростков групп обследования и группы контроля выделялось 13–15 родов микроорганизмов. Их спектры у детей 1-й и 2-й групп в значительной степени совпадали. Ассоциации бактерий у детей с ГЭРБ и ХГД обычно представлены сочетанием 4–6 родов бактерий, что больше, чем у здоровых лиц (обычно 1–4 культуры).
У всех детей с ГЭРБ из тела желудка выделялись стафилококки и стрептококки, более чем у половины бактероиды и сарцины. Только у детей 1-й группы выделялись стоматококки. У детей с ХГД микробный спектр чаще представлен стафилококками, стрептококками и бактероидами. В 3-й группе только стафилококки присутствовали в биоптатах из тела желудка более чем у половины подростков, остальные микроорганизмы выявлялись значительно реже (табл. 2).
Гемолитические стафилококки выявлены у детей 1-й и 2-й групп в 71,4% и 61,5% случаев соответственно и лишь у 22,2% лиц в контрольной группе (р < 0,01), гемолитические стрептококки – у 35,7% в 1-й группе и у 30,4% во 2 группе в сравнении с 11,1% здоровых (р < 0,05). Стафилококки с лецитиназой в группе контроля не выделялись.
Количество стафилококков, стрептококков, бактероидов у детей с ГЭРБ и ХГД было больше, чем у здоровых детей и почти во всех случаях превышало 4 lg КОЕ/г. В большем количестве у больных детей 1-й и 25-й групп встречались микроорганизмы с факторами патогенности.
Заключение. Микробный спектр слизистой оболочки пищевода и желудка у всех обследованных подростков представлен в большей степени нормальной и реже условно-патогенной микрофлорой. Спектр микроорганизмов, выделенных у больных с ГЭРБ и ХГД, шире, их количество часто превышало 4 lg КОЕ/г. Штаммы микроорганизмов у детей с ГЭРБ и ХГД обладают факторами агрессии (гемолизин, лецитиназа) и цитотоксичностью, наличие которой рассматривается как фактор патогенности.
В то же время Н. pylori чаще встречается в слизистой оболочке пищевода и тела желудка здоровых подростков. Уреазную активность имеет не только H. pylori, но у данного микроорганизма она проявляется намного быстрее.
У детей с ГЭРБ микробный спектр в пищеводе шире, количество выделенных бактерий больше по сравнению не только со здоровыми подростками, но и с детьми с изолированным ХГД. В то же время различия в микробиоценозе желудка между детьми 1-й и 2-й групп не столь существенны, хотя определяются различия с контрольной группой. Мы считаем, что при ГЭРБ повреждающее действие на слизистую оболочку пищевода агрессивного желудочного содержимого приводит к созданию благоприятных условий для развития микробной флоры в данном отделе пищеварительного тракта.
ЛИТЕРАТУРА
1. Базлов С. Н., Червинец В. М., Егорова Е. Н. Эффективность трансэндоскопической санации ульцерозного процесса при рецидиве язвенной болезни, ассоциированной с дисбактериозом гастродуоденальной зоны. Альманах клинической медицины. 2006; 14: 13–7.
2. Егорова Е. Н. Микробная флора и лизоцим слизистой оболочки гастродуоденальной зоны при язвенной болезни и возможности их коррекции: Автореф. дис. … канд. мед. наук. СПб.; 1999.
3. Казимирова А. А., Казачков Е. Л. Структурно-функциональное состояние слизистой оболочки желудка и его микробиоценоз при хроническом гастрите у детей. Уральский медицинский журнал. 2009; 4: 17–21.
4. Лазебник Л. Б., Машарова А. А., Бордин Д. С. и др. Многоцентровое исследование «Эпидемиология гастроэзофагеальной рефлюксной болезни в России» (МЭГРЕ): первые итоги. Экспериментальная и клиническая гастроэнтерология. 2009; 6: 4–12.
5. Масевич Ц. Г., Лосева И. А. Гастроэзофагеальная рефлюксная болезнь в сочетании с инфицированием пилорическим хеликобактером. Терапевтический архив. 1998; 70 (2): 26–8.
6. Цветкова Л. Н., Горячева О. А., Цветков П. М. и др. Гастроэнтерологическая патология у детей: патоморфоз заболеваний и совершенствование методов диагностики на современном этапе. В кн.: Актуальные проблемы абдоминальной патологии у детей. М.; 2011: 5–8.
7. Червинец В. М. Изменение микробиоценоза при воспалительных и эрозивно-язвенных поражениях пищевода, желудка и двенадцатиперстной кишки и пути его коррекции: Автореф. дис. … д-ра мед. наук. М.; 2002.
8. Червинец В. М. Микрофлора воспалительно-эрозивных участков пищевода при эзофагитах. Журнал микробиологии, эпидемиологии и иммунобиологии. 2002; 2: 73–5.
9. El-Serag Н. В., Sonnenberg A., Jamal М. М. et al. Corpus gastritis is protective against refux oesophagitis. Gut. 1999; 45: 181–5.
10. O’Connor H. J. review article: helicobacter pylori and gastroesophageal refux disease – clinical implications and management. aliment. pharmacol. Ther. 1999; 13: 111–27
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru







