особенностью азитромицина являются бактериостатические, бактерицидные и иммуномодулирующие свойства и его безопасность. Установлены существенные различия в отношении максимальной концентрации и продолжительности действия оригинального азитромицина по сравнению с генерическим препаратом в ткани легкого. Наиболее частой комбинированной антибактериальной терапией тяжелой ВП является сочетание цефалоспоринов III поколения и макролидов, что обеспечивает снижение риска смертности на 18% в сравнении с другими режимами антимикробной терапии.
Ключевые слова: внебольничная пневмония, диагностика, макролиды, эффективность, безопасность.
Для цитирования: Лещенко И.В. Макролиды: значение и безопасность для лечения пневмонии // РМЖ. 2017. №3. С. 232-237
Leshchenko I.V.
Ural State Medical University, Yekaterinburg
Early diagnosis of community-acquired pneumonia (CAP) and timely treatment largely determine the course and prognosis of the disease. The severity of the CAP is determined by the scale of Confusion-Respiratory rate-Blood pressure-65 (CRB-65) and / or systemic inflammatory response syndrome (SIRS). Macrolide antibiotics occupy a leading position in the antibacterial therapy CAP of various etiologies. A feature of azithromycin are bacteriostatic, bactericidal and immunomodulation properties and its safety. There are differences in the max-imum concentration and the duration of the original as compared with azithromycin generic drug in lung tissue. The most frequent combination antibiotic therapy is the combination of severe CAP III generation cephalosporin’s and macrolides, which reduces the risk of death by 18% in comparison with other modes of antimicrobial therapy.
Key words: community-acquired pneumonia, diagnosis, macrolides, efficiency, security.
For citation: Leshchenko I.V. Macrolides: efficiency and security for the treatment of pneumonia // RMJ. 2017. № 3. P. 232–237.
Статья посвящена возможностям применения макролидов при лечении пневмонии
Эпидемиологическими исследованиями установлено, что более 25% больных ежедневно обращаются к врачам в связи с заболеваниями дыхательных путей. Около 1/3 из них приходится на инфекционные заболевания нижних отделов. Внебольничная пневмония (ВП) является одним из наиболее распространенных заболеваний органов дыхания. В различных регионах Российской Федерации заболеваемость пневмонией составляет от 3-х до 15 случаев на 1000 населения [1].
Пневмония – распространенное и в то же время плохо диагностируемое в амбулаторных условиях заболевание. Только у 1/3 пациентов с пневмонией правильный диагноз устанавливается при обращении к врачу, из них лишь у 35% в первые 3 дня болезни [1]. Между тем ранняя диагностика пневмонии и своевременно начатое лечение во многом определяют течение и прогноз заболевания.
Решение о госпитализации пациента или лечении его в домашних условиях – наиболее важное клиническое заключение, принимаемое врачом в течение всей болезни. Это решение имеет непосредственное отношение к определению места (поликлиника или стационар), оценке лабораторных исследований, выбору антибактериальной терапии и стоимости лечения.
Немаловажен клинический и экономический результат амбулаторного ведения больных с нетяжелой ВП. На сегодня преимущества стационара перед поликлиникой для больных с нетяжелой ВП довольно эфемерны. Стационары зачастую не могут предложить условия пребывания лучше домашних, а скученность в палатах, особенно в осенне-зимний период, способствует распространению инфекции и развитию нозокомиальной пневмонии.
Цель публикации: представить диагностические критерии и критерии тяжести внебольничной пневмонии в амбулаторных условиях, а также подчеркнуть значение и безопасность макролидов для лечения внебольничной пневмонии при нетяжелом и тяжелом течении.
Содержание статьи
Диагностика
Диагноз ВП устанавливается на основании клинических, объективных критериев и данных рентгенологического обследования органов грудной клетки.
Основанием для предварительной диагностики ВП в амбулаторных условиях являются следующие симптомы или по крайней мере 2 из них:
• острое начало, температура тела ≥38,0° С;
• кашель с мокротой, возможно малопродуктивный;
• физикальные признаки инфильтрации в легочной ткани (крепитация, хрипы, бронхиальное дыхание, притупление при перкуссии).
Диагноз ВП более вероятен при отсутствии у больного симптомов инфекции верхних дыхательных путей.
Диагноз ВП является определенным (категория доказательности А) при наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и по крайней мере 2-х клинических признаков из числа следующих:
• острая лихорадка в начале заболевания (температура тела >38,0° С);
• кашель с мокротой;
• физикальные признаки пневмонической инфильтрации (фокус крепитации и/или мелкопузырчатые хрипы, жесткое бронхиальное дыхание, укорочение перкуторного звука);
• лейкоцитоз >10,0×109/л и/или палочкоядерный сдвиг (>10%).
Диагноз ВП неточный/неопределенный (категория доказательности А) при отсутствии или недоступности рентгенологического подтверждения очаговой инфильтрации в легких (рентгенография или крупнокадровая флюорография органов грудной клетки). При этом диагноз заболевания основывается на эпидемиологическом анамнезе, жалобах и соответствующих локальных симптомах.
Диагноз ВП маловероятен (категория доказательности А), если у пациента с лихорадкой, кашлем, одышкой, отделением мокроты и/или болью в грудной клетке рентгенологическое исследование недоступно и отсутствует соответствующая локальная симптоматика.
Критерии диагноза ВП отражены в таблице 1 [2].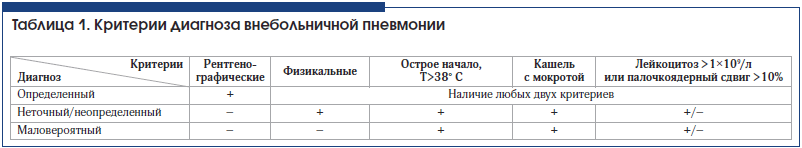
Рентгенологическая картина. Диагностика ВП практически всегда предполагает обнаружение очагово-инфильтративных изменений в легких в сочетании с соответствующей симптоматикой инфекции нижних дыхательных путей. Изменения на рентгенограмме органов грудной клетки (распространенность инфильтрации, наличие или отсутствие плеврального выпота, полости деструкции) соответствуют степени тяжести заболевания и в сочетании с клинической картиной могут служить ориентиром для выбора антибактериальной терапии.
Показания для компьютерной томографии:
а) очевидная клиническая симптоматика ВП, но отсутствие изменений в легких на рентгенограмме;
б) выявление нетипичных рентгенологических изменений у больного с предполагаемой пневмонией (обтурационный ателектаз, инфаркт легкого на почве тромбоэмболии легочной артерии, абсцесс легкого и др.);
в) рецидивирующие инфильтративные изменения в той же доле легкого (сегменте), что и в предыдущем эпизоде заболевания или при затяжном течении пневмонии (свыше 4-х недель).
Физикальное обследование. Информация, получаемая при физическом обследовании пациента, зависит от многих факторов, включая степень тяжести заболевания, распространенность пневмонической инфильтрации, возраст, наличие сопутствующих заболеваний. Примерно у 20% больных объективные признаки ВП могут отличаться от типичных или отсутствовать вовсе.
Клинические признаки. Такие симптомы ВП, как острая лихорадка, боль в грудной клетке и т. д., в начале заболевания могут отсутствовать, особенно у ослабленных пациентов и пожилых. Примерно у каждого 4-го пациента старше 65 лет отсутствует лихорадка, а лейкоцитоз отмечается лишь у 50–70%. Клиническая симптоматика может быть представлена утомляемостью, слабостью, тошнотой, анорексией, болями в животе, нарушением сознания. Нередко ВП дебютирует симптомами декомпенсации сопутствующих заболеваний.
При подозрении на пневмонию врач определяет:
• показания для госпитализации;
• антибактериальную терапию. Проведение дополнительных методов диагностики (лучевых и/или лабораторных) не должно влиять на время назначения антибактериальных препаратов.
Оценка тяжести состояния пациента с внебольничной пневмонией
При принятии решения о месте лечения пациента с ВП рекомендуется клиническая оценка по прогностической шкале Confusion-Respiratoryrate-Bloodpressure-65 (CRB–65) [3] и/или критериям синдрома системной воспалительной реакции (СВР) [4].
Шкала оценки тяжести CRB-65 (1 балл соответствует каждому присутствующему признаку):
• нарушение сознания;
• ЧД ≥30 в минуту;
• артериальное давление (систолическое АД
• возраст ≥65 лет.
Синдром СВР неспецифический и определяется как клинический ответ на неспецифические повреждения, имеющие инфекционное или неинфекционное происхождение.
Критериями для диагностики синдрома СВР является наличие 2-х или более из следующих критериев [4, 5]:
• температура тела >38° C или
• частота сердечных сокращений (ЧСС) >90 уд/мин;
• ЧД >20 в минуту или уровень PaCO2 (напряжение углекислого газа в артериальной крови)
• число лейкоцитов периферической крови (>12×109/л или 10% палочкоядерных форм).
Стационарному лечению подлежат:
• больные ВП или с подозрением на ВП, имеющие по шкале CRB-65 1 балл и более и/или синдром СВР (госпитализируются в экстренном порядке в круглосуточный стационар);
• пациенты с ВП или подозрением на ВП с оценкой тяжести по CRB-65 0 баллов, не имеющие признаков синдрома СВР (при наличии социальных показаний или желании пациента могут быть госпитализированы в круглосуточный или дневной стационар);
• пациенты старше 65 лет со следующими заболеваниями (состояниями), ассоциированными с осложненным течением ВП:
– хроническая обструктивная болезнь легких (ХОБЛ), тяжелая бронхиальная астма, сахарный диабет или сердечная недостаточность;
– предыдущая госпитализация год назад;
– постоянный прием системных глюкокортикостероидов;
– использование антибиотиков в предыдущем месяце;
– общее недомогание;
– спутанность/ослабление сознания;
– ЧСС>100 в минуту, температура тела >38° С, ЧД>30 в минуту, АД
Для всех возрастных групп с ВП наличие серьезных состояний, таких как злокачественные новообразования, печеночная и почечная недостаточность и другие заболевания, влияющие на иммунокомпетентное состояние, увеличивают риск осложнений.
Амбулаторному лечению подлежат больные ВП с низким риском летального исхода:
• возраст до 65 лет;
• сохраненный интеллектуальный статус;
• отсутствие клинико-анамнестических указаний на сопутствующие опухолевые заболевания, застойную сердечную недостаточность, цереброваскулярную патологию, заболевания почек и печени;
• ЧД≤20 в минуту;
• ЧСС≤90 в минуту;
• температура тела >35,0° С и ≤38,3° С;
• АД сист. >90 мм рт. ст.;
• при поражении не более одного сегмента легкого;
• с удовлетворительными бытовыми и материальными условиями;
• при возможности проведения рентгенологического исследования органов грудной клетки;
• согласие пациента на амбулаторное лечение.
Лечение
До настоящего времени антибиотики являются единственным научно обоснованным методом медикаментозной терапии ВП. Согласно Национальным практическим рекомендациям по диагностике, лечению и профилактике ВП, больные с ВП разделены на 4 группы с учетом тяжести заболевания, сопутствующей патологии, продолжительности и давности лечения антибактериальными препаратами [3]. В каждой группе больных ВП представлены наиболее вероятный спектр бактериальных возбудителей и перечень антибактериальных препаратов [6].
Макролидные антибиотики занимают одно из ведущих мест в антибактериальной терапии ВП различной этиологии. По фармакокинетическим характеристикам макролиды относятся к тканевым антибиотикам. К особенностям фармакокинетики наиболее часто назначаемых при лечении ВП антибиотиков (бета-лактамов и макролидов) относится способность макролидов к большей концентрации в очаге инфекции, чем в плазме крови (табл. 2) [7].
Успех антибиотикотерапии зависит от правильно выбранного препарата, своевременности его назначения, состояния пациента и резистентности бактериального патогена к лекарственному препарату, биодоступности и биоэквивалентности. Последнее относится к генерическим препаратам, столь широко представленным на отечественном фармакологическом рынке. Сравнительная характеристика фармакокинетических параметров в сыворотке крови и легочной ткани одного из широкопредставленных на фармакологическом рынке макролидных антибиотиков – оригинального азитромицина и его генериков (проверено в эксперименте на здоровых мышах) дана в таблице 3 [8]. ![Таблица 3. Сравнительная характеристика фармакокинетических параметров в сыворотке крови и легочной ткани оригинального азитромицина и его генериков [8] Таблица 3. Сравнительная характеристика фармакокинетических параметров в сыворотке крови и легочной ткани оригинального азитромицина и его генериков [8]](https://medblog.su/wp-content/uploads/2018/12/1545380106_197_makrolidy-znachenie-i-bezopasnost-dlya-lecheniya-pnevmonii-leshhenko-i-v.png)
Сравнение оригинального и генерического азитромицина показало сопоставимые результаты фармакокинетических параметров в сыворотке крови и существенные различия в отношении максимальной концентрации и продолжительности действия оригинального азитромицина по сравнению с генерическим препаратом в ткани легкого, что, безусловно, следует учитывать при выборе препарата.
Отличительной особенностью азитромицина от других макролидов является его не только бактериостатические, но и бактерицидные свойства. Бактерицидный эффект достигается благодаря способности азитромицина создавать очень большие внутриклеточные концентрации, губительные для многих патогенов, находящихся внутри клеток [9]. Азитромицин проявляет постантибиотический эффект и эффект постантибиотической субминимальной подавляющей концентрации против таких микроорганизмов, как Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae, Legionella pneumophila. Азитромицин – единственный макролид с природной активностью в отношении H. influenza; и по продолжительности постантибиотического эффекта при инфекциях, вызванных H. influenzae и L. Pneumophila, он превосходит кларитромицин [10, 11].
Известно, что азитромицин и другие макролиды обладают иммуномодулирующим и противовоспалительным действием. Уникальность азитромицина не только как антибиотика, обладающего антибактериальным, но и иммуномодулирующим свойством, может быть связана с особым строением молекулы. По химическому строению азитромицин является 15-членным макролидом и его коренное отличие от «классических» 14-членных макролидов состоит в том, что в состав его молекулы входит атом азота. В эксперименте на здоровых добровольцах, которые принимали азитромицин в дозе 500 мг/сут в течение 3-х дней, было продемонстрировано 2-фазное иммуномодулирующее действие препарата [12]. Первая фаза сопровождается быстрой, но преходящей стимуляцией дегрануляции нейтрофилов и усилением окислительного взрыва, что оптимизирует защитные функции иммунной системы. Вторая фаза иммуномодулирующего действия азитромицина начинается позднее и характеризуется уменьшением продукции интерлейкина-8 и усилением апоптоза нейтрофилов, что обеспечивает уменьшение выраженности воспалительной реакции. С противовоспалительным действием макролидов связано уменьшение гиперреактивности дыхательных путей, как правило, сопровождающей бронхолегочные инфекции [13]. Действительно, в исследованиях продемонстрированы лучшие результаты терапии макролидами у больных с ВП независимо от антимикробного эффекта, что вероятнее всего связано с их иммуномодулирующим действием. Например, как в экспериментальной, так и в клинической картине сепсиса, исследования продемонстрировали развитие макролид-индуцированной адгезии лейкоцитов, их деактивацию и снижение воспалительной продукции цитокинов [14, 15]. Еще одной характерной особенностью азитромицина является его антитоксическое действие, которое также вносит свой вклад в эффективность препарата. Азитромицин in vitro показал себя наиболее активным из группы макролидов в отношении подавления синтеза и высвобождения бактериальных токсинов, в частности, он снижает синтез пневмолизина пневмококками, включая высокорезистентные штаммы [16, 17].
Важным условием при выборе антибиотика выступают ожидаемая частота и тяжесть нежелательных явлений. Азитромицин характеризуется благоприятным профилем безопасности. Чаще других нежелательных явлений при его применении наблюдаются реакции со стороны желудочно-кишечного тракта (
Оценивая безопасность макролидов в отношении развития нежелательных сердечно-сосудистых событий, следует отметить, что результаты проведенных исследований убедительно свидетельствуют об их сердечно-сосудистой безопасности. Частота развития жизнеугрожающих аритмий при их применении чрезвычайно низка и не превышает 1 случая на 100 000 назначений [20]. В эксперименте, проведенном Poluzzi E. et al., и в исследовании H. Svanstrom et al. выявлено, что среди макролидов азитромицин оказывает наименьший аритмогенный эффект [12, 21]. Тем не менее определение факторов риска нежелательных сердечно-сосудистых событий (женский пол, структурные заболевания сердца, брадикардия, генетическая предрасположенность, электролитные нарушения, лекарственные взаимодействия, пожилой возраст, печеночная или почечная недостаточность) и их адекватная оценка позволят еще больше повысить безопасность использования макролидов [22]. Что касается гепатотоксичности, то по сравнению с многими антибиотиками азитромицин отличает наименьшая частота гепатотоксических реакций, в т. ч. и по сравнению с другими макролидами (≤0,06: 100 000) [23, 24]. В этой связи распространяемое мнение о гепато- и кардиотоксичности макролидов (азитромицина) недопустимы, т. к. это может привести к избыточному потреблению других классов антибиотиков и росту устойчивости микроорганизмов [25].
Эффективность и безопасность азитромицина обеспечивают препарату достойное место в лечении больных ВП. Согласно отечественным и международным рекомендациям, у взрослых больных с ВП нетяжелого течения азитромицин рекомендуется в качестве монотерапии и в составе комбинированной терапии в сочетании с бета-лактамными антибиотиками [2, 6, 26, 27].
Показаниями для назначения макролидов, в частности азитромицина, при нетяжелом течении ВП являются [2, 6, 26]:
• подозрение на «атипичную» этиологию заболевания (Mycoplasma pneumoniae, Chlamydia pneumoniaе, Legionella spp.);
• аллергия на β-лактамы;
• отсутствие эффекта при лечении β-лактамами.
Комбинированная антибактериальная терапия ВП, включающая макролиды, применяется при нетяжелом течении ВП у больных с сопутствующей патологией или при применении за последние 3 мес. антибактериальных препаратов ≥2 дней. Наиболее частое применение макролиды находят у больных с ВП, требующих госпитализации, особенно в отделение реанимации и интенсивной терапии [6, 26, 27]. В этом аспекте макролиды следует рассматривать не только в качестве средства «прикрытия» от внутриклеточных возбудителей, но и как антибиотик с потенцированием эффекта в отношении пневмококка [28]. Наиболее частым вариантом комбинированной антибактериальной терапии тяжелой ВП является сочетание цефалоспоринов III поколения и макролидов, причем назначение комбинации этих 2-х классов антибиотиков обязательно должно быть в качестве стартовой терапии. Только в этом случае достоверно сокращается пребывание пациента в отделении реанимации и интенсивной терапии [29].
В перспективном сравнительном исследовании оценена эффективность комбинированной терапии цефтриаксоном и азитромицином и того же цефалоспорина III поколения и кларитромицина у больных старше 65 лет с тяжелой ВП (n=603) [30]. Установлено сокращение стационарного лечения на 2,1 дня (p
Значение макролидов для лечения больных с тяжелым течением пневмонии подтверждается результатами, полученными на основании систематического обзора и метаанализа, включавшего 9850 пациентов в возрасте от 58 до 78 лет с ВП, находящихся в критическом состоянии [31]. Установлено, что использование макролидов в комбинации c бета-лактамными антибиотиками связано со значимым 18% относительным и 3% абсолютным снижением риска смертности в сравнении с другими режимами антимикробной терапии, не содержащими макролидных антибиотиков (отношение шансов (ОШ) 0,75; 95% доверительный интервал (ДИ) 0,58–0,96; р=0,02) [31]. Cравнительная оценка показателей смертности у больных тяжелой ВП, получавших бета-лактамы в сочетании с макролидами и бета-лактамы в сочетании с респираторными фторхинолонами (РФХ), показала тенденцию к уменьшению смертности при применении схем, включающих макролидные антибиотики (20% пациентов лечились бета-лактамами в сочетании с макролидами и 23% больных получали бета-лактамы в сочетании с РФХ (ОШ 0,83; 95% ДИ 0,67–1,03; р=0,09)), что дает право выбора лечащему врачу при лечении больных тяжелой ВП между макролидами (азитромицин или кларитромицин) и РФХ, назначаемыми в сочетании с цефалоспоринами III поколения [31].
Таким образом, в настоящее время макролидам принадлежит одно из ведущих мест в антибактериальной терапии ВП независимо от тяжести заболевания, а азитромицин является эффективным и безопасным представителем макролидных антибиотиков для лечения пневмонии.
Литература
1. Биличенко Т.Н., Чучалин А.Г., Сон И.М. Основные итоги развития специализированной медицинской помощи больным пульмонологического профиля на территории Российской Федерации за период 2004–2010 гг. // Пульмонология. 2012. № 3. С. 5–16 [Bilichenko T.N., Chuchalin A.G., SonI. M. Osnovnie itogi razvitija specializirovannoi medicinskoi pomochi bolnim pulmonologicheskogo profilja naterritorii Rosiiskoi Federacii za period 2004–2010 gg. // Pulmonologia. 2012. № 3. S. 5–16 (in Russian)].
2. Клинико-организационный алгоритм ведения больных с внебольничной пневмонией. Методические рекомендации / под общ. ред. А.Г. Чучалина. 2-е изд., перераб. и доп. М.: Эликон-Дизайн, 2012. С. 70 [Kliniko-organozacionni algoritm vedenia bolnih s vnebolnichnoi pnevmoniei. Metodicheskie rekomedacii / рod red. A.G. Chuchalina. 2-e izd. M.: Elikon-Dizain. 2012. S. 70 (inRussian)].
3. Charles P.G.P., Wolfe R., Whitby M. et al. SMART-COP: a tool for predicting the need intensive respiratory or vasopressor support in community-acquired pneumonia // Clin. Infect. Dis. 2008. Vol. 47. P. 375–384.
4. Bone R.C. Toward an Epidemiology and Natural History of SIRS // JAMA. 1992. Vol. 268. P. 3452–3455.
5. Dellinger R.P., Levy M.M., Carlet J.M. et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008 // Intensive Care Med. 2008. Vol. 34(1). P. 17–60.
6. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. Пособие для врачей. М., 2010 [Chuchalin A.G., Sinopalnikov A.I., Kozlov R.S. i dr.Vnebolnichnaya pnevmoni yau vzroslich: prakticheskie rekomendacii po diagnostike, lecheniu i profilaktike. Posobiedlavrachei. M., 2010 (inRussian)].
7. Gordon E.M., Blumer J.L. Рharmacokinetics and pharmacodynamics: azithromycin concentrates in tissues // Pediatr. Infect. Dis. J. 2004. Vol. 23(Suppl 2). S.102–107.
8. Rivulgo V., Sparo M., Ceci M. et al. Comparative Plasma Exposure and Lung Distribution of Two Human Use Commercial Azithromycin Formulations Assessed in Murine Model: A Preclinical Study // BioMed Research International 2013: http://dx.doi.org/10.1155/2013/392010.
9. Odenholt-Tornqvist I.,Lowdin E., Cars О. Postantibiotic effects and postantibiotic sub-MIC effects of roxithromycin, clarithromycin, and azithromycin on respiratory tract pathogens // Antimicrob. Agents Chemother. 1995. Vol. 39. P. 221–226.
10. Fang G.D., Stout J.E., Yu V.L. Comparison of intracellular postantibiotic effect of azithromycin and clarithromycin vs. erythromycin against Legionella pneumophila serogroup 1. In: The 36th International Conference on Antimicrobial Agents and Chemotherapy, New Orleans, 1996; abstr. A91.
11. Andes D. Pharmacokinetic and pharmacodynamic properties of antimicrobials in the therapy of respiratory tract infections // Curr.Opin. Infect. Dis. 2001. Vol. 14. P. 165–172.
12. Poluzzi E., Rischi E., Motorola D. et al. Antimicrobial and the risk of torsade de pointes: the contribution from data mining of the US FDA Adverse Event Reporting System // Drug Saf. 2010. Vol. 33(4). P. 303–314.
13. Plouffe J., Schwartz D., Kolokathis A. et al. Clinical efficacy of intravenous followed by oral azithromycin monotherapy in hospitalized patients with community-acquired pneumonia. The Azithromycin Intravenous Clinical Trials Group // Antimicrob. Agents Chemother. 2000. Vol. 44(7). P. 1796–1802.
14. Parnham M.J. Immunomodulatory effects of antimicrobials in the therapy of respiratory tract infections // Curr. Opin. Infect. Dis. 2005. Vol. 18. P. 125–131.
15. Giamarellos-Bourboulis E.J. Immunomodulatory therapies for sepsis: Unexpected effects with macrolides // Int. J. Antimicrob. Agents. 2008. Vol. 32 (Suppl 1). S39–S43.
16. Shryock T.R., Mortensen J.E., Baumholtz M. The effects of macrolides on the еxpression of bacterial virulence mechanisms // J. Antimicrobial Chemotherapy. 1998. Vol. 41. P. 505–512.
17. Fukuda Y., Yanagihara K., Higashiyama Y. et al. Effects of macrolides on pneumolysin of macrolide-resistant Streptococcus pneumoniae // Eur.Respir. J. 2006. Vol. 27(5). P. 1020–1025.
18. Li H., Lui D-H., Chen L-L. et. al. Meta-Analysis of the Adverse Effects of Long-Term Azithromycin Use in Patientswith Chronic Lung Diseases // Antimicrobial Agentsand Chemotherapy. 2014. Vol. 58(1). P. 511–517.
19. Wilton L., Kollarova M., Heeley E., Shakir S. Relative risk of vaginal candidiasis after use of antibiotics compared with antidepressants in women: postmarketing surveillance data in England // Drug Saf. 2003. Vol. 26(8). P. 589–597.
20. Mosholder A.D., Mathew J., Alexander J.J. et al. Cardiovascular risks with azithromycin and other antibacterial drugs // N. Engl. J. Med. 2013. Vol. 368. P. 1665–1668.
21. Svanstrom H., Pasternak B., Hviid A. Use of Azithromycin and Death from Cardiovascular Causes // N. Engl. J. Med. 2013. Vol. 368. P. 1704–1712.
22. Галеева Ж.А., Зырянов С.К. Кардиотоксичность макролидных антибиотиков // Клин. микробиол. антимикроб. химиотер. 2015. № 17(4). С. 262–266 [Galeeva G.A., Zirjanov S.K. Kardiotoksichnost makrolidnich antibiotikov // Klin. Mikrob. Antimikrob. Himioter. 2015. № 17(4). S. 262–266 (in Russian)].
23. Синопальников А.И., Андреева И.В., Стецюк О.У. Безопасность макролидных антибиотиков: критический анализ // Клиническая медицина. 2012. № 3. С. 23–30 [Sinopalnikov A.I., Andreeva I.V., Stecuk O.U. Bezopastnost makrolidnich antibiotikov: kriticheskiianaliz // Klinicheskaja medicina. 2012. № 3. S. 23–30 (in Russian)].
24. Andrade R.J., Tulkens P.M. Hepatic safety of antibiotics used in primary care // J. Antimicrob. Chemother. 2011. Vol. 66(7). P. 1431–1446.
25. Козлов Р.С., Завалко Т.А., Кулагина В.В. и др. Резолюция Саммита специалистов по антимикробной терапии // Consilium Medicum. 2014. № 16(11). С. 33–36 [Kozlov R.S., Zavalkova T.A., Kulagina V.V. i dr. Rezolucija Sammita specialistov po antimikrobnoi terapii // Consilium Medicum. 2014. № 16(11). S. 33–36 (in Russian)].
26. Guidelines for the management of adult lower respiratory tract infections/Guest Editor: Didier Raoult. The official publication of the European Respiratory Society and European Society for Clinical Microbiology and Infectious Diseases // ClinMicrobiol Infect. 2011. Vol. 17(Suppl. 6). P. 1−24.
27. Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. М., 2014 [Klinicheskie rekomendacii po diagnostike, lecheniu i profilaktike tjageloi vnebolnichnoi pnevmonii u vzroslich. M., 2014 (in Russian)].
28. Girard D., Finegan S.M., Dunne M.W. et al. Enhanced efficacy of single-dose versus multi-dose azithromycin regimens in preclinical infection models // J. Antimicrob. Chemoter. 2005. Vol. 56(2). P. 65–71.
29. Stahl J.E., Barza M., DesJardin J. et al. Effects of macrolides as part of initial emperic therapy on length of stay in patients hospitalized with CAP // Arch. Intern. Med. 1999. Vol. 159. P. 2576–2580.
30. Sanchez F., Mensa J., Martinez J.A. et al. Is azithromycin the first-choice macrolide for treatment of community-acquired pneumonia? // Clin. Infect. Dis. 2003. Vol. 36. P. 1239–1245.
31. Sligl W.I., Asadi L., Eurich D.T. et al. Macrolides and Mortality in Critically Ill Patients With Community-Acquired Pneumonia: A Systematic Review and Meta-Analysis // Critical Care Medicine 2014. Vol. 42(2). Р. 420–432.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru