Введение
Повреждения мягких тканей сопровождают жизнь человека. Ушиб — это закрытое механическое повреждение мягких тканей, обусловленное кратковременным воздействием повреждающего фактора, которое не сопровождается образованием ран. При ушибе всегда происходит разрыв мелких сосудов с последующим кровоизлиянием, степень выраженности которого может быть различной. Повреждения мягких тканей, вне зависимости от причины, их вызвавших, составляют основное число обращений в учреждения первичного звена здравоохранения. Ушибы возникают, как правило, при падении или ударах о твердые предметы. У детей первых лет жизни преобладают бытовые, игровые травмы, ушиб мягких тканей лица и шеи. В более старшем возрасте основными видами травм являются транспортные, спортивные, уличные травмы [1]. Повреждение поверхностных мягких тканей всегда сопровождается отеком места повреждения в результате пропитывания кожи лимфой, кровью и местным асептическим воспалением. Величина отека зависит от площади повреждения подкожной клетчатки в месте ушиба. Так, например, в области свода черепа ввиду тонкого слоя подкожно-жировой клетчатки отек незначительный, тогда как даже слабые ушибы лица сопровождаются развитием выраженного отека [2]. Продолжающееся в глубине тканей кровотечение нередко приводит к дополнительной травме соседних тканей в результате их сдавливания, что сопровождается постепенным усилением боли и нарушением функции. Ушиб иногда сопутствует другим повреждениям (перелому и др.), поэтому всегда следует исключать более сложные повреждения и оценивать последствия травм [2, 3].
Травмы мягких тканей сопровождаются болью различной интенсивности. Так, при ушибах крупных нервов и их окончаний боль всегда резкая, простреливающая. При ушибах туловища и конечностей (плечо, бедро) могут формироваться напряженные гематомы, с распирающими болями, иногда с поверхностным онемением.
Лечение ушибов мягких тканей традиционно направлено на устранение вышеперечисленных симптомов и исключение более тяжелой патологии [4]. В настоящее время существуют стандарты лечения — клинические рекомендации по оказанию скорой медицинской помощи при повреждениях мягких тканей, где особое место отводится вопросам иммобилизации, туалету раны и обезболиванию [5]. Введение опиоидных и неопиоидных анальгетиков рекомендовано проводить в сочетании с антигистаминными препаратами (метамизолом натрия, тримеперидином, дифенгидрамином). Необходимо как можно раньше выполнить иммобилизацию. Даже при легких повреждениях лучше наложить на ушибленное место тугую повязку или выполнить иммобилизацию ортезом. Это обеспечит покой ушибленного сегмента, нормализует микроциркуляцию, уменьшит двигательную активность. Некоторые ортезные изделия обладают эффектом микромассажа, что тоже благотворно влияет на репаративные процессы. Вместе с этим проводится анальгезирующая терапия. Эти мероприятия необходимо выполнять в течение первых 3 сут. Затем возможно применение согревающих процедур, физиотерапевтических мероприятий. Местную терапию мазями и гелями возможно применять с 1-х суток, если они не обладают согревающим эффектом и не увеличивают проницаемость сосудов.
Ушиб мягких тканей, а соответственно, и боль неотъемлемо связаны между собой. Боль — это своеобразное психофизиологическое состояние человека, возникающее в результате воздействия сверхсильных или разрушительных раздражителей и вызывающих функциональные или органические нарушения в организме. Причем боль носит субъективный характер, ее восприятие основано на личном опыте, связанном с повреждением в раннем периоде жизни. Ее перцепция определяется не только источником боли, но и такими, на первый взгляд, неочевидными факторами, как психофизическая и эмоциональная характеристика индивидуума, его культурный уровень, семейное обучение и многие другие. Наиболее часто она характеризуется как психофизическое состояние человека, являющееся характерной реакцией на различные органические и функциональные нарушения, вызванные действием разнообразных раздражителей. Боль одновременно является физическим ощущением и эмоциональной реакцией на него. Эксперт по вопросам боли Марго Мак Кеффри дает свое емкое определение — это «все, что, по словам пациента, ранит его».
Функционирование ноцицептивной системы опосредовано нейрохимическими механизмами, реализуемыми эндогенными пептидами и медиаторами, среди которых гистамин, субстанция Р, кинины, простагландины, лейкотриены, ионы калия и водорода [4–6]. При боли активируются процессы гиперкоагуляции, пероксидного окисления липидов, увеличивается содержание протеолитических ферментов, что вызывает деструкцию тканей. Боль способствует развитию тканевой гипоксии, дистрофических процессов
и нарушению микроциркуляции в тканях. Это, в свою очередь, усиливает альтерацию травмированных тканей [7].
Таким образом, боль является сложным психофизиологическим феноменом, который как с этической стороны, так и с позиции нормативно-правового регулирования требует лечения, направленного на облегчение боли [8]. Понимание сложности ее природы, механизмов развития и регулирования позволяет дифференцированно подходить к вопросу выбора анальгетической терапии.
К одним из наиболее эффективных средств защиты периферических ноцицепторов, не вызывающих депрессию витальных функций, относят нестероидные противовоспалительные препараты (НПВП). Современная концепция эффективного обезболивания ушибов и других видов травм предполагает мультимодальный подход — воздействие на различные звенья проведения болевой импульсации. В связи с этим целесообразно сочетать введение НПВП с опиатами или опиоидами при сильном болевом синдроме, например при шокогенных травматических повреждениях.
Нестероидные противовоспалительные препараты являются препаратами выбора при лечении легкой и умеренной боли. В основе их противовоспалительного действия лежит ингибирование циклооксигеназы (ЦОГ). Одним из представителей НПВП является кетопрофен, выпускаемый в различных формах (таблетированной, инъекционной, наружной). Тройной эффект — противовоспалительный, анальгезирующий и жаропонижающий — обусловлен блокированием ферментов ЦОГ-1 и ЦОГ-2 и, частично, липоксигеназы, что приводит к подавлению синтеза простагландинов (в т. ч. в ЦНС, вероятнее всего, в гипоталамусе) и тромбоксанов. Кетопрофен стабилизирует in vitro и in vivo липосомальные мембраны, при высоких концентрациях in vitro подавляет синтез брадикинина и лейкотриенов. Не оказывает отрицательного влияния на состояние суставного хряща [9].
С точки зрения соотношения противовоспалительной и анальгетической активности кетопрофен представляется оптимальной молекулой. Так, согласно данным экспериментального исследования с использованием модели зубной боли, кетопрофен обладает наиболее выраженным противовоспалительным эффектом по сравнению с многими НПВП, при этом показатель клинической эффективности (суммарное снижение боли через 4 ч) наибольший для кетопрофена [10]. Важно отметить, что эти экспериментальные данные были подтверждены данными метаанализа 13 РКИ: в отношении купирования умеренной и тяжелой боли кетопрофен существенно превосходит диклофенак и ибупрофен [11].
Несмотря на то, что кетопрофен является «традиционным» неселективным НПВП, он в меньшей степени способен вызывать НПВП-ассоциированные осложнения со стороны желудочно-кишечного тракта и сердечно-сосудистой системы — данные финского популяционного исследования по оценке причин развития 9191 события в верхних отделах ЖКТ (в т. ч. случаи крово-течения, язв и перфорации). Согласно полученным результатам вероятность развития серьезных осложнений со стороны ЖКТ при использовании кетопрофена была ниже в сравнении с другими НПВП, например диклофенаком. Кетопрофен демонстрировал аналогичный или даже меньший риск развития патологии ЖКТ, чем ряд селективных НПВП [9–11]. Минимальное негативное влияние кетопрофена на состояние сердечно-сосудистой системы продемонстрировано в ряде масштабных эпидемиологических исследований.
В исследовании анальгетического эффекта кетопрофена в острый период травмы у пострадавших с различными скелетными повреждениями было отмечено начало обезболивающего эффекта уже через 12,2±2,6 мин после внутримышечного применения 100 мг кетопрофена. Применение 200 мг позволило сократить ожидание развития анальгезии до 8,2±2,2 мин. При этом у больных с тяжелой скелетно-мышечной травмой кетонал применялся в дозе 200 мг в комбинации с внутривенным введением трамадола (100 мг), при этом обезболивающий эффект реализовывался через 5,8±0,9 мин, что было быстрее по сравнению с монотерапией трамадолом в той же дозировке (6,0±1,2 мин) [12].
Цель исследования: определить эффективность анальгетической терапии при ушибах верхних и нижних конечностей.
Материал и методы
Проведено пилотное проспективное сравнительное исследование, в которое включено 54 пациента с ушибом мягких тканей плеча (n=27) и бедра (n=27). Ушибы у всех пациентов характеризовались образованием подкожного или внутрикожного кровоизлияния, отеком мягких тканей без повреждения мышц. Критерии включения: возраст 25–50 лет, компенсированная коморбидная патология. Критерии невключения: декомпенсированная или требующая постоянной медикаментозной поддержки сопутствующая патология; тяжелые повреждения мягких тканей; давность повреждения более 1 сут; самостоятельный прием анальгезирующих и других медикаментозных средств с целью обезболивания до первичного посещения. Все пациенты подписывали информированное согласие на участие в исследовании.
При первичном осмотре всем больным выполнено УЗИ места повреждения для исключения более тяжелой патологии. Оценку отека мягких тканей определяли на каждом посещении по объему окружности поврежденного сегмента конечности, измеряя в верхней, средней и нижней трети, и сравнивали с неповрежденной конечностью. Восстановление функции оценивали по возможности выполнения пациентом сгибания в локтевом и плечевом суставе и приседания не менее 10 раз, а также удержания груза 2,5 кг более 2 мин в вытянутой руке.
В зависимости от получаемой формы препаратов пациенты были разделены на 8 групп. 1-я группа (n=6) — пациенты с повреждением верхней конечности, получавшие таблетки кетопрофена (Кетонал®) в дозировке 100 мг 1 р/сут; 2-я группа — пациенты с повреждением верхней конечности (n=6), получавшие таблетки диклофенака в суточной дозировке 100 мг; 3-я группа (n=7) — пациенты с повреждением нижней конечности, получавшие таблетки кетопрофена в дозировке 100 мг 1 р/сут; 4-я группа (n=7) — пациенты с повреждением нижней конечности, получавшие таблетки диклофенака в дозировке 100 мг; 5-я группа (n=7) — пациенты с повреждениями верхней конечности, в курации которых использовали инъекционную форму кетопрофена в суточной дозировке 100 мг; 6-я группа (n=7) — пациенты с повреждениями верхней конечности, в лечении которых использовали инъекционную форму диклофенака 100 мг; 7-я группа (n=7) — пациенты с повреждениями нижней конечности, получавшие кетопрофен в инъекциях в дозе 100 мг; 8-я группа (n=7) — пациенты с повреждениями нижней конечности и применением инъекционной формы диклофенака.
У всех пациентов помимо анальгезирующей терапии в 1-е сутки проводили иммобилизацию тугой повязкой места повреждения и применяли охлаждающие процедуры. При повторном визите (на 2-е сутки и далее ежедневно) оценивали интенсивность боли по ВАШ, выраженность отека. Лечение и наблюдение за пациентами прекращали при достижении стойкого анальгезирующего эффекта (по ВАШ), отсутствии нарастания отека мягких тканей, восстановлении функции конечности.
Результаты и обсуждение
Средний возраст пациентов составил 44,7 года. Соотношение мужчин и женщин было 1:1.
Как видно на рисунке 1, при ушибах верхней конечности кетопрофен в таблетках начинал проявлять свою активность уже на 10-й минуте, при ушибах нижней конечности — несколько позже, на 20-й минуте. Применение инъекционной формы (рис. 2) обеспечивало выраженный обезболивающий эффект уже на 5-й минуте. Как таблетированная, так и инъекционная форма кетопрофена продемонстрировали преимущество перед диклофенаком. К 3–4-м суткам во всех случаях удавалось добиться полного купирования боли. Продолжительность анальгезирующего действия препаратов не изучали ввиду большой психоэмоциональной составляющей и малой выборки пациентов. Особенностью оценки болевого синдрома при первичном обращении явилось то, что пациенты с ушибом плеча оценивали боли на 2–3 балла выше, чем пациенты с ушибом бедра (6–8 баллов).
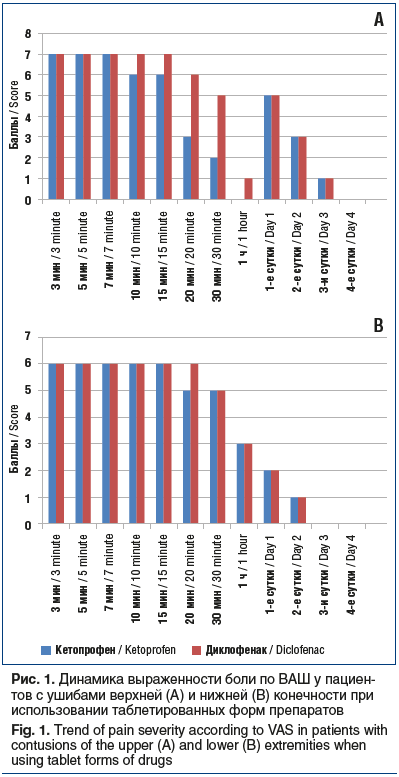
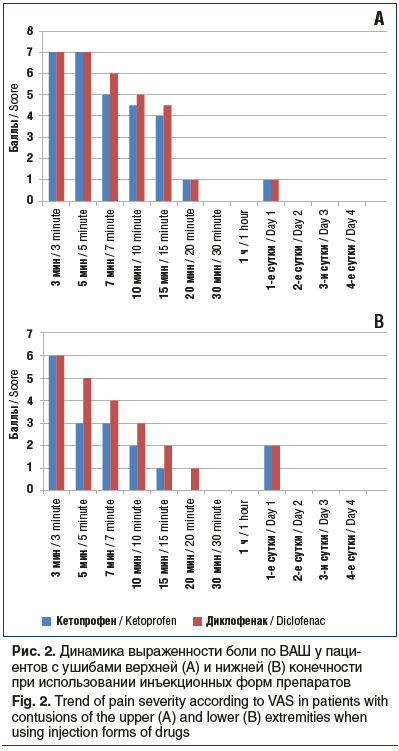
Хотелось бы отметить, что, несмотря на эффективность инъекционной формы препарата, формой выбора для пациентов с повреждением руки, согласно опросу, оставалась таблетированная форма. У пациентов с повреждениями ноги предпочтительной оказалась инъекционная форма. Здесь приходится констатировать парадокс: при более выраженном болевом синдроме при ушибе верхней конечности более эффективная инъекционная форма используется значительно реже, чем у пациентов с повреждением нижней конечности.
Заключение
Таким образом, данное пилотное исследование подтвердило эффективность и быстрое начало анальгетического эффекта кетопрофена в лечении ушибов мягких тканей. Использование препарата позволяет полностью купировать болевой синдром в течение 3 сут. Полученные в рамках небольшой выборки данные дают основания расширить группу наблюдения для увеличения мощности исследования, сформировав клинические группы в зависимости от вида, степени повреждения и локализации травмы.
Сведения об авторах:
Жуков Дмитрий Викторович — к.м.н., доцент кафедры травматологии и ортопедии ФГБОУ ВО НГМУ Мин-
здрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-4334-217X.
Устикова Нина Васильевна — врач-ревматолог ФГБУ «ННИТО им. Я.Л. Цивьяна» Минздрава России; 630091, Россия, г. Новосибирcк, ул. Фрунзе, д. 17.
Прохоренко Валерий Михайлович — д.м.н., профессор, заведующий кафедрой травматологии и ортопедии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ведущий научный сотрудник ФГБУ «ННИТО им. Я.Л. Цивьяна» Минздрава России; 630091, Россия, г. Новосибирcк, ул. Фрунзе, д. 17.
Контактная информация: Жуков Дмитрий Викторович, e-mail: zhukdv@ngs.ru. Источник финансирования: публикация осуществлена при поддержке АО «Сандоз». Конфликт интересов: авторы получили вознаграждение за написание статьи. Никто из авторов не имеет финансовой заинтересованности в представленных материалах, методах и результатах. Статья поступила 22.03.2021, поступила после рецензирования 14.04.2021, принята в печать 28.04.2021.
About the authors:
Dmitry V. Zhukov — Cand. of Sci. (Med.), Associate Professor of the Department of Traumatology and Orthopedics, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-4334-217X.
Nina V. Ustikova — rheumatologist, Novosibirsk Research Institute of Traumatology and Orthopedics named after Ya.L. Tsivyan; 17, Frunze str., Novosibirsk, 630091, Russian Federation.
Valery M. Prokhorenko — Dr. of Sci. (Med.), Professor, Head of the Department of Traumatology and Orthopedics, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; leading researcher of the Novosibirsk Research Institute of Traumatology and Orthopedics named after Ya.L. Tsivyan; 17, Frunze str., Novosibirsk, 630091, Russian Federation.
Contact information: Dmitry V. Zhukov, e-mail: zhukdv@ngs.ru. Financial Disclosure: this article was published with the support of JSC Sandoz. Conflict of interests: authors received a reward for preparing a paper. No authors have a financial or property interest in any material, method or results mentioned. Received 22.03.2021, revised 14.04.2021, accepted 28.04.2021.
.
Информация с rmj.ru