Комплексные биорегуляционные препараты в терапии остеоартрита
Содержание статьи
Введение
Современное общество переживает обусловленный постарением населения демографический кризис, который затронул практически все экономически развитые и многие развивающиеся страны мира, включая Российскую Федерацию. Среди возраст-ассоциированных заболеваний на одно из первых мест выходит хроническая неинфекционная патология: ишемическая болезнь сердца, гипертоническая и цереброваскулярная болезнь, сахарный диабет, рак и др. В этом ряду дегенеративные костно-мышечные заболевания являются основной причиной инвалидизации и снижения качества жизни вследствие формирования суставной боли и ограничения повседневной двигательной активности, что увеличивает затраты государства на оказание медицинской и социальной помощи населению. Известно, что стоимость стационарного лечения пациентов 70 лет и старше примерно в 7 раз превышает прямые и косвенные затраты на лечение молодых взрослых. Потребность в оказании первичной медико-санитарной и специализированной медицинской помощи у граждан старшего возраста выше, чем у трудоспособного населения.
Важной клинической особенностью развития болезней в старшем возрасте является их сочетание, которое в научной литературе получило название коморбидности. В среднем у одного человека старше 60 лет выявляются 4–5 различных хронических заболеваний, что оказывает существенное влияние на выбор адекватной лечебной тактики. Наличие сочетанной патологии не позволяет врачу в полной мере применять научно обоснованные медицинские стандарты, поскольку комбинированная лекарственная терапия, в свою очередь, сопряжена с риском развития нежелательных реакций, которые в подобных случаях могут носить непредсказуемый характер.
Улучшению и сохранению здоровья людей в пожилом возрасте способствует профилактика возраст-ассоциированных заболеваний и гериатрических синдромов, направленная на коррекцию модифицируемых факторов риска, раннее выявление болезней, оптимальное применение немедикаментозных и медикаментозных методов лечения.
Правительство Российской Федерации разработало и приступило к реализации программы системной поддержки и повышения качества жизни граждан старшего поколения «Старшее поколение» (2010–2024 гг.), предусматривающей увеличение периода активного долголетия и продолжительности здоровой жизни. В паспорте программы указаны мероприятия, направленные на поддержку физической активности пожилых людей, а также повышение доступности медицинской помощи и услуг с учетом потребностей граждан старшего поколения. Мероприятия будут способствовать переходу пожилых людей на позитивные, активные и ориентированные на развитие позиции. В сфере здравоохранения приоритетным будет являться обеспечение пожилых граждан диспансеризацией и профилактическими осмотрами вне зависимости от места проживания (город, сельская местность). Не менее 70% лиц старше трудоспособного возраста должны быть охвачены профилактическими осмотрами и диспансеризацией к концу 2024 г.
Наряду с заболеваниями сердечно-сосудистой системы, онкопатологией, эндокринными болезнями и когнитивными расстройствами в стареющем обществе неуклонно возрастает медико-социальная значимость болезней костно-мышечной системы. Среди этой группы заболеваний на первое место по распространенности выходят дегенеративно-дистрофические болезни суставов (остеоартрит) и позвоночника. Остеоартрит (ОА) относится к заболеваниям, которые не имеют обратного развития и носят необратимый характер. При этом уменьшение боли, поддержание активной повседневной деятельности и сохранение социальной функции являются основными целями лечения практически всех пациентов.
ОА относится к гетерогенной группе заболеваний со сходными клиническими проявлениями и исходами, при которых в патологический процесс вовлекаются все структуры сустава: суставной хрящ, связки, капсула, синовиальная оболочка и субхондральная кость. В последние годы многие авторы стали указывать на участие в прогрессировании заболевания мышц, осуществляющих активные движения в диартрозных суставах. Вместе с тем в настоящее время принято выделять фенотипические субтипы болезни, такие как метаболический, возрастной, генетический, травматический и некоторые другие. Такой подход в большей степени обусловлен необходимостью разработки персонифицированной терапии заболевания.
Эпидемиология ОА
Широкомасштабные эпидемиологические исследования, проведенные несколько десятилетий назад на основании клинических и рентгенологических критериев ОА, свидетельствуют о росте заболеваемости по мере увеличения возраста: от 1 до 10% среди людей моложе 30 и 40 лет соответственно и более 50% у лиц старше 60 лет. Приблизительно 80% населения старше 65 лет имеют рентгенологические признаки ОА [1, 2]. Исследование аутопсийного материала продемонстрировало, что изменения хряща в области суставных поверхностей наблюдались практически у всех людей старше 65 лет [3]. ОА развивается с одинаковой частотой как у мужчин, так и у женщин в возрасте 45–55 лет с постепенным преобладанием у женщин после 55 лет.
Тактика ведения пациентов с ОА
Следует признать, что явного регресса патологического процесса в гиалиновом хряще и субхондральной кости под влиянием одного простого или комбинированного лекарственного средства достичь не удается. Анализ результатов различных наблюдательных программ, которые применялись в реальной клинической практике, как правило, при оказании первичной амбулаторной медицинской помощи пациентам с ОА, указывает на то, что в краткосрочной перспективе купирование боли и ограничение воспаления являются вполне разрешимыми задачами [4, 5]. Для этой цели используется большой арсенал лекарственных средств, эффективность которых доказана в клинических исследованиях, и, соответственно, их перечень и алгоритм применения описаны в клинических рекомендациях или стандартах/протоколах лечения. Известно также, что эффективное лечение коморбидной патологии у пациентов с ОА может ограничить проявления самой болезни [6]. Не меньшее влияние на успех терапии ОА оказывают образовательные программы среди пациентов, приучая их самостоятельно контролировать болезнь, правильно с точки зрения соблюдения режимов и дозировок использовать назначенные врачом лекарственные средства, применять комплекс физических упражнений, гимнастику, физиотерапевтические воздействия, диету и т. д. [7]. Многочисленные эпидемиологические и клинические исследования позволяют говорить лишь о достижении стабилизации, выражающейся в уменьшении болевого синдрома.
Вместе с тем консервативная терапия не позволяет достигать существенного улучшения в течение длительного периода времени. Клиническая ремиссия в большинстве случаев сменяется обострением, вовлечением в процесс новых суставов, развитием стойких синовитов, бурситов и, как следствие,
рентгенологическим прогрессированием. Пациенты указывают на неудовлетворенность лечением. В таких случаях, вероятно, следует ставить вопрос о необходимости подключения хирургических методов лечения (эндопротезирование, околосуставная остеотомия, артродез).
Доступность и качество медицинской помощи пациентам с ОА достигаются применением на практике основных положений клинических рекомендаций по лечению ОА. В международных и отечественных рекомендациях выделяют следующие направления: нефармакологические методы воздействия, лекарственную терапию, хирургическое лечение. В последнее десятилетие сделан акцент на разработке и внедрении в клиническую практику нелекарственной терапии [8]. Однако перечень медицинских услуг, их количество, частота применения и продолжительность воздействия четко не определены. При этом каждое из трех направлений может иметь самостоятельное значение, грамотное их сочетание, вероятно, может оказать максимальное положительное воздействие на пациентов с ОА.
Анальгетики и НПВП
Несмотря на то, что для купирования болевого синдрома существует большое количество лекарственных средств (ЛС) с различными механизмами действия, ни одно из них не обладает абсолютной эффективностью. Основные противопоказания связаны с применением нестероидных противовоспалительных препаратов (НПВП), особенно у пациентов с сопутствующими заболеваниями сердечно-сосудистой системы и желудочно-кишечного тракта, но не ограничиваются ими. Исследование, проведенное в Голландии, показало, что артериальная гипертензия, ишемическая болезнь сердца и ОА сочетаются с частотой 20 и 18% соответственно среди людей в возрасте от 55 до 85 лет [9]. Американское общество гериатров (AGS) в очередной раз опубликовало перечень препаратов, которые нежелательно использовать у пожилых пациентов (2012, 2015). Так, в «стоп-лист» попали все НПВП (селективные и неселективные ингибиторы циклооксигеназы-2). Поскольку среди пожилых людей распространен феномен полипрагмазии (полифармации), все они находятся в группе риска развития различных побочных эффектов. Также известно, что у пациентов старшего возраста не только возрастает частота нежелательных явлений, связанных с фармакотерапией, но и усиливается их тяжесть.
Требуется тщательный мониторинг медикаментозной терапии, особенно в тех случаях, когда лекарственный препарат назначается впервые. Необходимо соблюдать следующие положения:
обязательное документирование назначенного любого нового ЛС в амбулаторной карте или истории болезни;
обоснование терапевтической задачи при применении нового ЛС;
регистрация достигнутого эффекта или его отсутствия;
лабораторный контроль, позволяющий оценивать как эффективность, так и безопасность медикаментозной терапии;
периодический анализ и пересмотр всей медикаментозной терапии для решения вопроса о ее ограничении/сокращении (депрескрайбинг).
Имеются данные наблюдательных исследований, которые показали увеличение смертности и повышение риска сердечно-сосудистых событий среди пациентов с ОА коленных и тазобедренных суставов, что обусловлено выраженным ограничением функциональной активности и развитием серьезных нежелательных явлений, связанных с фармакотерапией.
Симптоматические медленнодействующие препараты
Несмотря на существующие разночтения вокруг использования ЛС, получивших название симптоматических медленнодействующих препаратов для лечения ОА, таких как глюкозамин сульфат, хондроитин сульфат и гидрохлорид, а также неомыляемых соединений сои и авокадо, все они широко используются в клинической практике в западноевропейских странах и РФ. Многочисленные исследования, метаанализы работ, проведенных за последние 30 лет, показали, что указанная группа препаратов дает положительный результат у пациентов с наличием выраженной боли в крупных суставах по сравнению с таковым при применении плацебо. Вместе с тем уже в двух больших клинических исследованиях не было продемонстрировано преимущества комбинированной терапии (глюкозамин сульфат кристаллический и хондроитин сульфат) по сравнению с плацебо в течение 6 мес. наблюдения [10, 11].
ЛС для внутрисуставного введения
Введение различных лекарственных препаратов локально (внутрисуставно) является одним из эффективных способов терапии ОА, прежде всего гонартроза. В клинической практике широко применяются глюкокортикоиды (ГК), гиалуроновая кислота, обогащенная тромбоцитами плазма. В последнее время дополнительно стали использовать классические хондропротекторы (хондроитина сульфат). Очевидно, что время наступления клинического эффекта, его выраженность и продолжительность у этих методов будут существенно различаться. Более того, не все ЛС, вводимые внутрисуставно, могут быть использованы при том или ином фенотипе ОА. Если обратиться к клиническим рекомендациям по профилактике и лечению ОА, опубликованным за последние 10 лет, то мы не найдем четкого алгоритма применения препаратов для внутрисуставного введения при ОА, а получим лишь сведения о преимуществах и недостатках конкретного метода лечения с точки зрения доказательной медицины. В ряде рекомендаций проведен лишь сравнительный анализ описанных методов, указывающий на относительное преимущество одних перед другими. Больше того, между различными рекомендациями не существует согласованной позиции, что затрудняет получение обобщенных результатов.
ГК, пожалуй, наиболее часто используются в случаях, когда объективно имеют место выраженные синовиты коленных суставов, с которыми консервативными методами не удается справиться, а комплексная терапия с применением НПВП, физиотерапевтических процедур и лечебной физкультуры не приносит ожидаемого эффекта. Вместе с тем продолжаются дебаты о целесообразности использования ГК, поскольку уровень доказательности у них слабый, а количество возможных побочных эффектов остается высоким. Также врачи хорошо осведомлены о недопустимости увлечения этим способом купирования воспаления в пораженных суставах. К основным рискам внутрисуставного введения ГК относят инфекции и ускорение деградации гиалинового хряща при частом их применении [12].
Не менее обсуждаемым методом лечения ОА является вискосупплементация (термин, используемый в англоязычной литературе с середины 1990-х гг.). В данном контексте речь идет о внутрисуставном введении гиалуроновой кислоты и ее дериватов. Обоснованием для их широкого применения стали исследования, которые показали возможность улучшения физико-химических свойств синовиальной жидкости при ОА крупных суставов. Гиалуроновая кислота (полисахарид) является одновременно главным компонентом хряща и синовиальной жидкости и обладает выраженными лубрикантными свойствами [13].
К настоящему времени проведено более 10 метаанализов различных клинических исследований, в которых изучались ближайшие и отдаленные эффекты гиалуроновой кислоты с различным молекулярным весом. N. Bellamy et al. (2006) опубликовали Кокрейновский систематический обзор, посвященный применению гиалуроновой кислоты и ее дериватов для лечения ОА коленных суставов [14]. В обзор были включены 76 клинических исследований, длительность последующего наблюдения достигала 18 мес.
В 40 клинических исследованиях в качестве контрольной группы использовалась группа плацебо (солевые растворы или артроцентез), в 10 — внутрисуставное введение ГК, в 6 — НПВП, в других — немедикаментозные методы лечения (физиотерапия, физические упражнения, артроскопия). 15 клинических исследований были сравнительными, в них изучалась эффективность различных коммерческих продуктов гиалуроновой кислоты.
В целом авторы сделали вывод о том, что гиалуроновая кислота является эффективным ЛС при гонартрозе, ее применение приводило к существенному снижению интенсивности боли и улучшению функции сустава. Длительность эффекта гиалуроновой кислоты оказалась больше, чем у ГК, хотя сам эффект несколько отсрочен по времени.
Экспериментальные и клинические исследования показали, что лучше снижают боль в суставе препараты с молекулярным весом от 500 тыс. до 4 млн дальтон. Вместе с тем существует предположение, что для достижения эффекта важен не молекулярный вес, а концентрация гиалуроновой кислоты [15]. В отношении нежелательных явлений имеются сведения о том, что применение гиалуроновой кислоты может вызвать обострение артрита (вплоть до псевдосептических реакций), но чаще подобные осложнения развиваются при использовании препаратов с высоким молекулярным весом.
В последние 10 лет обозначился повышенный интерес к использованию ростовых факторов из аутологичных тромбоцитов при их внутрисуставном введении для лечения ОА коленных суставов. Известно, что обогащенная тромбоцитами плазма оказывает регенеративное и противовоспалительное действие на ткани, в т. ч. при ОА.
L. Shen et al. провели систематический обзор и метаанализ 14 рандомизированных клинических исследований (2017) для оценки эффекта обогащенной тромбоцитами плазмы на боль и функцию при ОА коленных суставов. В метаанализ вошли данные о 1423 пациентах. Исследование показало преимущество обогащенной тромбоцитами плазмы перед внутрисуставным введением гиалуроновой кислоты, ГК, солевых растворов, озона через 3–12 мес. после последней процедуры [16].
Таким образом, при прогрессирующем характере ОА коленных суставов, когда консервативными методами лечения не удается достигнуть желаемого результата, целесообразно проводить внутрисуставное введение активных ЛС, таких как ГК, гиалуроновая кислота, хондроитина сульфат, обогащенная тромбоцитами плазма. В отношении каждого из перечисленных средств имеются клинические доказательства их эффективности и безопасности.
Возможности применения ЛС Цель® Т и Траумель® С при ОА
Наряду с известными традиционными методами лечения ОА существуют альтернативные воздействия, не получившие статуса доказательности в силу различных причин, в т. ч. из-за сложности организации клинических исследований. К числу таких методов относят терапию биорегуляционными препаратами, которые широко применяется при различных заболеваниях суставов. Комплексные биорегуляционные препараты — это ЛС, получаемые исключительно из компонентов природного происхождения. В настоящее время для их производства используется около 500 видов лекарственных трав. Несмотря на то, что в целом механизм их действия при приеме внутрь малоизучен, экспериментальные исследования позволяют утверждать, что многие из них обладают противовоспалительным, иммуномодулирующим, противомикробным действием. В ряде случаев положительный эффект терапии биорегуляционными препаратами был установлен эмпирически.
Пожалуй, особую популярность приобрели ЛС, созданные в Германии несколько десятков лет назад компанией Biologische Heilmittel Heel. В настоящее время для практического применения выпускаются многокомпонентные препараты, получившие название Цель® Т (Zeel® T) и Траумель® С (Traumеel® S), в различных формах: раствор для внутримышечных и периартикулярных инъекций, таблетки и мазь для наружного применения. Эти три лекарственные формы позволяют варьировать схему терапии, адаптируя ее к конкретным обстоятельствам и индивидуальным предпочтениям пациента.
Цель® Т и Траумель® С содержат флавоноиды, известные своими антиоксидантными свойствами [17]. Компоненты препарата оказывают влияние на высвобождение макрофагами провоспалительных цитокинов, которые играют ведущую роль в развитии хронического воспаления и ангиогенеза. В эксперименте на животных было показано, что терапия индуцированного артроза препаратом Цель® Т привела к уменьшению эрозий хряща по сравнению с таковыми в контрольной группе. При этом уровень васкуляризации был во много раз меньше, чем в группе сравнения. Цель® Т обладает способностью ингибировать сосудистый эндотелиальный фактор роста [18, 19]. Считается, что эффект многокомпонентных препаратов значительно превышает изолированное действие каждого из ингредиентов за счет явления синергизма.
В литературе имеются ссылки на несколько рандомизированных клинических и наблюдательных исследований, в которых был продемонстрирован клинический эффект Траумель® С при острых травматических повреждениях различных мягких тканей (эпикондилитах, тендинитах), травматическом гемартрозе, синдроме карпального канала, «замороженном плече».
В 2014 г. были опубликованы результаты рандомизированного клинического исследования (MOZArT) с включением 232 пациентов с ОА коленного сустава, средний возраст которых составил 59,5 года [20, 21]. На фоне терапии препаратами Траумель® С и Цель® Т поочередно внутрисуставно на протяжении 3 нед. отмечено достоверное снижение интенсивности боли (на 60%) по сравнению с исходным состоянием, в соответствии с оценкой по шкале WOMAC (А — при осуществлении обычной нагрузки; В — после прохождения 50 футов = 15 метров) (рис. 1).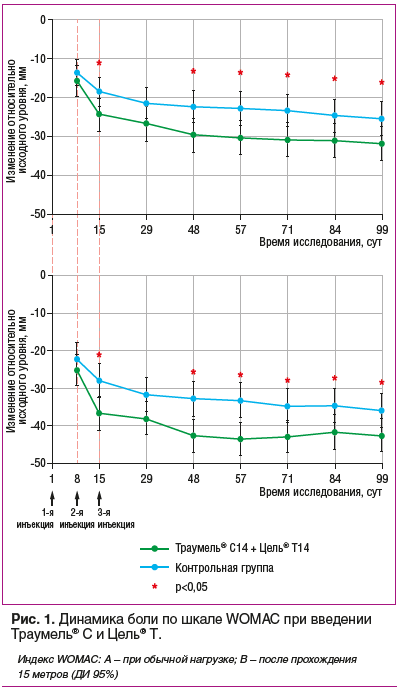
Комбинированное введение препаратов Траумель® С
и Цель® Т оказалось значительно эффективнее плацебо, а клинический эффект сохранялся на протяжении 3 мес. Post hoc анализ показал, что к концу исследования минимально значимой клинической эффективности в группе вмешательства достигли 48,7% пациентов, а в контрольной группе (солевой раствор) — лишь 32,4% больных с ОА (р=0,0054).
Заключение
Главным достоинством терапии биорегуляционными препаратами является крайне низкая частота регистрации нежелательных явлений [22–24]. Это дает возможность назначать такие препараты в случаях, когда высоки риски развития побочных эффектов традиционных ЛС, прежде всего НПВП. Выбор в пользу данного класса препаратов может быть связан с предпочтениями самого пациента. В то же время биорегуляционные препараты природного происхождения могут стать дополнительным компонентом комплексного лечения ОА, а не являться только его альтернативой.
Информация с rmj.ru




