Содержание статьи
Комплексное исследование спинномозговой жидкости при
бактериальных гнойных менингитах
М. В. Нагибина*, кандидат медицинских наук
Ю. Я. Венгеров*, доктор медицинских наук, профессор
Д. В. Чернышев**
Т. М. Коваленко**
Т. Н. Молотилова**, кандидат медицинских наук
Е. П. Михалинова**
С. Е. Раздобарина**
Т. С. Свистунова**, кандидат медицинских наук
Е. В. Беликова**
Л. Б. Байкова**
Т. Ю. Смирнова**
А. П. Сафонова***
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ,
** ГБУЗ ИКБ № 2 ДЗМ,
*** ФБУН ЦНИИЭ Роспотребнадзора РФ, Москва
Бактериальные гнойные менингиты (БГМ) занимают ведущее место в структуре
нейроинфекций. Несмотря на существенные успехи в лечении БГМ летальность на
протяжении последних 40 лет остается на стабильном уровне 6–24% в зависимости от
этиологии БГМ и качества лечения [1–5]. Исследования, проведенные в 2008–2014
гг., повысили качество оказания медицинской помощи больным БГМ благодаря в том
числе разработке и внедрению новых методов исследования спинномозговой жидкости
(СМЖ): полимеразной цепной реакции (ПЦР), уровня лактата, D-димера фибрина (D-ДФ),
лактатдегидрогеназы (ЛДГ) и ее изоформ, фракций белка, рН, рО2 и рСО2,
исследованию показателей местного гуморального и клеточного иммунитета.
Материалы и методы исследования
Исследована СМЖ у 1806 больных БГМ различной этиологии, группу сравнения
составили 25 больных серозными вирусными менингитами и 10 пациентов с
невоспалительным поражением центральной нервной системы (ЦНС). Спинномозговая
пункция осуществлялась при поступлении в стационар (острый период болезни), на
3–5 дни (осложненное течение) и на 8–18 дни лечения.
Результаты исследования
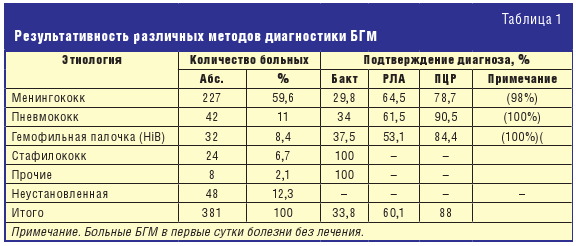
Бактериологическое исследование СМЖ, являясь «золотым стандартом»
диагностики, обеспечивает этиологическую расшифровку менингитов не более чем в
30–40% случаев [1, 4, 6], а иммунологические методы, в частности, реакция
латекс-агглютинации (РЛА), — в 60% случаев [7, 8]. Применение ПЦР позволяет
расшифровать этиологию менингита в поздние сроки заболевания и на фоне
проводимой антибактериальной терапии, когда бактериологический метод не дает
положительного результата и количество капсульных полисахаридных антигенов в СМЖ
не достаточно для их выявления методом РЛА [8–10]. Использование ПЦР также
помогает дифференцировать вирусные и бактериальные менингиты в сомнительных
случаях, определяя тактику лечения больного. Использование ПЦР повысило
эффективность расшифровки этиологии БГМ в среднем на 40% по сравнению с
результатами бактериологического и иммунологического исследований (N.
meningitidis, H. influenzaе и Str. рneumoniaе), а в комплексе с другими
методами этиологической диагностики менингитов позволило повысить расшифровку
БГМ с 46% до 88%, а при раннем поступлении и отсутствии лечения в 100% (табл.
1).
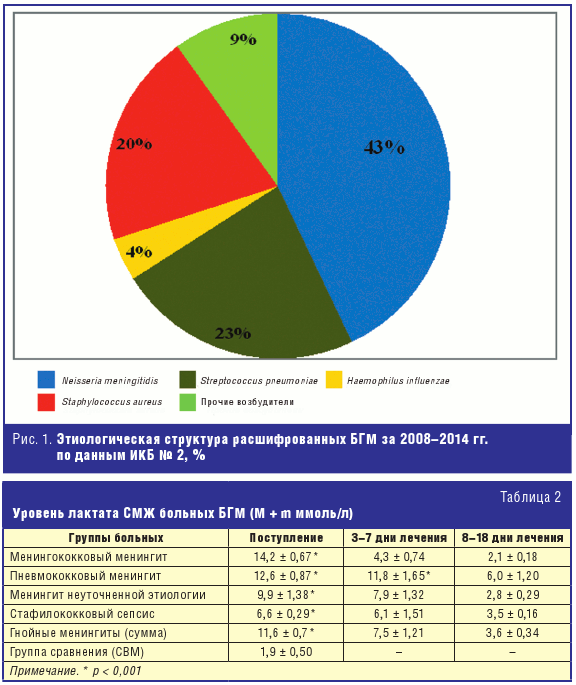
По результатам различных методов диагностики за последние 7 лет были выявлены
значительные изменения в структуре БГМ. По-прежнему ведущими возбудителями БГМ
(64%) являются менингококк и пневмококк, причем отмечается снижение числа
больных менингококковым менингитом в 1,25 раза (50,1–41%). Гемофильной менингит
регистрируется у детей до 5 лет, и в связи с применением вакцинации число
больных снизилось в 2,5 раза (с 9,9% до 4,0%). Существенным является возрастание
за последние 5 лет роли стафилококкового менингита до 22,3%. Заболеваемость
пневмококковым менингитом сохраняется на стабильно высоком уровне (23%). В
отдельных случаях возбудителями БГМ являлись листерии, клебсиеллы, различные
виды стрептококков, грамотрицательные бактерии — не более 9% (рис. 1).
Недостатком этиологической диагностики является длительность получения
результата (до трех суток) и часто отрицательный результат в случае приема ранее
антибактериальных препаратов. Поэтому для проведения эмпирической
антибактериальной терапии необходимо использование методов экспресс-диагностики,
которые позволяют в течение 2–3 часов дифференцировать БГМ от вирусных
менингитов и других заболеваний ЦНС, выявить критерии тяжести течения болезни. В
отечественной и зарубежной литературе имеются работы по исследованию в СМЖ
уровня лактата [11, 12], D-ДФ [12–15], изменения белков острой фазы [12, 16–18],
лактатдегидрогеназы (ЛДГ) и ее изоформ одновременно в СМЖ и крови [12, 19, 20],
показателей кислотно-основного состояния и электролитов в крови и СМЖ [21, 22].
Однако эти сообщения носят описательный характер, вне зависимости от этиологии,
тяжести, лечения и прогноза БГМ. Уровень лактата в СМЖ можно рассматривать как
интегральный показатель метаболической активности возбудителя, который находится
в обратной корреляции с глюкозой. Лактат СМЖ не зависит от уровня его в крови, в
отличие от глюкозы, т. к. образуется непосредственно в субарахноидальном
пространстве и является продуктом метаболизма бактерий и лейкоцитов [23, 24].
При БГМ различной этиологии уровень лактата возрастает до 5,5–25,0 ммоль/л (в
среднем 11,6 ± 0,7 ммоль/л, норма 1,1–2,2 ммоль/л). При вирусных серозных
менингитах, невоспалительных поражениях ЦНС этот показатель остается в пределах
0,9–3,9 ммоль/л (1,9 ± 0,5 ммоль/л). Уровень лактата свыше 4,0–4,5 ммоль/л
является достоверным критерием БГМ, что позволяет использовать его в качестве
надежного дифференциально-диагностического теста. Существенное значение имеет
параллельное определение лактата СМЖ и крови, поскольку бактериальные менингиты
всегда развиваются на фоне бактериемии или наличия гнойно-септического очага.
Уровень лактата крови, особенно при вторичных БГМ (пневмогенных, отогенных,
риногенных, сепсисе), определялся от 3,1 до 4,8 ммоль/л (норма 1–2,1 ммоль/л) в
остром периоде. Изменение в динамике уровня лактата СМЖ позволяет оценивать
эффективность лечения (табл. 2).
При эффективной антибактериальной терапии уже через 2–3 суток концентрация
лактата снижается в 1,5–2,0 раза и более, при отсутствии эффекта,
неблагоприятном исходе болезни положительная динамика отсутствовала, что
свидетельствует о сохранении возбудителем биологической активности в
субарахноидальном пространстве. Таким образом, лактат СМЖ может использоваться
как диагностический, дифференциально-диагностический и прогностический
биохимический маркер при БГМ. Нами установлено наличие при менингитах в СМЖ
компонентов системы гемостаза и фибринолитической активности. Наибольший интерес
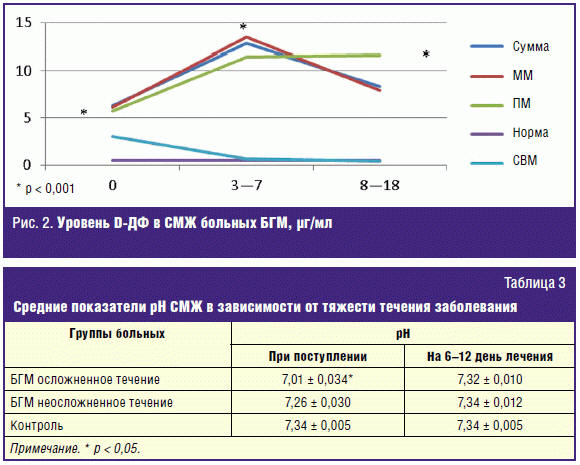
представляет определение D-ДФ, являющегося основным продуктом фибринолиза
[13–15]. В норме уровень D-ДФ в СМЖ не превышает 0,5 µг/мл (500 мг/мл). В остром
периоде болезни (при поступлении) в субарахноидальном пространстве количество
его возрастает и составляет выше 1,0 µг/мл у 90% обследованных. В процессе
фибринолиза воспалительного гнойного экссудата, на 3–7 дни лечения количество
D-ДФ в СМЖ продолжало увеличиваться в среднем в 1,7 раза (особенно при
пневмококковой этиологии менингита) и варьировало у отдельных больных от 3 до 21
µг/мл (в среднем 13,5 ± 1,41 µг/мл), что было достоверно выше (p < 0,005), чем
при поступлении. При вирусных менингитах и невоспалительных заболеваниях ЦНС
уровень D-ДФ не превышал 3,0 µг/мл (1,05 ± 0,28 µг/мл) (рис. 2).
Содержание D-ДФ в СМЖ коррелирует и с другими показателями, характеризующими
выраженность воспалительного процесса в субарахноидальном пространстве.
Коэффициент корреляции с цитозом составил 0,48, с содержанием белка — 0,65, с
уровнем глюкозы — 0,65, с уровнем лактата — 0,73. При этом фибриноген у
обследованных больных в СМЖ отсутствовал, что свидетельствует о высокой
свертывающей активности СМЖ, приводящей к формированию фибринозных сгустков в
оболочках и веществе головного мозга. Таким образом, D-ДФ может использоваться
как диагностический маркер БГМ, а по динамике D-ДФ можно судить об эффективности
проводимой терапии и при отсутствии его снижения — прогнозировать
неблагоприятный исход болезни. Показателями, характеризующими БГМ, также
являются изменения кислотности СМЖ [21, 24, 25]. рН СМЖ в норме является
слабощелочной, соответствующей плазме крови за счет повышения pCO2 до
50–60 мм рт. ст. (норма 45 мм рт. ст.). При развитии БГМ ликвор у 84,5%
становился более кислым (рН 7,0–7,3). Также отмечается снижение pO2 в
СМЖ у более 50% больных до 40–45 мм рт. ст. (норма 60 мм рт. ст.), эти
показатели имели прямую корреляцию с тяжестью состояния больного (табл. 3).
При эффективной терапии в динамике к 3-му дню лечения при БГМ рН ликвора
повышается в среднем на 0,2 и составляет 7,25–7,35, повышается рО2
(более 60 мм рт. ст.), что указывает на улучшение кровотока в мозге, и снижается
pCO2, которые нормализуются при осложненном течении болезни к 5–8 дню
лечения. Таким образом, уровень рН СМЖ может служить диагностическим критерием
БГМ, объективным показателем тяжести течения болезни и критерием оценки
эффективности проводимой терапии. В СМЖ обнаружены почти все ферменты,
принимающие участие в обмене веществ в мозге [12, 24–27]. Однако вследствие
низкого содержания в СМЖ определение их активности связано с рядом трудностей.
Из обнаруженных ферментов большее диагностическое значение имеет ЛДГ — наиболее
чувствительный индикатор гипоксии и лактатрахии мозга. Активность ЛДГ в СМЖ
повышается при различных поражениях головного мозга (норма 5,0–40,0 Ед/л) [19,
20]. Причем исследование изоферментного спектра ЛДГ более информативно, чем
общей активности. У здоровых людей активность ЛДГ в СМЖ ниже, чем в сыворотке
крови, а изоферменты ЛДГ4 и ЛДГ5 чаще всего вообще не определяются. Так,
установлено, что активность ЛДГ1–2 в СМЖ имеет положительную корреляционную
связь с тяжестью травматического повреждения мозга [18]. Воспалительные
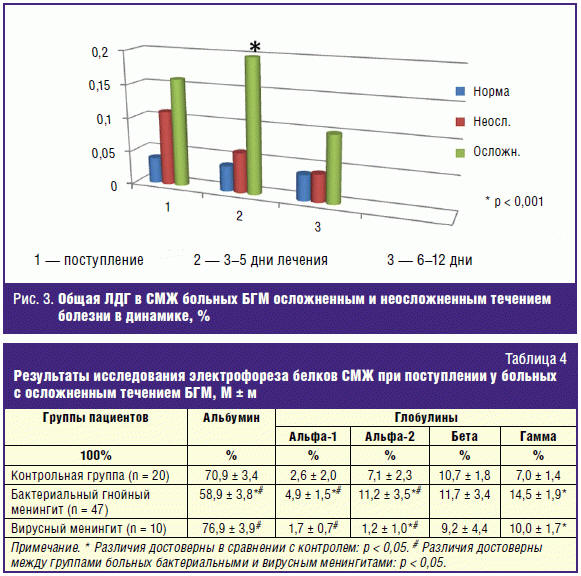
изменения при гнойных менингитах вызывает увеличение доли ЛДГ4–5. Исследование
изоформ ЛДГ (ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5) в СМЖ в остром периоде и в динамике
заболевания БГМ различной этиологии и степени тяжести показало, что при БГМ в
СМЖ происходит повышение активности ЛДГ4 и ЛДГ5 в 2,5 раза в остром периоде
болезни. Отмечено значительное повышение фракций ЛДГ4 и ЛДГ5 в СМЖ при всех БГМ,
причем при менингококковом менингите их уровень достигал максимума уже в 1-й
день, при пневмококковом — к 3–5 дню болезни (р < 0,05) и в среднем составлял
для ЛДГ4 — 17 ± 9,5% (в группе сравнения — 8,8 ± 5,7%), ЛДГ5 — 33,2 ± 12,4 (3,3
± 2,1). При летальном исходе заболевания увеличение фракций ЛДГ значительнее,
чем при БГМ среднетяжелого течения, что отражает вовлечение в процесс вещества
головного мозга при осложненном течении БГМ (рис. 3).
Установлена зависимость активности ЛДГ в СМЖ от содержания белка и рН [21,
23, 24]. При вирусном менингите в отличие от БГМ увеличивалась активность
изоферментов ЛДГ1 и ЛДГ3 в СМЖ, что коррелировало с содержанием лимфоцитов.
Таким образом, появление ЛДГ4–5 в СМЖ может служить диагностическим критерием
БГМ, а нормализация этих показателей говорит об эффективности проводимой
терапии. Повышение уровня белка в СМЖ при воспалительных процессах обусловлено
повышением проницаемости стенок сосудов [24, 28]. При этом отношение альбумина к
глобулинам колеблется в пределах 2–3. Альбумины и глобулины в СМЖ — важный
показатель проницаемости гематоликворного барьера (ГЛБ), а также являются
маркерами острого воспаления (белки острой фазы), т. к. их функция при БГМ —
распознавание чужеродных агентов, образование с ними комплекса антиген–антитело
и нейтрализация их [12, 28]. Протеинограмма СМЖ является значительно более
информативной по сравнению с величиной общего белка, так как в ряде случаев при
нормальном содержании общего белка в СМЖ выявляются существенные фракционные
изменения при электрофорезе [12, 24, 25]. Методом электрофореза белки СМЖ можно
разделить на альбумины, α-1-глобулины, α-2-глобулины, β-глобулины и γ-глобулины,
нами были проведены эти исследования в зависимости от тяжести состояния больного
в остром периоде и динамике лечения. Во всех группах больных БГМ в остром
периоде болезни отмечено повышение? -1-глобулинов в СМЖ, что представлено в
табл. 4.
Выявлена достоверная прямая корреляционная зависимость между одноименными
показателями: альбумином (R = 0,59) и α-2-глобулинами (R = 0,53) сыворотки крови
и СМЖ, что подтверждает повышенную проницаемость ГЛБ при БГМ. Установлено, что
при гнойных воспалительных процессах в СМЖ отмечается увеличение содержания α-1-,
α-2- и γ-глобулинов, что характеризует острый воспалительный процесс в
субарахноидальном пространстве, а процентное содержание альбумина уменьшается.
При поступлении в стационар (1–3 день болезни) при БГМ в СМЖ повышаются α-1-глобулины
— в 1,8 раза и α-2-глобулины — в 1,5 раза, в отличие от вирусного менингита, при
отсутствии таких отклонений в крови, что говорит о возможной продукции
специфических белков острой фазы в остром периоде болезни непосредственно в
сосудистых сплетениях головного мозга. С 5-го дня повышаются γ-глобулины в 2
раза по сравнению с контрольной группой (р < 0,05). В последующие дни (3–8 день
лечения) повышаются γ-глобулины СМЖ в 1,7–2,1 раза по сравнению с контрольной
группой (р < 0,05) у всех обследованных больных БГМ. Таким образом, увеличение α-1-
и α-2-глобулинов в СМЖ может иметь дифференциальное значение между БГМ и
менингитами вирусной этиологии (серозные) и является маркером острого воспаления
при БГМ в отличие от вирусных. Метод ликворного электрофореза позволяет оценить
эффективность терапии и имеет клинико-прогностическое значение при сопоставлении
белковых фракций СМЖ и сыворотки крови у больных БГМ. Что касается γ-глобулинов,
то они имеют как плазматическое, так и мозговое происхождение [27, 28].
Повышение γ-глобулинов в СМЖ связано с нарастающими процессами местного
саногенеза (IgA и IgM). Изменения в протеинограмме не являются строго
специфическими, и их используют для диагностики, дифференциальной диагностики и
прогноза заболевания обязательно вместе с другими рутинными и специфическими
показателями. Существенное место в ликворологических исследованиях занимают
иммунологические методы [29, 30]. Иммунная система ЦНС функционирует автономно и
является фактором саногенеза при БГМ, между показателями иммунитета в крови и
СМЖ отсутствует достоверная корреляция (р > 0,05) по всем параметрам. Нами
установлено, что между показателями клеточного и гуморального иммунитета в крови
и СМЖ имеются существенные различия. В СМЖ происходила значительная большая и
качественно отличная от крови активация показателей иммунитета. Так, ИРИ в СМЖ
составил 3,0 ± 0,4, в крови 1,9 ± 0,3 (р < 0,05), что было связано с ростом СД4+
до 62,7 ± 5,4% (в крови 45,1 ± 4,8%, р < 0,05). Это указывает на высокую
фагоцитарную активность лейкоцитов СМЖ. Следует также отметить, что у двух
больных с ИРИ в СМЖ меньше единицы наблюдалась поздняя санация ликвора (19 и 27
для лечения). Длительный плеоцитоз при клиническом выздоровлении обусловлен
местной иммуноклеточной реакцией с накоплением Т-хелперов и повышением ИРИ до
4,5–5,0. Цитотоксическая активность в СМЖ осуществлялась преимущественно за счет
СД8+, а в крови — NKT. Одновременно активируется и В-клеточная
система и в СМЖ происходит накопление Ig различных классов. Несмотря на то, что
содержание Ig в СМЖ было во много раз ниже, чем в крови, их концентрация в
пересчете на 1 г белка была существенно выше, что позволяет утверждать о
продукции Ig непосредственно в субарахноидальном пространстве. Уровень Ig в г%
белка также существенно различался. Содержание IgА на грамм белка в СМЖ
составляло 0,150 г%, в крови — 0,043 г% (р < 0,001), т. е. в 3,5 раза выше, IgМ
соответственно 0,239 г% и 0,030 г/м (р < 0,001), т. е. в 7,6 раза выше. Сложной,
особенно в тяжелых случаях, является оценка эффективности антибактериальной
терапии в ранние сроки, особенно у больных с тяжелым течением БГМ, что часто
приводит к необоснованной замене антибактериального препарата. Так, например,
при Hib-менингите замена произведена у 68%, а обоснована только у 28%.
Клинически оценить эффективность лечения можно не всегда, т. к. при
неэффективной этиотропной терапии ошибки допускаются, когда временный
терапевтический эффект достигается за счет дезинтоксикационной и
дегидратационной терапии. При эффективной антибактериальной терапии отсутствие
положительной динамики или отрицательная динамика в состоянии больного могут
быть обусловлены прогрессированием воспалительного процесса в результате
бактериолизиса под воздействием бактерицидных препаратов, внутричерепными
осложнениями (прогрессирование отека-набухания головного мозга, субдуральная и
субарахноидальная гематома, блокада ликворопроводящих путей), внечерепными
осложнениями (пневмония и др.), активизацией герпетической инфекции, что
подтверждается выявлением методом ПЦР репликации герпесвирусов 1-го, 2-го, 5-го,
6-го типов, лихорадочными реакциями на введение антимикробных препаратов. Наши
исследования показали, что эффективность этиотропной терапии при осложненном
течении болезни возможно оценить только на основании ликворологических
исследований. Они позволяют оценить эффективность этиотропной терапии в течение
3 суток у 91% больных менингококковым, у 82% — пневмококковым, у 88% гемофильным
и у 89% менингитом неустановленной этиологии. Установлено, что иногда при
неэффективной антибактериальной терапии критерии рутинного обследования не
всегда информативны, так, наблюдается снижение плеоцитоза СМЖ в 1,5–2,0 раза, %
нейтрофилов снижается. Поэтому главным критерием оценки эффективности проводимой
антибактериальной терапии являются дополнительные ликворологические показатели:
снижение уровня белка в 2 раза, повышение на 1 ммоль/л и более концентрации
глюкозы, снижение уровня лактата и D-ДФ в 1,5–2,0 раза в течение 2–3 дней,
повышение рН на 0,2 и рО2 в 1,5 раза, снижение рСО2,
снижение фракций ЛДГ4 и 5, снижение α-1- и α-2-глобулинов (табл. 5).

Отсутствие положительной динамики или ухудшение этих показателей
прогностически неблагоприятно. Несмотря на имеющиеся критерии отмены
антибиотиков, в частности снижение цитоза до 100 клеток в 1 мкл, у 5–10% больных
в течение 1,0–1,5 месяцев в СМЖ сохраняется лимфоцитарный плеоцитоз до 200–300 в
1 мкл при хорошем общем состоянии. Нами установлено, что плеоцитоз в этих
случаях обусловлен местной иммуноклеточной реакцией с накоплением Т-хелперов и
повышением ИРИ до 4,5–5,0. Одновременно активируется и В-клеточная система и в
СМЖ происходит накопление Ig различных классов. Таким образом, совокупность этих
данных в большинстве случаев позволяет в течение 2–3 суток реально оценить
эффективность лечения и принять обоснованное решение о продолжительности лечения
тем же препаратом или о его замене. Оценка эффективности антибактериальной
терапии объективно возможна не ранее чем через 2–3 суток лечения, а при
пневмококковом менингите — через 3–5 суток.
Заключение
Исследование СМЖ позволяет получить огромный объем информации о характере
патологического процесса в оболочках и веществе мозга и при БГМ является
основным методом диагностики, дифференциальной диагностики и оценки
эффективности антибактериальной терапии и прогноза заболевания. Для повышения
диагностической ценности исследования СМЖ целесообразно проводить определение
уровня лактата, D-ДФ, рН как в остром периоде болезни, так и в процессе лечения.
Литература
-
Лобзин Ю. В., Пилипенко В. В., Громыко Ю. Н. Менингиты и
энцефалиты. СПб: Фолиант, 2006. 124 с. -
Королева М. А., Покровский В. И., Миронов К. О. и др.
Эпидемиологический мониторинг за гнойными бактериальными менингитами в
историческом и современном аспекте // Эпидемиология и инфекционные болезни.
Актуальные вопросы. 2014. № 2. С. 52–56. -
Венгеров Ю. Я., Нагибина М. В. Практические аспекты диагностики и
лечения бактериальных гнойных менингитов // Неотложная медицина. 2011. № 3. С.
23–28. -
Сорокина М. Н., Иванова В. В., Скрипченко Н. В. Бактериальные
менингиты у детей. М.: Медицина, 2003. 320 с. -
Bottomley M. J., Serruto D., Safadi M. A. P., Klugman K. P.
Future challenges in the elimination of bacterial meningitis // Vaccine. 2012;
30 (Suppl. 2): B78–В86. -
Schuchat A., Robinson K., Wenger J. D. et al. Bacterial
meningitis in United States in 1995 // Active Surveillance Team. N. Engl. J.
Med. 1997; 337 (14): 970–976. -
Богомолов Б. П. Диагностика вторичных и первичных менингитов //
Эпидемиология и инфекционные болезни. 2007. № 6. С. 44–49. -
Thigpen V. C., Whitney C. G., Messonnier N. E. et al. Bacterial
meningitis in the United States, 1998–2007 // N. Engl. J. Med. 2011; 36 (21):
2016–2025. -
Венгеров Ю. Я., Нагибина М. В. Диагностическое значение ПЦР при
нейроинфекциях / Материалы VIII научно-практической конференции «Инфекционные
болезни и антимикробные средства». М., 2010. С. 125–130. -
Тютюнник Е. Н. Использование ПЦР для диагностики и
прогнозирования течения менингитов. Автореф. к.м.н. М., 2001. -
Венгеров Ю. Я., Нагибина М. В. и др. Клиническое значение
лактат-ацидоза при гнойных менингитах // Тер. архив. 2008. № 80. С. 33–35. -
Молотилова Т. Н. Сравнительная оценка биохимических характеристик
СМЖ и крови больных менингитами различной этиологии. Автореф. к.м.н. М., 2012. -
Папаян Л. П., Князева Е. С. D-димер в клинической практике. М.,
2002. -
Гильманов А. Ж. D-димер. Что? Как? У кого? С какой целью? //
Клинико-лабораторный консилиум. 2009. № 6. -
Adam S. S., Key N. S., Greenberg C. S. D-dimer antigen: current
concepts and future prospects. // Blood. 2009. Vol. 113. № 13. P. 2878–2887. - Рослый И. М., Шуляк Ю. А. Практическая биохимия. М., 2004. 167 с.
-
Миноранская Н. С., Миноранская Е. И. Значение воспалительных
маркеров для дифференциальной диагностики различных форм острых иксодовых
клещевых боррелиозов // Современные проблемы науки и образования. 2014. № 1. -
Watson M. A., Scott M. G. Clinical utility of biochemical
analisis of cerebrospinal fluid // Clin. Chem. 1995. Т. 41. Р. 343–360. -
Paz J. M. et al. Evaluation of determination of lactate
dehydrogenase isoenzyme I by chemica inhibition with perchiorate or with
1,6-hexanediol // Clin. Chem. 1990. Vol. 36. P. 355–358. -
Берестовская В. С. Методы определения активности
лактатдегидрогеназы // Terra medica nova. Журн. для врачей всех
специальностей. 2008. № 1. 17 с. -
Марданлы С. Г., Первушин Ю. В., Иванова В. Н. Спинномозговая
жидкость, лабораторные методы исследования и их клинико-диагностическое
значение: учебное пособие для специалистов по клинической лабораторной
диагностике Электрогорск. ЗАО «ЭКОлаб», 2011. 72 c. -
Черняева Т. Е. Кислотно-основное состояние, газовый состав крови
и ликвора у больных менингококковой инфекцией. Автореф. к.м.н. М., 1973. 17 с. -
Ткачук В. А. Клиническая биохимия. М.: Издательство ГЭОТАР-Медиа,
2004. 515 с. -
Фридман А. П. Основы ликворологии (учение о жидкости мозга). Изд.
«Медицина», 1971. 647 с. -
Seehusen D. A., Reeves M. M., Fomin D. A. Cerebrospinal fluid
analysis // Am Fam Physician. 2003. Vol. 68. P. 1103–1108. -
Гусейнов Т. Ю. Углеводный обмен мозга в условиях гипоксии //
Анестезиология и реаниматология. 1991. № 3. С. 14–17. -
Пикалюк В. С., Бессанова Е. Ю., Ткач В. В. Ликвор как гуморальная
среда организма. Симферополь: ИТ «Ариал», 2010. 192 с. -
Бабич Г. Н. Маркеры повреждения гематоэнцефалического барьера при
нейроинфекциях // Нейроиммунология. 2003. Т. 103. № 1. С. 51–56. -
Балмасова И. П., Венгеров Ю. Я., Раздобарина С. Е., Нагибина М. В.
Иммунопатогенетические особенности бактериальных гнойных менингитов //
Инфекционные болезни и эпидемиология. 2015. № 3. С. 15–18. -
Мазанкова Л. Н., Наср М. А., Гусева Г. Д. и др. Особенности
продукции цитокинов при менингококковой инфекции у детей // Детские инфекции.
2010. Т. 9. № 1. С. 17.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru