Комплексная клинико-функциональная оценка тонкой кишки при метаболическом синдроме
Я.М. Вахрушев, М.В. Ляпина
ГБОУ ВПО «Ижевская государственная медицинская академия», кафедра пропедевтики внутренних болезней, г. Ижевск.
Резюме
Цель исследования: комплексное изучение функционального состояния тонкой кишки (ТК) при метаболическом синдроме (МС).
Материалы и методы. Обследовано 120 больных с МС. В подтверждении МС использованы критерии диагностики, предложенные Всероссийским научным обществом кардиологов в 2009 году. При обследовании ТК, помимо клинических данных, использованы результаты исследования моторной, пищеварительной и всасывательной функций. Изучены особенности изменений гормонального, вегетативного статуса и липидного обмена у больных с МС.
Результаты. У большинства (82,9 %) больных МС отмечены клинические местные и общие признаки поражения ТК. При изучении функционального состояния ТК отмечены нарушения на всех этапах гидролизно-резорбционного конвейера на фоне гипомоторной дискинезии в постпрандиальном периоде и гиперсимпатикотонии у больных с МС. Выявлены патогенетические закономерности, касающиеся роли гормонов в нарушении пищеварительной, всасывательной и двигательной функций кишечника при МС.
Заключение. Результаты наших исследований позволяют полагать, что изменения функционального состояния ТК, выявленные при МС, являются важным звеном сложного патогенетического круга метаболического синдрома.
Ключевые слова: метаболический синдром; функциональное состояние тонкой кишки; гормоны; вегетативный статус.
ДГР — дуодено-гастральный рефлюкс, ДПК — двенадцатиперстная кишка, ЖКТ — желудочно-кишечный тракт, ИМТ — индекс массы тела, КА — коэффициент атерогенности, ЛПВП — липопротеины высокой плотности, МС — метаболический синдром, ОТ — окружность талии, ПЭГЭГ — периферическая электрогастроэнтерография, Тг — триглицериды, ТК — тонкая кишка, ТТГ — тиреотропный гормон, Хс — общий холестерин
Метаболический синдром (МС) представляет собой комплекс глубоких обменных нарушений, сопровождающихся абдоминальным ожирением, артериальной гипертензией, дислипидемией, сахарным диабетом 2-го типа или нарушением толерантности к глюкозе и сопряжённой с ними инсулинорезистентностью [3, 12, 22, 24, 26, 27, 28]. Основные составляющие каскада нарушений при МС тесно связаны с функциональным состоянием пищеварительной системы. Органы пищеварения могут играть триггерную роль в патогенезе основных кластеров МС, нередко и сами они становятся органами-мишенями и конечными этапами проявлений дислипидемии [4, 5, 11]. Пищеварительный тракт можно рассматривать как главную «репетиционную сцену» МС, где уже на ранних стадиях формируются основные патогенетические механизмы данного синдрома [2].
В последнее время большой интерес вызывает изучение роли тонкой кишки (ТК) в развитии МС, являющейся одним из центральных органов в регуляции обмена веществ [6, 7, 15]. Тем не менее, у пациентов с МС функциональное состояние ТК изучено недостаточно. Это связано с трудоёмкостью и инвазивностью методик исследования ТК.
Задачами нашей работы являлись, во-первых, характеристика клинического течения энтерального поражения при МС, во-вторых, комплексное исследование функционального состояния ТК, в-третьих, изучение роли нейро-гормональных факторов в нарушении функций ТК, и, наконец, выяснение сопряжённости нарушений функций ТК и липидного обмена.
Материалы и методы
Обследовано 120 больных с МС, который подтверждался с помощью критериев диагностики, предложенных Всероссийским научным обществом кардиологов в 2009 г [10]. Больные были в возрасте от 32 до 75 лет. Женщин было 66 (55,0 %), мужчин — 54 (45,0 %). Средний возраст у мужчин составил 49,45±1,55 лет, у женщин — 58,61±1,8 лет. В результате комплексных исследований нами выявлены патологические изменения пищевода у 57 % больных с МС, заболевания печени и билиарного тракта — у 41 %, патологические изменения со стороны желудка и двенадцатиперстной кишки — у 63 %, заболевания поджелудочной железы — у 89 %.
Основные методы обследования для выявления ожирения включали антропометрию — измерение веса, роста, окружности талии (ОТ), расчет индекса массы тела ( ИМТ). ИМТ (индекс Кетле) определяли по формуле: ИМТ = вес (кг)/рост (м)2. Состояние вегетативного тонуса у больных с МС оценивали по индексу Кердо, который рассчитывали по формуле: (1 — диастолическое артериальное давление/ пульс) × 100. Величину индекса Кердо оценивали по номограмме, значения выше +5 расценивали как преобладание симпатического тонуса, ниже — 5 — преобладание парасимпатического тонуса [28].
Состояние углеводного обмена оценивали с помощью перорального глюкозотолерантного теста путем исследования содержания глюкозы в капиллярной крови натощак и через 1 и 2 часа после перорального приема 75 г глюкозы, растворённой в 200 мл воды.
Оценка липидного обмена проводилась по содержанию в плазме крови общего холестерина (Хс), Хc липопротеинов высокой плотности (ЛПВП), триглицеридов (Тг ). У р о в е н ь Хс, ХсЛПВП, Тг определяли на анализаторе F P — 9 0 1 ( M ) фирмы « L a b s y s t e m s » ( F i n l a n d ) , полученные результаты выражали в ммоль/л. В соответствии с полученными данными определяли коэффициент атерогенности (КА) по формуле
КА = (Хс-ХсЛПВП)/ХсЛПВП,
при этом КА от 3 до 4 соответствовал умеренному риску, КА ≥ 4 — высокому риску развития сердечно-сосудистых осложнений.
Изучение базального уровня гормонов в периферической крови (инсулина, кортизола, гастрина, тиреотропного гормона — ТТГ, свободного тироксина — Т4) проводилось методом электрохемилюминесцентного иммуноанализа с помощью анализатора IMMULITE фирмы «Siemens». Исходя из концентрации иммунореактивного инсулина и глюкозы, рассчитывался индекс инсулинорезистентности HOMA–IR по формуле:
HOMA–IR = инсулин натощак (мкМЕ/мл) × глюкоза натощак (ммоль/л) : 22,5
Для изолированного исследования резорбтивных процессов использованы вещества, не подвергающиеся ферментативной обработке в кишке: глюкоза, D-ксилоза. Концентрацию глюкозы в крови натощак и прирост её в течение двух часов после нагрузки углеводами определяли глюкооксидантным энзиматическим методом. Содержание D-ксилозы в моче определяли методом, предложенным Roe и Rice, после приёма её внутрь в количестве 5 г в пятичасовой порции мочи. Состояние пристеночного пищеварения оценивалось по результатам усвоения в тонкой кишке дисахарида сахарозы. Для характеристики полостного пищеварения в тонкой кишке использована проба с растворимым крахмалом. У всех обследованных проводили изучение копрограммы и определение эластазы-1 в кале.
В изучении моторно-эвакуаторной функции ТК применялась периферическая электрогастроэнтерография (ПЭГЭГ) с использованием приборов ЭГГ-4М, модифицированного нами частотным фильтром для измерения биопотенциалов ТК, и «Гастроскан-ГЭМ» (НПП «Исток-Система» г. Фрязино). Исследование проводили в два этапа: 1 этап — утром натощак — 40 минут; 2 этап — после стандартного завтрака (200 мл тёплого чая, 4 г сахара, 100г белого хлеба) — 40 минут. Проведение 2-х этапов исследования позволяет оценивать функциональную и органическую патологию ЖКТ, особенно его верхних отделов — желудка, двенадцатиперстной кишки (ДПК) и тощей кишки [19, 20]. При этом учитывали числовые значения, характеризующие энергию (суммарную (Pi) и по частотным спектрам (Ps)), процентное отношение вклада каждого отдела ЖКТ в суммарную мощность (Pi/Ps)), ритмичность сокращений каждого отдела ЖКТ (Kritm), а также коэффициент соотношения (Pi/P(i+1)), представляющий собой отношение электрической активности вышележащего отдела к нижележащему (последний характеризует эвакуаторную функцию). На основе анализа ритма, частоты сокращений и амплитуды зубцов определялся тип двигательной активности ТК.
Результаты специальных лабораторно-инструментальных исследований сравнивали с показателями контрольной группы, которую составили 45 практически здоровых лиц.
Результаты исследования представлены в международных единицах СИ и подвергнуты статистической обработке, которая включала традиционные методики вычисления относительных (Р) и средних величин (М) с определением их ошибки (±m). Оценка достоверности различий показателей и средних величин осуществлялась с использованием параметрических (критерий Стьюдента (t), достоверными считались различия при p<0,05) критериев. Для определения наличия связи между признаками использовался коэффициент парной корреляции Пирсона (r).
Результаты и обсуждение
Обязательный критерий МС — центральный тип ожирения (ОТ более 94 см у мужчин, более 80 см у женщин), наблюдался у всех (100 %) исследуемых больных. При этом избыточную массу тела (ИМТ = 25 — 29,9 кг/м2) имели 23 пациента (18,9 %), ожирение I степени (ИМТ = 30 — 34,9 кг/м2) — 63 (52,8 %), ожирение II степени (ИМТ = 35 — 39,9 кг/м2) — 23 (18,9 %), ожирение III степени (ИМТ 40 кг/м2 и более) — 11(9,4 %).
Нарушения углеводного обмена носили различный характер: нарушенная гликемия натощак была выявлена у 21 больного (17,5 %), у остальных больных (82,5 %) наблюдалось нарушение толерантности к глюкозе. Повышение показателя индекса НОМА выявлено у всех больных, включенных в исследование. Средний уровень индекса НОМА соответствовал 4,22+0,8 и был выше среднего показателя контрольной группы — 2,05±0,00, p<0,05. При этом превышение этого показателя более чем в 2 раза отмечалось у 50 % пациентов, что свидетельствует о наличии выраженной инсулинорезистентности.
Основными клиническими симптомами поражения кишечника при МС были вздутие живота (82,9 %), чувство тяжести в животе после еды (43 %) и нарушение стула (63 %) в виде запора (29 %), полифекалии (47 %), диареи (32 %), чередования запоров и поносов (18 %). В 66,5 % случаев отмечен болевой синдром в околопупочной области, характерный для поражения тонкой кишки.
При физикальном обследовании выявлены симптомы полигиповитаминоза и качественных расстройств трофики, как проявления общего энтерального поражения (ломкость ногтей, выпадение волос, сухость кожи, фолликулярный кератоз, ангулярный стоматит, кровоточивость дёсен, глоссит) у 48 % больных. Обложенность языка желтовато-белым налётом выявлена в 96,7 % случаев, болезненность в точке Поргеса и околопупочной области — в 62 %, болезненность при пальпации отделов толстой кишки — в 35,0 % случаев.
У больных с МС наблюдается нарушение мембранного и полостного этапов пищеварения. Так, при проведении нагрузочной пробы с сахарозой прирост уровня глюкозы в течение 30 минут в сравнении с контролем (2,5±0,14 ммоль/л) существенно не отличался (2,6±0,22 ммоль/л, р > 0,05), а через 60 минут был достоверно ниже (1,36±0,26 ммоль/л и 2,7±0,38 ммоль/л, соответственно, р < 0,05). Изменение усвоения сахарозы может быть связано не только с подавлением собственно кишечного пищеварения, но и с нарушением адсорбции ферментов (главным образом панкреатических), принимающих участие в мембранном пищеварении. Деятельность этих двух систем тесно связана [16, 21].
Несмотря на более высокий уровень гликемии натощак, прирост после приёма крахмала, в сравнении с контролем, у больных был достоверно ниже как через 30 минут (0,4±0,02 ммоль/л и 1,54±0,31 ммоль/л, соответственно, р < 0,01), так и через 60 минут (0,36±0,06 ммоль/л и 1,65±0,41 ммоль/л, соответственно, р < 0,01), что указывает на нарушение полостного пищеварения в ТК при МС. У больных с МС в среднем содержание эластазы-1 в кале составило 196,1±12,28 мкг/г, что было существенно ниже в сравнении с контролем — 500,33±28,51 мкг/г (p<0,01). Содержание нейтрального жира в кале выявлено у 40 % пациентов, синдром креатореи, характеризующийся преимущественно наличием мышечных волокон без исчерченности — у 76 %, амилорея выявлена у 55 % пациентов.
При исследовании резорбционной функции ТК с помощью нагрузочной пробы с глюкозой в течение 30 минут прирост гликемии был сопоставим с контрольной группой (2,68±0,12 ммоль/л и 2,71±0,21 ммоль/л, р > 0,05), а через 60 мин был более выраженным, чем в группе здоровых лиц (3,09±0,15 ммоль/л и 2,87±0,44 ммоль/л, р > 0,05). Однонаправленные изменения всасывательной функции тонкой кишки установлены при использовании теста с D-ксилозой. У больных с МС отмечено повышение резорбции D-ксилозы в ТК в сравнении с контрольной группой — 2,05±0,05 г/л и 1,82±0,08 г/л соответственно, р < 0,05.
В изменении этапов пищеварительного процесса в тонкой кишке у больных при патологии желудочно-кишечного тракта участвуют механизмы компенсации и перераспределения нарушенных функций [14, 17]. С этим согласуются результаты наших корреляционных исследований, когда между приростом гликемии после нагрузки сахарозой и концентрацией D-ксилозы в моче наблюдается средней силы обратная связь (r = -0,47; p<0,05), то есть при угнетении пристеночного пищеварения активность резорбционной функции возрастает. Между приростом гликемии после нагрузки крахмалом и показателями экскреции D-ксилозы также отмечена умеренная обратная связь (r = -0,53; p<0,05).
При проведении электроэнтерографии с помощью ЭГГ-4М натощак у 42 % больных с МС наблюдался нормотонический и нормокинетический тип сокращений ТК, у 33 % — гиперкинетическая дискинезия, у 25 % — гипокинетическая дискинезия ТК (табл. 1).
Таблица 1. Показатели двигательной функции тонкой кишки у больных с метаболическим синдромом
|
Показатели |
Исследование натощак (n = 48) | Исследование через 1 час после пищевой нагрузки (n = 48) | ||||
| Нормо- моторика (n = 20) |
Гипо- моторика (n = 12) |
Гипер- моторика (n = 16) |
Нормо- моторика (n = 9) |
Гипо- моторика (n = 34) |
Гипер- моторика (n = 5) |
|
| Частота, цикл/мин (больные с МС) | 6,3±0,43 | 3,14±0,12* | 9,38±0,69* | 9,4±1,05 | 5,04±0,74* | 14,2±0,81* |
| Частота, цикл/мин (контрольная группа) | 6,02±0,24 | 8,9±0,68 | ||||
| Амплитуда, мВ (больные с МС) | 0,08±0,012 | 0,03±0,001* | 0,39±0,07* | 0,24±0,03 | 0,05±0,003* | 0,48±0,02* |
| Амплитуда, мВ (контрольная группа) | 0,09±0,002 | 0,21±0,003 | ||||
Примечание: * — достоверные изменения по отношению к контролю (р<0,05), n — число наблюдений.
Через 1 час после стандартного завтрака у большинства больных (81 %) имело место нарушение моторной функции ТК. При этом значительно преобладала гипотоническая дискинезия ТК на фоне снижения частоты сокращений в минуту (у 71,5 % больных). У 9,5 % исследуемых наблюдалась гипертоническая тахикинезия. Лишь в 19 % случаев биоэлектрическая активность ТК была сопоставима с данными контрольной группы.
По результатам гастроэнтеромониторинга на ГЭМ-01 «Гастроскан-ГЭМ» у большинства больных с МС (70 %) электрическая активность ДПК, тощей и подвздошной кишок натощак повышена по сравнению с контрольной группой. В пищевую фазу электрическая активность тощей и подвздошной кишок сопоставима с контролем. Электрическая активность ДПК в постпрандиальном периоде у 70 % больных низкая, что свидетельствует о недостаточном ответе ДПК на пищевую стимуляцию при МС (рис. 1).
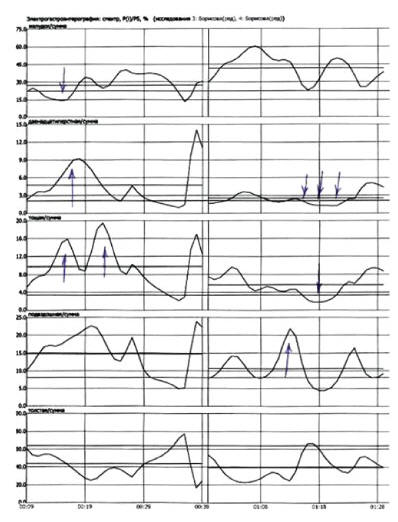
Рис. 1. Электрогастроэнтерография: спектр, Pi/Ps, %. Тощаковая фаза (слева) — электрическая активность желудка снижена, электрическая активность ДПК и тощей кишки повышена, пищевая фаза (справа) — электрическая активность желудка повышается, электрическая активность ДПК и тощей кишки снижена
Дискоординация моторики между желудком и ДПК усугубляется в постпрандиальном периоде, при этом у 40 % больных появляется дуодено-гастральный рефлюкс (ДГР), который не наблюдался в тощаковую фазу исследования. Несмотря на то, что коэффициент соотношения ДПК/тощая кишка натощак у большинства больных (70 %) не изменён, в пищевую фазу у 60 % имеет низкие значения, что свидетельствует о снижении эвакуации из ДПК в тощую в постпрандиальном периоде. Между подвздошной и толстой кишками наблюдается дискоординация моторики, усугубляющаяся после пищевой стимуляции (рис. 2).
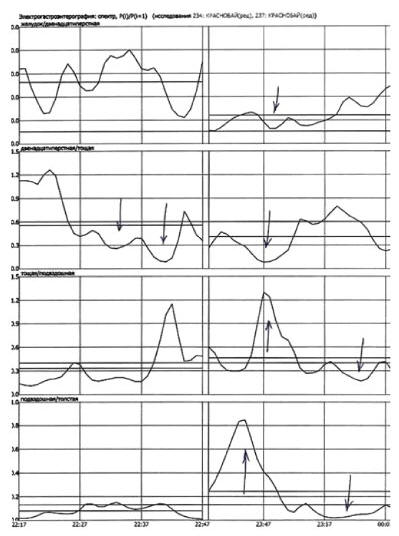
Рис. 2. Электрогастроэнтерография: спектр, Pi/P(i+1). Тощаковая фаза (слева) — коэффициент соотношения ДПК/тощая кишка снижен, пищевая фаза (справа) — коэффициенты соотношения желудок/ ДПК, ДПК/тощая кишка снижены, дискоординация моторики подвздошной и толстой кишок
Коэффициент ритмичности ДПК у 40 % больных снижен в обе фазы исследования, у 50 % — не изменён и лишь в 10 % случаев повышен. Значительное снижение ритмичности сокращений наблюдается на частотах тощей, подвздошной и толстой кишок как натощак, так и в постпрандиальном периоде, что указывает на ослабление пропульсивных сокращений кишечника у больных с МС.
Функционирование пищеварительной системы, включающее сопряжение моторики, секреции и всасывания регулируются сложной системой нервных и гормональных механизмов [8]. Однако исследований зависимости гидролизно-резобционной и моторно-эвакуаторной функций кишечника от гормонов в крови у больных с МС мы не встретили.
У больных с МС нами отмечено повышение базального уровня гастрина, инсулина, кортизола и ТТГ, снижение уровня свободного Т4 в крови (табл. 2).
Таблица 2. Данные исследования базального уровня гормонов у больных с МС
| Обследуемые группы | Гастрин (пг/мл) |
Кортизол (нмоль/л) |
Инсулин (мкМЕ/л) |
ТТГ (мкМЕ/л) |
Т4(св) (пмоль/л) |
| Больные с МС | 180,9±23,0** n=25 |
547,9±49,6 ** n=25 |
15,4±1,86 * n=25 |
3,01±0,14* n=29 |
16,1± ,21* n=29 |
| Контрольная группа | 66,14±2,44 n=20 |
419,4±12,81 n=20 |
10,46±0,66 n=20 |
2,09 ±0,08 n=20 |
18,9 ±0,27 n=20 |
Примечание: n — число наблюдений; * — достоверность по отношению к группе контроля, p<0,05; ** — достоверность по отношению к группе контроля, p<0,01.
Для выяснения роли гормональных факторов в нарушениях гидролиза и резорбции в ТК у больных с МС, проведены корреляционные исследования между гормонами и показателями функционального состояния ТК. Так, выявлена обратная связь между полостным пищеварением и уровнями кортизола и инсулина, то есть на фоне повышения уровня кортизола и инсулина наблюдается угнетение процессов полостного пищеварения в кишечнике. Выявлена прямая связь между мембранным пищеварением и уровнем инсулина крови, то есть отмечено однонаправленное повышение мембранного пищеварения и уровня инсулина. Связь между резорбцией глюкозы и D-ксилозы и уровнем кортизола отсутствовала. Между уровнем инсулина и показателями всасывания глюкозы и D-ксилозы выявлена умеренная прямая зависимость (табл. 3).
Таблица 3. Показатели корреляции между уровнями гормонов и некоторыми показателями функционального состояния тонкой кишки
|
Функциональные пробы |
Гастрин | Инсулин | Кортизол | ТТГ | Т4 |
| Прирост гликемии после нагрузки глюкозой | — 0,74 p<0,01 |
+ 0,58 p<0,05 |
— 0,18 p>0,05 |
— 0,64 p<0,01 |
+ 0,25 p>0,05 |
| Прирост гликемии после нагрузки сахарозой | + 0,13 p>0,05 |
+ 0,49 p<0,05 |
+ 0,49 p<0,05 |
— 0,21 p>0,05 |
+ 0,61 p>0,01 |
| Прирост гликемии после нагрузки крахмалом | — 0,39 p<0,05 |
— 0,26 p>0,05 |
— 0,38 p<0,05 |
+ 0,05 p>0,05 |
+ 0,42 p<0,05 |
Примечание: р — достоверность показателя.
Проведённый корреляционный анализ показал умеренную отрицательную связь между уровнем гастрина и электрической активностью (Pi/Ps) желудка и ДПК, между уровнем гастрина и коэффициентом соотношения (Pi/P(i+1)) желудка к ДПК, в итоге приводящие к замедлению эвакуации химуса из желудка и ДПК и возникновению ДГР (табл. 4).
Таблица 4. Показатели корреляции между уровнями гормонов и некоторыми показателями МЭФ желудка и двенадцатиперстной кишки у больных с МС
| Гормоны | Электрическая активность (Pi/Ps) желудка |
Электрическая активность (Pi/Ps) ДПК |
Коэффициент соотношения (Pi/P(i+1)) желудок/ДПК |
Коэффициент соотношения (Pi/P(i+1)) ДПК/тощая кишка |
| Гастрин | — 0,44 р<0,05 |
— 0,13 р>0,05 |
— 0,42 р<0,05 |
— 0,57 р<0,05 |
| Инсулин | + 0,22 р>0,05 |
— 0,06 р>0,05 |
— 0,04 р>0,05 |
— 0,36 р<0,05 |
| Кортизол | — 0,42 р<0,05 |
— 0,33 р<0,05 |
— 0,14 р>0,05 |
— 0,44 р<0,05 |
| ТТГ | — 0,12 р>0,05 |
— 0,13 р>0,05 |
— 0,05 р>0,05 |
— 0,17 р>0,05 |
| Т4 | + 0,32 р<0,05 |
+ 0,04 р>0,05 |
+ 0,01 р>0,05 |
+ 0,16 р>0,05 |
Примечание: р — достоверность показателя.
При повышении уровня кортизола наблюдается снижение скорости эвакуации из ДПК и уменьшение электрической активности ТК. Полученные нами данные согласуются с ранее проведёнными исследованиями [9, 18], показавшими, что избыток эндогенных кортикостероидов в организме оказывает расслабляющее действие на гладкую мускулатуру органов, вызывая снижение их моторики, амплитуды сокращений, снижение давления в области сфинктеров. Зависимость нарушений моторной функции ЖКТ от уровней инсулина, ТТГ и Т4 была незначительной. Кроме того, в нарушении моторики ТК нельзя исключить и роль активизации симпатической нервной системы [13, 23], являющейся признаком МС [1, 3, 22]. Проведённый нами анализ индекса Кердо показал, что у 86 % больных с МС наблюдается преобладание симпатического тонуса.
Снижение скорости эвакуации пищевого химуса по ТК у больных с МС способствует нарушению соотношения питательных веществ в составе потока, тем самым изменяя темп их переноса из энтеральной во внутреннюю среду, усугубляя метаболические нарушения, в том числе обмен липидов. Так , уровень общего Хс у больных был выше (6,08±0,16 ммоль/л, р<0,05), чем в группе контроля (4,99±0,32 ммоль/л и 2,28±0,17 ммоль/л, соответственно).
Наряду с этим наблюдалась гипертриглицеридемия (2,83±0,34 ммоль/л, р<0,05) в сравнении с контролем (1,48±0,29 ммоль/л) и снижение содержания ХсΛПВП — 0,86±0,14 ммоль/л (в контрольной группе — 1,4±0,11 ммоль/л, р<0,05). У большинства больных с МС (97 %) было выявлено повышение уровня коэффициента атерогенности (КА) — 5,21±0,28, при этом средний риск (КА от 3 до 4) наблюдался у 27,6 %, высокий риск (КА > 4) — у 69,4 % больных. При корреляционном анализе выявлена умеренная отрицательная зависимость между показателями резорбции D-ксилозы (r=-0,68), глюкозы (r=-0,42) в ТК и частотой её сокращений, умеренная отрицательная связь между уровнем коэффициента атерогенности и частотой и амплитудой сокращений ТК (r = -0,53, r = -0,48, соответственно).
Заключение
У всех больных с МС выявлены клинические симптомы энтерального поражения, которые находятся в тесной зависимости от характера нарушений пищеварительной, всасывательной и двигательной функций тонкой кишки. Комплексное исследование пищеварительной и всасывательной функции тонкой кишки позволило уточнить характер нарушений мальдигестии и мальабсорбции при метаболическом синдроме.
На фоне угнетения полостного и пристеночного пищеварения обнаружено повышение резорбции глюкозы и D-ксилозы, сопряжённое со снижением электрической активности и замедлением эвакуации по тонкой кишке в постпрандиальном периоде. При гипомоторной дискинезии тонкой кишки в постпрандиальном периоде создаются условия для более длительной экспозиции питательных веществ в энтеральной среде. Это, в свою очередь, способствует повышению уровня липидемии и гликемии (преимущественно за счёт моносахаридов), что на фоне инсулинорезистентности усугубляет формирование абдоминального ожирения у больных с метаболическим синдромом.
Исследование показателей моторно-эвакуаторной функции и гидролизно-резорбционного конвейера ТК с одной стороны и уровней гормонов и нейро-вегетативного статуса с другой позволило выявить новые патогенетические закономерности, касающиеся роли последних в нарушении функций кишечника у больных с МС. Результаты наших исследований позволяют утверждать, что поражение тонкой кишки, выявленное при МС, является важным звеном в сложном патогенетическом круге метаболического синдрома. Можно полагать, что с позиции коррекции функционального состояния ТК будут разработаны более эффективные способы лечения МС.
Список литературы
- Алимова И.Л. Метаболический синдром у детей и подростков. М.:ГЭОТАР- Медиа; 2008.
- Буторова Л.И. Дислипидемия и патология органов пищеварения. Медицинский Вестник. 2012; 9 (586): 6-10.
- Бутрова С.А. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению. РМЖ. 2001; 2: 56-60.
- Вахрушев Я.М., Волкова А.А. Дифференцированные подходы к лечению больных хроническим панкреатитом с сопутствующим метаболическим синдромом. Эксп. и клин. гастроэнтерология. 2011; 11: 33-36.
- Вахрушев Я.М., Волкова А.А. Специфическое динамическое действие пищи у больных хроническим панкреатитом с сопутствующим метаболическим синдромом. Тер. архив. 2012; 2: 49-52.
- Вахрушев Я.М., Ляпина М.В. Клинико-функциональная характеристика тонкой кишки при метаболическом синдроме. Эксп. и клин. гастроэнтерология. 2011; 9: 26-29.
- Вахрушев Я.М., Ляпина М.В. Изучение роли тонкой кишки в развитии метаболического синдрома. Тер. архив. 2012; 12: 62-65.
- Вахрушев Я.М., Крючкова В.И. Очерки по нейрогуморальной регуляции дыхательной и пищеварительной систем. Ижевск; 1993.
- Герман С.В., Степенко А.С., Гурвич Р.Н. Гиперкортицизм и моторика пищевода. Рос. журн. Гастроэнтерол., гепатол., колопроктол. 1996; 4: 2.
- Диагностика и лечение метаболического синдрома. Российские рекомендации (второй пересмотр). Разработаны Комитетом экспертов Всероссийского научного общества кардиологов и Российского медицинского общества по артериальной гипертонии. Москва 2009.
- Егорова Е.Г., Звенигородская Л.А., Лазебник Л.Б. Метаболический синдром с позиции гастроэнтеролога. РМЖ. 2005; 26: 1706-1712.
- Лазебник Л.Б., Звенигородская Л.А. Метаболический синдром и органы пищеварения. М.: Анахарсис; 2009.
- Лычкова А.Э. Серотониновая регуляция моторной функции тонкой кишки. Эксп. и клин. гастроэнтерология. 2011; 3: 130 — 135.
- Метельский С.Т. Физиологические механизмы всасывания в кишечнике. Рос. журн. гастроэнтерол., гепатол., колопроктол. 2009; 3:51-56.
- Парфёнов А.И. Энтерология. М.: ООО «Медицинское информационное агенство»; 2009.
- 1Парфёнов А.И. Синдром нарушенного пищеварения (К 50-летию открытия А.М. Уголевым мембранного пищеварения). Эксп. и клин. Гастроэнтерология. 2008; 7: 76-81.
- Петухов А.Б., Лысиков Ю.А., Морозов И.А. Энзиматический барьер слизистой оболочки тонкой кишки при патологии. «Санкт-Петербург — Гастро-2000». 2000; 1-2: 73.
- Положенкова Л.А., Герман С.В. Особенности клинической симптоматики гастроэзофагеальной рефлюксной болезни при избытке эндогенных стероидов в организме. Материалы Десятой Российской Гастроэнтерологической Недели. Российск. журн. гастроэнтерол., гепатол., колопроктол. 2004; 5: 13.
- Смирнова Г.О., Силуянов С.В. Периферическая электрогастроэнтерография в клинической практике. М.: ИД «МЕДПРАКТИКА-М»; 2009.
- Ступин В.А. Функциональная гастроэнтерология. Инструментальные методы исследования. Пособие для врачей. М.: ИД «МЕДПРАКТИКА-М»; 2009.
- Уголев А.М. Мембранный гидролиз и транспорт: новые данные и гипотезы. Л.; 1986.
- Чазова И.Е., Мычка В.Б. Метаболический синдром. М.: Медиа Медика; 2004.
- Шмидт Р., Тевс Г. Физиология человека. Т.3. М.: Мир; 1996.
- Avogaro P. Association of hyperlipidemia, diabetes mellitus and mild obesity. Acta Diabetol. Lat. 1967; 4: 572-590.
- Angelo J. Diabetes prevention: a review of current literature. Preventive Medicine. 2005; 5: 250-259.
- Balkau B. Eschwege E. Insulin resistance: an independent risk factor for cardivascular disease? Diabetes. Obesity&Metab. 1999; 1: 23-31.
- Codario R. A. Type 2 diabetes, pre-diabetes, and the metabolic syndrome: the primary care guide to diagnosis and management. Humana Press. Inc. 2005.
- Kerdo I. Einaus der Blutzirkulation kalkulierten Index zur Beurteilung der vegetativen Tonuslage. Acta neurovegetativa 1966; 29 (2): 250-268.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru







