Введение
Одной из важных проблем современной медицины являются неуклонный рост числа инфекционных заболеваний, вызванных резистентными штаммами микроорганизмов, и снижение эффективности антимикробных препаратов, используемых для их лечения. Развитие резистентности к антимикробным препаратам у возбудителей заболеваний требует использования альтернативных, нередко менее безопасных и эффективных антимикробных препаратов, что снижает качество оказания медицинской помощи Мониторинг чувствительности/устойчивости штаммов в популяции бактерий, определенной одним из регламентированных методов (диско-диффузионным методом, определением минимальной подавляющей концентрации в различных вариантах), является важнейшим элементом медицинской практики Инфекции, вызываемые полирезистентными бактериями и связанные с оказанием медицинской помощи, признаны глобальной проблемой Результаты исследований, проведенных в Российской Федерации в последние годы, показали, что в этиологической структуре инфекций, связанных с оказанием медицинской помощи, к ведущим возбудителям относятся Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter baumanii, а также Enterococcus faecalis и Enterococcus faecium [1]. Перечисленные микроорганизмы находятся под пристальным вниманием Европейской системы надзора за антибиотикорезистентностью (EARS-Net). К наиболее проблемным возбудителям с позиций выбора адекватной терапии относят: метициллинорезистентные штаммы S. aureus; устойчивые к цефалоспоринам расширенного спектра и карбапенемам штаммы
K. pneumoniae и E. coli; резистентные к карбапенемам штаммы P. aeruginosa и A. baumannii; устойчивые к ванкомицину штаммы E. faecalis и E. faecium.
Изучение механизмов резистентности микроорганизмов к антимикробным препаратам может проводиться с использованием как фенотипических (хромогенные среды, определение чувствительности к конкретным антимикробным препаратам диско-диффузионным методом или определение минимальной подавляющей концентрации в различных вариантах), так и молекулярно-генетических (детекция генов, ответственных за конкретные механизмы резистентности) методов [2].
С одной стороны, энтеробактерии являются представителями нормальной микрофлоры кишечника человека, с другой — могут быть возбудителями тяжелых как внебольничных, так и внутрибольничных инфекций. Бактерии, входящие в порядок Enterobacterales, колонизирующие кишечник, являются носителями генов как природной, так и приобретенной антибиотикорезистентности, которые могут передаваться от резистентных штаммов к чувствительным [3]. Частота обнаружения энтеробактерий с продукцией β-лактамаз расширенного спектра (Extended-spectrum beta-lactamase, ESBL) превышает 50% в большинстве стран мира [4]. Другими представителями нормальной микрофлоры кишечника являются энтерококки, которые становятся опасными при приобретении генов, ответственных за резистентность к ванкомицину. Колонизация слизистой оболочки кишечника ванкомицин-резистентными энтерококками (VRE) может сохраняться длительное время, от нескольких месяцев до нескольких лет [5].
Современные программы химиотерапии позволяют достичь высокой общей выживаемости у онкогематологических больных, но при этом увеличивается риск тяжелых инфекционных осложнений, частота которых достигает 80–90%. К данным осложнениям относится бактериемия, зачастую вызванная бактериями, обладающими каким-либо механизмом (маркером) резистентности: у энтеробактерий с высокой частотой встречаются изоляты, продуценты ESBL (43%), а у энтерококков — ванкомицин-резистентные штаммы (9%) [5–7].
В развитии инфекционных осложнений у больных, в первую очередь онкогематологических, преобладает эндогенный путь инфицирования, при котором бактерии со слизистой оболочки кишечника проникают в кровоток. В связи с этим микробиологический мониторинг слизистой оболочки кишечника у онкогематологических больных является неотъемлемой частью системы инфекционного контроля, позволяющей следить за циркуляцией возбудителей инфекций, связанных с оказанием медицинской помощи, изменениями в их структуре, тенденциями развития устойчивости к антимикробным препаратам.
Цель исследования: изучить колонизацию слизистой оболочки кишечника представителями порядка Enterobacterales с продукцией ESBL, устойчивыми к карбапенемам, Pseudomonas aeruginosa, устойчивыми к карбапенемам, и ванкомицин-резистентными Enterococcus фенотипическими и молекулярно-генетическими методами.
Материал и методы
Исследование проведено в период с 10 декабря 2019 г. по 30 марта 2020 г. Проанализировано 150 проб (131 проба с фекалиями на условно-патогенную микрофлору, 19 — мазки со слизистой оболочки прямой кишки) от 66 пациентов, находившихся на лечении в онкогематологическом центре ГАУЗ СО «ОДКБ». В исследование были включены дети в возрасте от 3 мес. до 16 лет (до года — 7 детей, от года до 7 лет — 26, от 7 лет до 10 лет — 14, от 11 лет до 16 лет — 19) с диагнозами: острый лимфобластный лейкоз (n=17), нейробластома (n=6), острый миелоидный лейкоз (n=4), апластическая анемия (n=5), острый лейкоз (n=4), остеосаркома Юинга (n=3), гистиоцитоз (n=3), прочие (n=24). Соотношение мальчиков (n=27) и девочек (n=39) 1:1,4. Пациенты находились в отделении анестезиологии, реанимации и трансплантологии костного мозга (n=18), отделениях детской онкологии № 1 (n=8) и № 2 (n=18), детской онкологии и гематологии (n=13), и 9 пациентов переходили в реанимацию или, наоборот, из реанимации с учетом их состояния Кратность обследования пациентов следующая: 1 проба — 35 пациентов; 2 пробы — 14; 3 пробы — 4; 4 пробы — 5; 5 проб — 5; 6, 7 и 15 проб — по одному пациенту.
Материал забирали и транспортировали в соответствии с методическими указаниями МУ 4.2.2039–05 [8].
Все пробы засевали на хромогенные селективные среды: «CHROMagarTM ESBL», «CHROMagarTM KPC», «CHROMagarTM VRE» (CHROMagar, Франция), затем инкубировали в термостате при температуре 36 °C в течение 18–24 ч. Среда «CHROMagarTM ESBL» предназначена для прямого выделения энтеробактерий с продукцией ESBL, «CHROMagarTM KPC» — для прямого обнаружения резистентных к карбапенемам грамотрицательных бактерий, «CHROMagarTM VRE» — для выявления и идентификации ванкомицин-резистентных штаммов Enterococcus (E. faecalis, E. faecium). Посев фекалий на условно-патогенную микрофлору проводили на среды Плоскирева, Эндо, Сабуро, желточно-солевой агар, 5% кровяной агар, висмут-сульфит агар (после 24-часового накопления на магниевой среде). Мазки со слизистой оболочки прямой кишки исследовали на среде Эндо. Идентификацию микроорганизмов проводили классическим бактериологическим методом, а также на полуавтоматическом анализаторе «ATB Expression» (bioMerieux, Франция) и автоматическом анализаторе «Phoenix M50» (Becton Dickinson, США).
Продукцию ESBL у энтеробактерий, полученных на хромогенной селективной среде «CHROMagarTM ESBL», подтверждали методом «двойных дисков». Резистентность к карбапенемам у грамотрицательных бактерий, и в частности у K. pneumoniae, продуцирующей карбапенемазы (Klebsiella pneumoniae carbapenemase — KPC), полученных на хромогенной селективной среде «CHROMagarTM KPC», доказывали определением резистентности к соответствующим карбапенемам диско-диффузионным методом Резистентность к ванкомицину у энтерококков, полученных на хромогенной селективной среде «CHROMagarTM VRE», подтверждали определением резистентности к ванкомицину диско-диффузионным методом
Постановку и оценку антибиотикочувствительности диско-диффузионным методом проводили на агаре Мюллера — Хинтона (Sifin diagnostics with passion, Германия) в соответствии с действующей нормативной документацией [9, 10]. Для выявления штаммов с множественной лекарственной резистентностью все изоляты, дающие рост на хромогенных средах, тестировали также на чувствительность к другим классам антибиотиков (табл. 1). В связи с изменениями в интерпретации результатов определения зон задержки роста в клинических рекомендациях в версии 2018–03 [9] и рекомендациях EUCAST (European Committee on Antimicrobial Susceptibility Testing) в версии 10.0, 2020 [10], которые внедрены с марта 2020 г., в таблице 1 указаны изменения в оценке результатов резистентности к антибиотикам
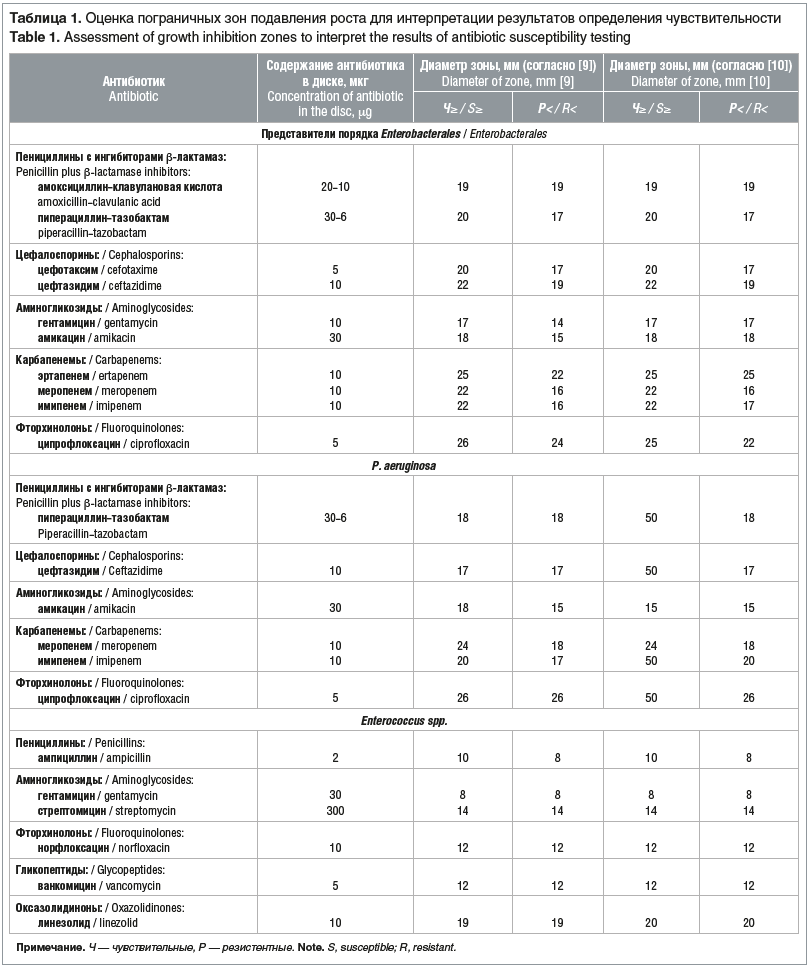
Для выявления продукции карбапенемаз без их дифференциации у P. aeruginosa и представителей порядка Enterobacterales применяли фенотипический метод инактивации карбапенемов (Carbapenem Inactivation Method, CIM) [11].
Молекулярно-биологическая детекция генов, кодирующих карбапенемазы у штамма Hafnia alvei, осуществлялась методом мультиплексной полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме реального времени с использованием наборов реагентов «АмплиСенс® MDR MBL-FL» и «АмплиСенс® MDR KPC/OXA-48-FL» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Россия). Выявлялись гены, кодирующие приобретенные сериновые карбапенемазы групп KPC и OXA-48-подобных (OXA-48 и OXA-162) и металло-бета-лактамазы с карбапенемазной активностью групп VIM, IMP и NDM.
Результаты и обсуждение
Всего выделено 67 штаммов представителей порядка Enterobacterales, 71 изолят энтерококков и 7 изолятов P. aeruginosa (табл. 2).
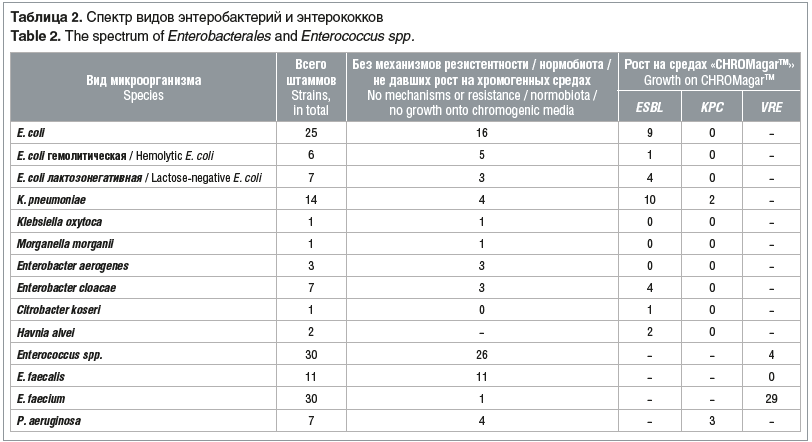
За исследуемый период было обследовано 66 детей. У 17 пациентов ростаэнтеробактерий, энтерококков, P. aeruginosa не обнаружено У 26 пациентов зарегистрирована колонизация кишечника одним или несколькими штаммами вышеперечисленных бактерий. У 9 пациентов при первых обследованиях роста не выявлено, затем имело место заселение кишечника: у 44,4% произошла колонизация нормофлорой, не обладающей изучаемыми механизмами резистентности (E. faecalis, Enterococcus spp., E. coli), у 44,4% — резистентной флорой (E. faecium, H. alvei, P. aeruginosa), у 11,2% — при первоначальной колонизации нормофлорой из-за длительно проводимой терапии произошла смена на ванкомицин-резистентный E. faecium. У 6 пациентов при первичной колонизации кишечника преимущественно штаммами, не обладающими антибиотикорезистентностью, за исключением одного пациента с E. coli с продукцией ESBL, на фоне проводимой антибиотикотерапии рост данных микроорганизмов перестал обнаруживаться У 6 пациентов произошла смена вида колонизирующего микроорганизма, на фоне постоянно выделяющегося ванкомицин-резистентного E. faecium или E. coli с продукцией ESBL менялись штаммы других видов энтеробактерий или энтерококков. У 2 пациентов внутри одного и того же чувствительного вида микроорганизма произошла селекция и колонизация резистентными штаммами: в первом случае место ванкомицин-чувствительного штамма E. faecium занял ванкомицин-резистентный, во втором — место карбапенем-чувствительного штамма P. aeruginosa занял резистентный штамм.
Пятнадцать пациентов на момент обследования не получали антибиотикотерапию, у них кишечник был колонизирован преимущественно штаммами без маркеров резистентности Остальные пациенты получали минимум один антибиотик, схема применяемого лечения зависела от диа-гноза основного заболевания, тяжести и стадии болезни, а также наличия осложнений
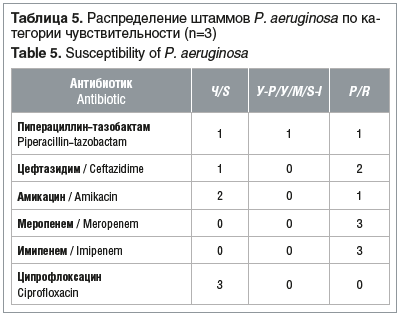
Все штаммы порядка Enterobacterales, рода Enterococcus и P. aeruginosa, не дающие рост на соответствующих средах «CHROMagarTM», не тестировались на чувствительность к антимикробным препаратам При повторном выделении у пациентов изолятов микроорганизмов, дающих рост на средах «CHROMagarTM», чувствительность к антибиотикам не определяли Чувствительность энтеробактерий, энтерококков и синегнойной палочки к антимикробным препаратам представлена в таблицах 3–5.
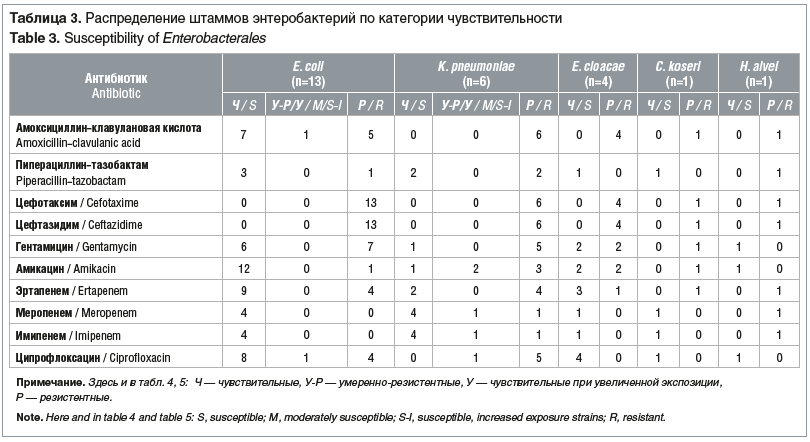
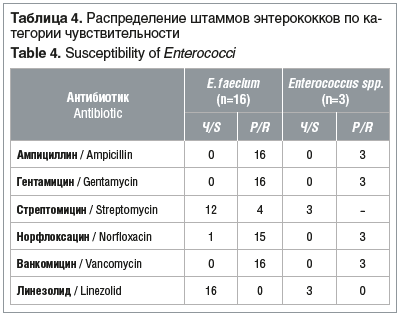
E. сoli типичная, с гемолитическими свойствами и лактозонегативная объединены в одну группу, так как интерпретация антибиотикочувствительности не зависит от морфологических и биохимических свойств кишечной палочки. У всех штаммов энтеробактерий, выросших на хромогенной среде «CHROMagarTM ESBL», продукция ESBL подтверждена методом «двойных дисков»: у E. сoli, K. pneumoniae, C. koseri путем использования дисков с цефтазидимом (10 мкг) и цефотаксимом (5 мкг) и диска, содержащего комбинацию амоксициллина с клавулановой кислотой (20–10 мкг), а у энтеробактерий с индуцибельными хромосомными AmpC: E. cloacae, H. alvei в дополнение к этому определялось наличие синергизма между диском цефепима (30 мкг) и диском, содержащим комбинацию амоксициллина с клавулановой кислотой (20–10 мкг) [12]. Два штамма K. pneumoniae, резистентных к карбапенемам и давших рост на среде «CHROMagarTM KPC», продуцировали ESBL и выросли на среде «CHROMagarTM ESBL». Резистентность к карбапенемам у продуцентов ESBL описана также рядом исследователей и может быть связана с комбинацией продукции ESBL и снижением проницаемости внешней мембраны [3].
При определении чувствительности к карбапенемам у представителей порядка Enterobacterales диско-диффузионным методом в первую очередь тестировали эртапенем как наиболее чувствительный к карбапенемазам антибиотик этой группы, но данный антимикробный препарат обладает меньшей специфичностью, поэтому изоляты, обладающие ESBL и AmpC, могут проявлять устойчивость к нему и в отсутствие карбапенемаз [12]. При выявлении умеренной резистентности или резистентности к эртапенему определялась чувствительность к меропенему и имипенему, для обнаружения карбапенемаз класса А ставили дополнительно диск с пиперациллином-тазобактамом, а также проводили CIM-тест. По результатам нашего исследования, если штамм энтеробактерий был только резистентен к эртапенему, он не давал роста на среде «CHROMagarTM KPC». Только у одного штамма K. pneumoniae CIM-тест был положительный, и он был резистентен к имипенему, меропенему, эртапенему, пиперациллину-тазобактаму, в данном случае, скорее всего, имела место продукция карбапенемаз класса А. У второго штамма K. pneumoniae CIM-тест был отрицательный, он резистентен к эртапенему, пиперациллину-тазобактаму и чувствителен при увеличенной экспозиции (ранее считался умеренно-резистентным) к имипенему и меропенему, скорее всего, в данном случае продукции карбапенемаз не было, а было снижение проницаемости внешней мембраны или имел место другой механизм [3]. Все остальные штаммы энтеробактерий, резистентные к эртапенему, были чувствительны к меропенему и имипенему, CIM-тест отрицателен.
Интересным представляется изолят H. alvei, резистентный к имипенему, меропенему, эртапенему, пиперациллину-тазобактаму, при этом, скорее всего, имели место продуцируемые карбапенемазы класса А. Культура не дала роста на среде «CHROMagarTM KPC», но согласно инструкции к данной среде она рассчитана на карбапенем-резистентные штаммы E. coli, группу KEC (Klebsiella, Enterobacter, Citrobacter), Pseudomonas, Acinetobacter, Stenotrophomonas. У H. alvei CIM-тест отрицательный Данный штамм был тестирован на гены резистентности методом ПЦР в реальном времени. Использованными нами ПЦР-наборами не определены гены резистентности: VIM, IMP, NDM, KPC, OXA-48, 162. Ни один фенотипический метод не обладает 100% чувствительностью По данным литературы, чувствительность CIM-теста составляет 82% [13, 14]. Существует модификация CIM-теста, разработанная с целью повышения его чувствительности, когда при приготовлении суспензии тестируемого изолята стерильную дистиллированную воду или 0,9% физиологический раствор заменяют на триптиказо-соевый бульон, что, с одной стороны, повышает чувствительность до 93%, но, с другой стороны, удорожает методику, поэтому она не используется в рутинной практике [14]. Наличие умеренно активных ферментов (карбапенемаз), в частности типа OXA-48, снижает чувствительность их определения [14]. Кроме того, при постановке CIM-теста необходимо строгое соблюдение методики — 24-часовое тестирование культуры и контрольных штаммов. В настоящее время «золотым стандартом» обнаружения продуцентов карбапенемаз являются молекулярные методы [14].
Однако разрешенные к применению в нашей стране ПЦР-наборы не включают весь спектр генов, ответственных за выработку карбапенемаз различных классов, поэтому точный механизм резистентности к карбапенемам у H. alvei выяснить не удалось.
В нашем исследовании колонизация кишечного тракта энтеробактериями с продукцией ESBL выявлена у 17 (25,8%) пациентов. Доминирующими представителями были Е. coli (44,8% — 13 штаммов) и K. pneumoniае (34,5% — 10 штаммов). У 5 (7,6%) детей выделены одновременно два и более штаммов, продуцирующих ESBL: Е coli + K. pneumoniае (n=2); Е. coli + E. cloacae (n=2); Е. coli + K. pneumoniae + E. сloacae (n=1).
Существует два типа ванкомицин-резистентности Первый тип, когда бактерия несет гены резистентности (главным образом типа VanC, а также VanD, VanE, VanF и т. д.), характерен для Enterococcus gallinarum, Enterococcus casseliflavus и Enterococcus flavescens, уровень резистентности в этом случае низкий. При втором типе имеет место приобретенная резистентность (типы VanA и VanB), часто обнаруживаемая у E. faecium и E. faecalis. Поэтому, чтобы вовремя обнаружить резистентные штаммы и предотвратить распространение резистентности, крайне важно детектировать VRE и дифференцировать их от других энтерококков
В нашем исследовании колонизация кишечного тракта ванкомицин-резистентными энтерококками, преимущественно E. faecium, выявлена у 18 (27,3%) пациентов
У 9 (13,6%) пациентов обнаруживался ванкомицин-резистентный энтерококк и энтеробактерия с продукцией ESBL.
У всех протестированных штаммов P. aeruginosa (n=3) продукция карбапенемазы фенотипическим методом (CIM) не выявлена, что, скорее, свидетельствует о других механизмах резистентности к карбапенемам.
Часто штаммы грамотрицательных бактерий имеют фенотип множественной резистентности к антимикробным препаратам (multiple drug resistanc, MDR), как минимум к трем препаратам, относящимся к различным категориям/классам антимикробных препаратов [15]. В нашем исследовании такие штаммы были среди Е. coli (n=1),
K. pneumoniae (n=3), P. aeruginosa (n=1).
Несмотря на значительные успехи, достигнутые в онкогематологии, инфекционные осложнения остаются одной из причин, ухудшающих прогноз при оказании высокотехнологичной помощи. В связи с этим необходима система надзора за ведущими возбудителями госпитальных инфекций и их резистентностью к антимикробным препаратам — микробиологический мониторинг, который позволит:
1) своевременно выявлять госпитальные штаммы микроорганизмов и разрабатывать стратегию и тактику борьбы с ними; 2) своевременно корректировать лекарственный формуляр на основе организации рационального взаимодействия клинических фармакологов, сотрудников лаборатории клинической микробиологии и госпитальных эпидемиологов; 3) активно выявлять пациентов с риском инфицирования, связанного с оказанием медицинской помощи
Заключение
Таким образом, на основании фенотипических и молекулярно-генетических исследований штаммов со слизистой толстого кишечника от пациентов, находящихся на лечении в онкогематологическом центре, практически у каждого 4-го (25,8–27,3%) определялась колонизация слизистой оболочки кишечника микроорганизмом с маркером устойчивости, и почти у каждого 7-го (13,6%) больного обнаружено 2 микроорганизма с маркерами резистентности. Среди энтеробактерий преобладали Е. coli и K. pneumoniae, среди энтерококков — E. faecium. Применение хромогенных сред для исследования образцов со слизистой кишечника позволило сделать заключение о наличии микроорганизмов с соответствующим маркером резистентности уже через 24 ч от момента поступления образцов в лабораторию Информирование онкологов о колонизации резистентными бактериями слизистой кишечника позволяет корректировать назначение антибактериальной терапии на различных этапах лечения, в т. ч у больных, перенесших трансплантацию костного мозга.
Сведения об авторах:
Боронина Любовь Григорьевна — д.м.н., профессор кафедры клинической лабораторной диагностики и бактериологии ФГБОУ ВО УГМУ Минздрава; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; секретарь научного отдела ГАУЗ СО «ОДКБ»; 620149, Россия, г. Екатеринбург,
ул. С. Дерябиной, д 32. ORCID iD 0000-0003-0152-962X.
Саматова Елена Валерьевна — км.н., врач-бактериолог лаборатории клинической микробиологии ГАУЗ СО «ОДКБ»; 620149, Россия, г Екатеринбург, ул. С Дерябиной, д. 32. ORCID iD 0000-0003-3154-6201.
Кукушкина Марина Павловна — заведующая лабораторией клинической микробиологии ГАУЗ СО «ОДКБ»; 620149, Россия, г. Екатеринбург, ул. С. Дерябиной, д. 32; ORCID iD 0000-0003-1980-9099.
Панова Светлана Анатольевна — врач-бактериолог лаборатории клинической микробиологии ГАУЗ СО «ОДКБ»; 620149, Россия, г Екатеринбург, ул. С Дерябиной, д. 32; ORCID iD 0000-0003-4347-0929.
Устюгова Светлана Сергеевна — врач-бактериолог лаборатории клинической микробиологии ГАУЗ СО «ОДКБ»; 620149, Россия, г. Екатеринбург, ул. С. Дерябиной, д. 32; ORCID iD 0000-0002-0053-4884.
Асновская Анна Геннадьевна — врач-бактериолог лаборатории клинической микробиологии ГАУЗ СО «ОДКБ»; 620149, Россия, г. Екатеринбург, ул С. Дерябиной, д. 32. ORCID iD 0000-0003-1649-1310.
Контактная информация: Саматова Елена Валерьевна, e-mail: lavrinenko@eka-net.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует Статья поступила 02.07.2020, поступила после рецензирования 27.07.2020, принята в печать 19.08.2020.
About the authors:
Lyubov’ G. Boronina — Doct. of Sci. (Med.), professor of the Department of Clinical Laboratory Diagnostics & Bacteriology, Ural State Medical University; 3, Repin str., Yekaterinburg, 620028, Russian Federation; secretary of the Scientific Division, Regional Children’s Clinical Hospital; 32, S. Deryabina str., Yekaterinburg, 620149, Russian Federation; ORCID iD 0000-0003-0152-962X.
Elena V. Samatova — Cand. of Sci. (Med.), bacteriologist of the Laboratory of Clinical Microbiology, Regional Children’s Clinical Hospital; 32, S. Deryabina str., Yekaterinburg, 620149, Russian Federation; ORCID iD 0000-0003-3154-6201.
Marina P. Kukushkina — Head of the Laboratory of Clinical Microbiology, Regional Children’s Clinical Hospital; 32, S. Deryabina str., Yekaterinburg, 620149, Russian Federation; ORCID iD 0000-0003-1980-9099.
Svetlana A. Panova — bacteriologist of the Laboratory of Clinical Microbiology, Regional Children’s Clinical Hospital; 32, S. Deryabina str., Yekaterinburg, 620149, Russian Federation; ORCID iD 0000-0003-4347-0929.
Svetlana S. Ustyugova — bacteriologist of the Laboratory of Clinical Microbiology, Regional Children’s Clinical Hospital; 32, S. Deryabina str., Yekaterinburg, 620149, Russian Federation; ORCID iD 0000-0002-0053-4884.
Anna G. Asnovskaya — bacteriologist of the Laboratory of Clinical Microbiology, Regional Children’s Clinical Hospital; 32, S. Deryabina str., Yekaterinburg, 620149, Russian Federation; ORCID iD 0000-0003-1649-1310.
Contact information: Elena V. Samatova, e-mail: lavrinenko@eka-net.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 02.07.2020, revised 27.07.2020, accepted 19.08.2020.
.
Информация с rmj.ru