Клинико-патогенетическая роль рецепторов к комплементу у больных хронической спонтанной крапивницей
Содержание статьи
Введение
Хроническая спонтанная крапивница (ХСК) — заболевание, характеризующееся появлением уртикарных элементов сыпи и/или ангиоотеков (АО) и сохраняющихся на протяжении не менее 6 нед. [1]. Хроническая крапивница развивается у 20–45% пациентов, перенесших острую крапивницу, причем у женщин в 2 раза чаще. Средний возраст пациентов с ХСК колеблется от 25 до 55 лет. У половины пациентов симптомы сохраняются менее 2 лет, и менее чем в 20% случаев симптомы могут сохраняться более 10 лет [2]. Помимо ХСК выделяют хронические индуцированные крапивницы, возникающие под воздействием различных триггеров: холода, солнечного излучения, давления, вибрации, тепла и др. Оказалось, что лишь 16% больных, страдающих индуцированной крапивницей, имеют длительность заболевания до 1 года [2].
В патогенезе ХСК ведущую роль играют тучные клетки (ТК) и базофилы. Активацию ТК могут вызывать как иммунологические, так и неиммунологические факторы. При дегрануляции ТК выделяются преформированные вазоактивные медиаторы, прежде всего гистамин. Активность заболевания может коррелировать с существенным увеличением в сыворотке С-реактивного белка, интерлейкина-6 (ИЛ-6), растворимого рецептора к ИЛ-6. Поскольку сон и циркадные ритмы связаны с ИЛ-6 опосредованными процессами, то возникла гипотеза о том, что причиной усиления тяжести симптомов крапивницы ночью может быть ночное физиологическое повышение концентрации ИЛ-6 и растворимых рецепторов [2].
В настоящее время некоторые авторы выделяют 2 патогенетических варианта крапивницы: 1) зависимая от ТК и 2) независимая от ТК. Активация ТК при крапивнице может происходить в результате реакций IgE-опосредованной гиперчувствительности. Это классический механизм активации, который характерен для некоторых случаев острой или эпизодической крапивницы, например при острой крапивнице на пищевые аллергены или контактной крапивнице на латекс. В то же время роль IgE менее важна при хронической крапивнице. Показана низкая корреляция между уровнем IgE и тяжестью ХСК. У 30% пациентов с ХСК выявляют IgG-антитела к высокоаффинным рецепторам к IgE- FceR1a и IgA, а также анти-IgE-антитела [1]. Неиммунологические механизмы, которые напрямую активируют ТК, включают воздействие радиоконтрастных веществ, опиатов, нейропептидов (например, субстанции Р) и некоторых пищевых продуктов.
Изучается роль и других факторов, в частности компонентов комплемента C3a, C4a, C5a, функционирующих как анафилотоксины [3]. Эти факторы путем прямого воздействия на поверхность ТК вызывают их дегрануляцию. Целый ряд рецепторов к комплементу экспрессируются на поверхности ТК, такие как CR1, CR2, C3aR, CR4,
C5aR [4]. Таким образом, при связывании комплемента с рецептором на ТК происходит их дегрануляция с выходом большого числа вазоактивных веществ [4].
Рецепторы системы комплемента присутствуют в организме и в растворенном виде. Предполагается, что растворимые рецепторы представляют собой высокоактивные молекулы, обладающие противовоспалительным эффектом и способностью подавлять активацию системы комплемента. Так, рецепторы CR1 связываются с белками комплемента C3b, C4b, C3bi и C1q и являются регуляторами активности комплемента [5]. Возможно, циркулирующие CR1 принимают участие в патогенезе ХСК. В литературе нами не найдено сведений об изучении рецепторов системы комплемента у больных ХСК.
Важно отметить, что в патогенезе крапивницы участвует множество факторов, в частности, независимых от ТК. Так, при контактной крапивнице на диметилсульфоксид антигистаминные препараты (АГП) оказываются неэффективными, поскольку в патогенезе играет основную роль не гистамин, а простагландин. Помимо указанных выше механизмов изучается роль адипокинов, факторов свертывания и др.
Рекомендуемая терапия ХСК включает поэтапное назначение неседативных Н1-антигистаминных препаратов (нсАГП), начиная с терапевтической дозы. В то же время у 50% пациентов заболевание резистентно к данной терапии, и в соответствии с Консенсусом 2018 г. рекомендуется увеличение дозы нсАГП до 4-кратной (терапия off-lable). При неэффективности увеличения дозы нсАГП необходим переход на третью линию терапии, а именно лечение моноклональными антителами (омализумаб). Следует обратить внимание на то, что часть пациентов остаются резистентными как к увеличенной дозе АГП, так и к анти-IgE-моноклональным антителам. В связи с этим представляет интерес изучение других факторов патогенеза, способных индуцировать дегрануляцию ТК, в частности активации ТК через систему рецепторов комплемента.
Цель исследования: изучить клинико-патогенетическую роль растворимых рецепторов к комплементу (C1qR1) у больных ХСК, а также сопоставить полученные результаты с клиническими особенностями заболевания.
Материал и методы
В исследование включены 49 больных ХСК старше 18 лет — 12 мужчин (24,5%) и 37 женщин (75,5%), средний возраст — 40,8±3,21 года. Группу контроля составили 34 здоровых донора: 6 мужчин (17,6%) и 28 женщин (82,4%), средний возраст — 39,1±2,25 года. Больные ХСК были разделены на 2 группы в зависимости от клинической картины заболевания. В группу 1 вошли 36 больных с сочетанием ХСК и АО — 8 мужчин (22,2%) и 28 женщин (77,8%), средний возраст — 43,8±2,96 года. В группу 2 вошли 13 пациентов с ХСК без АО — 4 мужчины (30,8%) и 9 женщин (69,2%), средний возраст — 40,5±4,3 года. Концентрацию C1qR1 в сыворотке крови определяли методом иммуноферментного анализа с использованием тест-систем Cloud-Clone Corp. (USA) на ридере Dynex Technologies.
Статистический анализ проводили методами непараметрической статистики. Описательную статистику анализировали, используя среднее значение и ошибку среднего (M±m). Для расчета уровня значимости (p) использовали критерий Манна — Уитни. Критической величиной уровня значимости р считали 0,05. Для обработки данных использовали программное обеспечение MS Excel и R-statistics.
Результаты исследования
В результате проведенного нами исследования установлено, что у больных ХСК при наличии АО отмечается достоверное увеличение C1qR1 по сравнению с больными без АО (рис. 1).
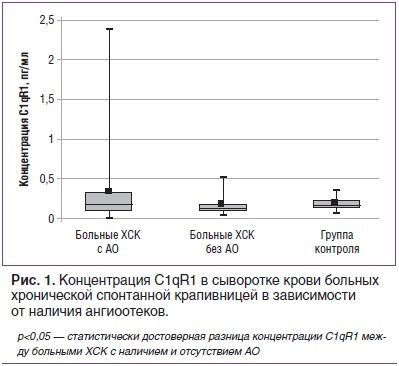
Как видно из представленных данных, у пациентов с ХСК и АО концентрация C1qR1 составляет 0,32±0,07 пг/мл, что существенно выше, чем у больных без АО — 0,17±0,05 пг/мл. Однако следует отметить, что показатели в обеих группах достоверно не отличались от показателей в контрольной группе — 0,18±0,01 пг/мл.
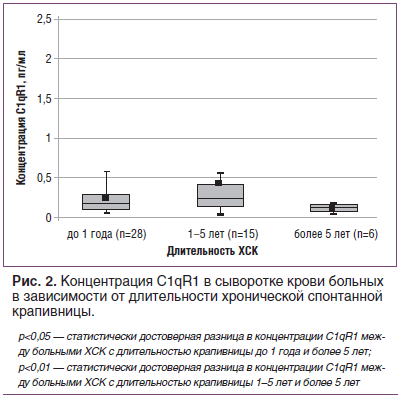
Известно, что ХСК может сохраняться в течение месяцев и лет. В связи с этим остается актуальным изучение патогенетических особенностей в зависимости от длительности заболевания. С этих позиций нами было проведено изучение концентрации C1qR1 у больных ХСК с разной длительностью болезни (рис. 2). Оказалось, что у больных с длительностью ХСК более 5 лет концентрация C1qR1 была достоверно ниже по сравнению с показателями у пациентов двух других групп: с длительностью заболевания до 1 года и от 1 года до 5 лет (0,09±0,02 пг/мл, 0,22±0,03 пг/мл и 0,41±0,16 пг/мл соответственно). Возможно, что такое истощение пула растворимых рецепторов влияет не только на длительность заболевания, но и на устойчивость к АГП.
Существенных различий в содержании C1qR1 у пациентов с ХСК в зависимости от пола и возраста не установлено. Так, у женщин с ХСК концентрация растворимых рецепторов составила 0,24±0,04 пг/мл, у мужчин — 0,41±0,20 пг/мл (p>0,05). Концентрация C1qR1 у больных ХСК 18–39 лет составила 0,24±0,04 пг/мл, 40–59 лет — 0,18±0,04 пг/мл, 60 лет и старше — 0,46±0,24 пг/мл (p>0,05).
Обсуждение
Первые работы по изучению системы комплемента при крапивнице были опубликованы еще в 1970-х гг. [6–8]. Тем не менее данных о вовлечении компонентов комплемента в механизмы ХСК мало. Показано, что у пациентов с ХСК содержание белков комплемента С3, С4, С5, С9 в сыворотке крови выше, чем у здоровых доноров [8, 9]. Имеются данные, что у 30% обследованных больных ХСК уровень C1q и C1s выше верхней границы нормы [8].
Активация системы комплемента и дегрануляция ТК — два фактора, которые способствуют повышению концентрации растворимых рецепторов комплемента. Циркулирующие рецепторы обладают комплементрегулирующей функцией и являются результатом протеолиза мембраносвязанной формы рецепторов [5]. Нами установлено, что у пациентов при сочетании ХСК и АО концентрация C1qR1 выше, чем у больных без АО (0,32±0,07 пг/мл и 0,17±0,05 пг/мл соответственно, p<0,05). Возможно, что при развитии АО происходит более массивная дегрануляция ТК, в результате чего высвобождается большее количество C1qR1. Кроме того, при АО поражаются глубокие слои дермы, и это может способствовать выходу C1qR1 в центральный кровоток, в отличие от случаев ХСК без АО.
Исследование показало, что у пациентов с длительностью крапивницы более 5 лет уровень растворимых рецепторов достоверно ниже, чем у больных с меньшей продолжительностью крапивницы (0,09±0,02 пг/мл и 0,28±0,06 пг/мл соответственно, p<0,05). Возможно, истощение пула растворимых рецепторов приводит к усилению прямого контакта аутоаллергенов с мембраносвязанными рецепторами ТК и далее к их дегрануляции. Нами также определено, что содержание C1qR1 у больных ХСК не зависит от пола и возраста пациентов. Таким образом, полученные данные об изменении концентрации растворимых рецепторов к C1q комплемента свидетельствуют о несомненной роли растворимых рецепторов комплемента в патогенезе ХСК, а следовательно, о влиянии их на результаты лечения больных.
Согласно Международному консенсусу первой линией терапии ХСК являются нсАГП. При неэффективности терапии первой линии в течение 2–4 нед. необходим переход на вторую линию терапии, т. е. увеличенную вплоть до 4-кратной дозу нсАГП. Необходимо отметить, что у значительной части пациентов с ХСК имеет место Н1-резистентная форма заболевания [10]. При этом показано, что у этих больных определяются более высокие уровни белков системы комплемента (С3, С5а), чем у пациентов, отвечающих на лечение нсАГП [10, 11]. Поскольку лечение пациентов на втором этапе производится off-label, то особую важность приобретает вопрос выбора АГП.
На сегодняшний день выбор АГП II поколения довольно широк (дезлоратадин, эбастин, цетиризин, фексофенадин, лоратадин). В том случае, когда крапивница контролируется терапевтической дозой препарата, ограничением может быть лишь возраст пациента. При увеличении дозы АГП определенные преимущества имеют те препараты, которые выпускаются в двойной дозировке. Таким уникальным свойством, в частности, обладает эбастин (например, препарат ЭСПА-БАСТИН®). Это неседативный блокатор Н1-гистаминовых рецепторов, предназначенный, в частности, для лечения крапивницы. В клинических исследованиях по эффективности и безопасности эбастина при холодовой крапивнице довелось участвовать нашему коллективу еще в 1998 г. В дальнейших рандомизированных исследованиях неоднократно подтверждались раннее начало действия препарата и его безопасность как в дозировке 10 мг, так и в дозировке 20 мг. Действие эбастина начинается через час после приема и продолжается в течение 48 ч [12]. После 5-дневного курса лечения антигистаминный эффект сохраняется в течение 72 ч за счет действия активного метаболита [13]. Эбастин в дозах, превышающих терапевтические, не вызывает нежелательных реакций [14]. Препарат не взаимодействует с седативными средствами, пищей, этанолом и этанолсодержащими препаратами [13].
Заключение
Впервые показано, что в патогенезе ХСК участвуют растворимые рецепторы к C1q-компоненту комплемента. При этом у больных с более тяжелыми формами ХСК, сопровождающимися АО, выявлено достоверное увеличение содержания растворимых рецепторов к С1q-компоненту комплемента по сравнению с больными ХСК без АО. Давность заболевания влияет на концентрацию растворимых рецепторов. Установлено достоверное снижение содержания C1qR1 в сыворотке крови больных ХСК с длительностью заболевания более 5 лет. Содержание C1qR1 у больных ХСК не зависит от пола и возраста. Основной линией терапии ХСК является применение неседативных Н1-АГП. С переходом на вторую линию терапии (off-label), требующую увеличения дозы до 2–4-кратной, оптимальным выбором следует считать те АГП, которые выпускаются в двух дозировках.
Информация с rmj.ru