Введение
За последние десятилетия смертность пациентов с системной красной волчанкой (СКВ) от активных проявлений болезни уменьшилась, тогда как смертность от коморбидных состояний и осложнений лечения кратно увеличилась [1, 2]. Не вызывает сомнения негативное влияние длительного приема высоких и средних доз глюкокортикоидов (ГК) на развитие коморбидных состояний и стероид-зависимых осложнений. Потому проблема уменьшения дозы ГК до относительно безопасной поддерживающей суточной дозы в 5–7,5 мг является актуальной и определяется зачастую неоптимальным контролем активности СКВ в современных условиях [3]. Как результат, пациенты молодого репродуктивного возраста с СКВ получают повреждение внутренних органов не только по причине их аутоиммунного поражения, но и за счет влияния на органы и ткани ГК. Стероидорезистентность (СР) пациентов с СКВ является одной из наиболее обсуждаемых проблем отечественных и зарубежных публикаций [4]. Неспособность в течение 3 мес. снизить дозу ГК до 7,5 мг/сут в преднизолоновом эквиваленте принято расценивать как СР [5].
Для прогностической оценки риска СР ранее нами был разработан индекс СР, учитывающий возраст постановки диагноза СКВ, титр антинуклеарного фактора (АНФ), уровень антител (АТ) к двуспиральной ДНК (дсДНК) и значение индекса активности СКВ SLEDAI-2K (Systemic Lupus Erythematosus Disease Activity Index) на момент их оценки [6, 7]. Очевидно, что формированию СР может способствовать множество факторов, включая коморбидные состояния, стартовую активность и терапию СКВ. Клинический профиль пациентов также может быть основой для формирования СР. Ранее считалось, что СР более подвержены лица с тяжелой жизнеугрожающей СКВ, характеризующейся нефритом, поражением центральной нервной системы, крови и др. Эти формы заболевания сейчас активно контролируются мощной цитостатической терапией и все реже демонстрируют длительную СР (так называемый интерфероновый профиль СКВ). Вместе с тем нежизнеугрожающие кожно-суставные формы СКВ ввиду их недолечивания на начальных этапах лечения и клинической резистентности в настоящий момент все чаще ассоциируются с развитием СР. Изучение ассоциирующихся с развитием СР клинических и иммунологических особенностей СКВ и коррекция указанных факторов могут способствовать уменьшению числа лиц со стероидорезистентным течением болезни, что в перспективе улучшит качество и повысит продолжительность жизни больных с СКВ.
Цель исследования: изучение клинико-лабораторных особенностей и коморбидных состояний, ассоциирующихся с высоким риском СР у пациентов с СКВ.
Содержание статьи
Материал и методы
Одноцентровое неинтервенционное исследование проведено на базе СПб ГБУЗ «КРБ им. В.А. Насоновой» (ранее СПб ГБУЗ КРБ № 25) и ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России.
Выполнен ретроспективный анализ 1254 амбулаторных карт пациентов, наблюдающихся в СПб ГБУЗ «КРБ им. В.А. Насоновой» с диагнозом СКВ, установленным за 12 мес. и более до начала настоящего исследования. Диагноз СКВ был установлен в соответствии с критериями SLICC 2012 / EULAR 2019 (Systemic Lupus International Collaborating Clinics 2012 / European League Against Rheumatism 2019) [8].
В исследование включали женщин 18–60 лет, подписавших добровольное информированное согласие на участие в нем (пациенты мужского пола были исключены ввиду малочисленности группы). Из исследования были исключены лица до 18 и старше 60 лет, беременные и кормящие женщины, лица с ограничением свободы волеизъявления, пациенты с 4–5-й стадиями хронической болезни почек, другими ревматическими заболеваниями. В исследование не включали данные пациенток с острыми или хроническими инфекционными заболеваниями, злокачественными новообразованиями, психическими заболеваниями, больных, которые перенесли оперативное вмешательство в течение 12 нед., предшествовавших исследованию.
Суммарно после оценки критериев включения и исключения/невключения в исследование были отобраны 187 пациенток. При помощи компьютерной программы по собственной методике рассчитывали вероятность развития СР у пациенток. Расчет индекса СР проводили на основании возраста постановки диагноза СКВ, текущего значения индекса активности SLEDAI-2K, текущего титра АНФ и уровня АТ к дсДНК. Индекс СР <0,5 расценивали как показатель низкого риска СР. При значениях индекса СР ≥0,5 риск развития СР расценивали как высокий [6, 7]. Активность СКВ определяли по индексу SLEDAI-2K [9].
Собирали данные о лечении СКВ и коморбидных состояниях на момент вступления пациенток в исследование и в анамнезе. Для оценки коморбидности использовали индекс Чарлсон [10]. Стратификацию риска сердечно-сосудистых событий выполняли с помощью индекса QRISK3 [11].
Все полученные в ходе исследования данные пациенток были обезличены и не позволяли идентифицировать отдельную пациентку как личность. Исследование проводили в соответствии с Федеральным законом от 27.07.2006 № 152-ФЗ «О персональных данных» в действующей редакции. Исследование одобрил комитет по этике СПб ГБУЗ КРБ № 25.
Статистический анализ осуществляли с помощью пакета программного обеспечения Statistica. В случае нормального распределения признака его описывали как среднее ± стандартное отклонение (M±SD). При отклонении распределения от нормального указывали медиану, 1-й и 3-й квартили Ме [Q1; Q3]. Для сравнения групп применяли t-критерий. Качественные показатели представлены в абсолютных и относительных (%) значениях. Для сравнения групп использовался критерий χ2. Различия и взаимо-связи считали статистически значимыми при p≤0,05.
Результаты исследования
Из 187 включенных в исследование пациенток с СКВ 100 пациенток имели высокий риск СР (срСКВ) и 87 пациенток — низкий риск СР (несрСКВ). Средний возраст пациенток с срСКВ составил 46,5±12,9 года, с несрСКВ — 36,9±13,6 года (р=0,01), длительность болезни на момент исследования (время с момента постановки диагноза) — 12,2±9,5 и 14,2±11,6 года соответственно (p=0,3). Закономерно, что пациентки с срСКВ имели больший индекс SLEDAI-2K по сравнению с пациентками с несрСКВ (5,62 против 3,8, p=0,0006). Значимых различий в структуре органных поражений при СКВ у обследованных пациенток не выявлено (табл. 1).
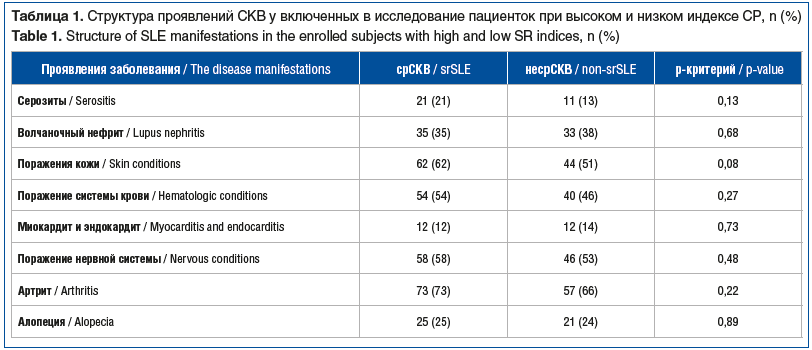
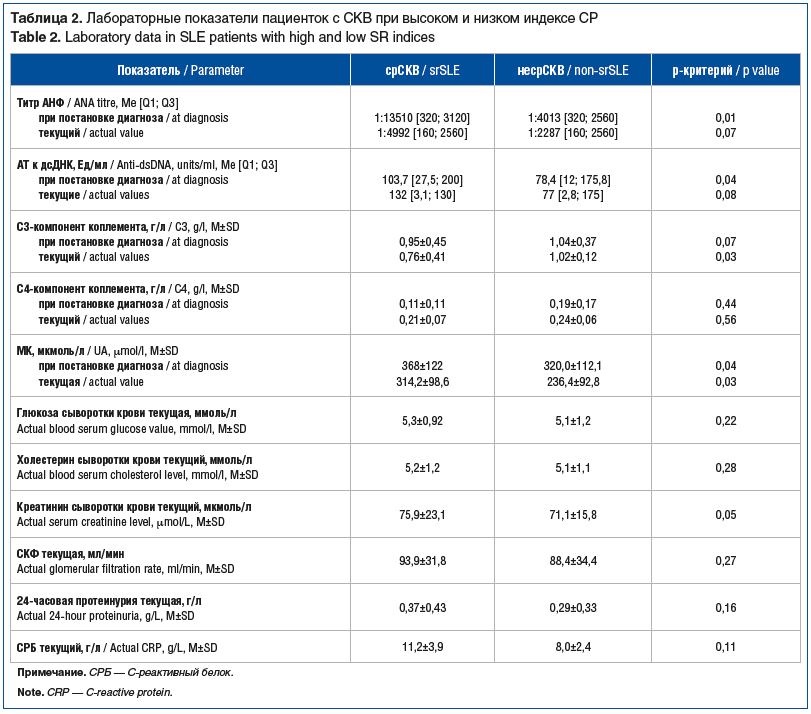
У пациенток с наличием и отсутствием СР были выявлены значимые различия в некоторых лабораторных показателях: титр АНФ на момент постановки диагноза у пациенток с срСКВ значимо превосходил таковой у пациенток без СР (1:13510 против 1:4013, p=0,01), притом что на момент включения в исследование значимых отличий в титре АНФ у пациенток с срСКВ не установили (1:4992 против 1:2287, p=0,07). Кроме того, больные срСКВ имели достоверно более высокий уровень АТ к дсДНК при постановке диагноза (103,7 Ед/мл против 78,4 Ед/мл, p=0,04), с сохранением этой тенденции к моменту включения в исследование (табл. 2). Пациентки группы срСКВ характеризовались тенденцией к снижению уровня С3-компонента комплемента при постановке диагноза (0,95 г/л против 1,04 г/л, p=0,07), тогда как на момент исследования и оценки индекса СР снижение достигло статистической значимости (0,76 против 1,02, p=0,03). Значимых различий в значениях С4-компонента комплемента выявлено не было. Отмечены более высокие уровни сывороточной мочевой кислоты (МК) как при постановке диагноза, так и на момент проведения исследования. При этом средний уровень МК в дебюте СКВ достиг уровня бессимптомной гиперурикемии (ГУ) со снижением до референтных значений в дальнейшем. Средние значения сывороточного креатинина сохранялись в пределах референтных значений, но у пациенток группы срСКВ достоверно превосходили показатели группы сравнения (см. табл. 2). Значимых различий в результатах клинического анализа крови выявлено не было.
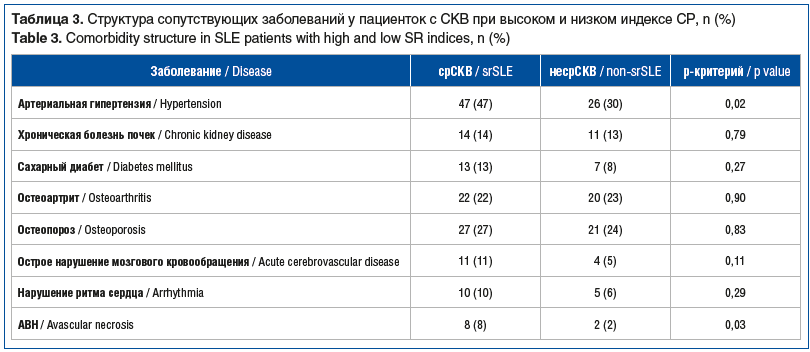
Известно, что длительный прием ГК ассоциирован с развитием обширного комплекса коморбидных состояний, таких как сердечно-сосудистые заболевания, ожирение, сахарный диабет 2 типа, остеопороз [3]. Анализ структуры сопутствующей патологии у обследованных больных показал значительно более частое выявление артериальной гипертензии и аваскулярных некрозов (АВН) у пациенток группы срСКВ. При этом достоверных различий в частоте встречаемости других ассоциированных с длительным приемом ГК состояний, таких как остеопороз и сахарный диабет, не отмечено (табл. 3).
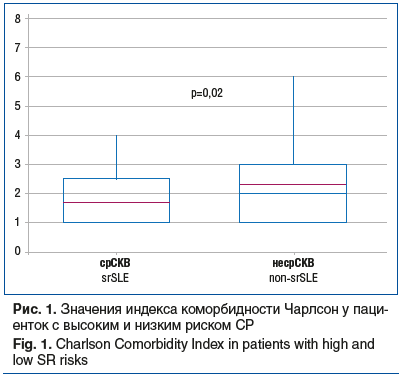
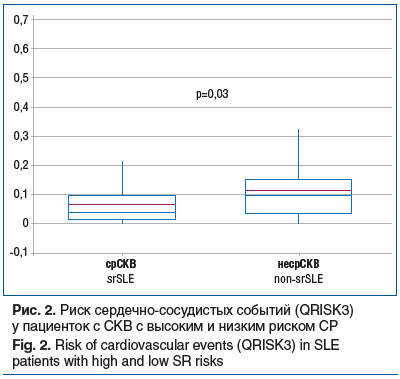
Пациентки с срСКВ имели более высокий индекс коморбидности Чарлсон (рис. 1) и показатели сердечно-сосудистого риска QRISK3 (рис. 2).
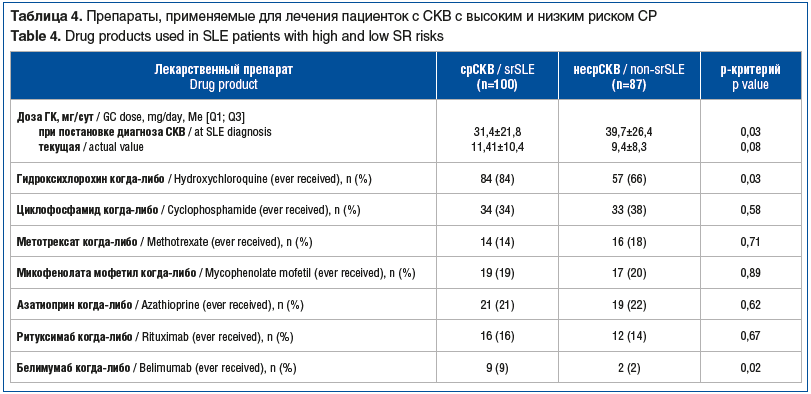
Установлено, что дозы ГК, назначенные пациенткам с срСКВ на момент постановки диагноза, были достоверно ниже, чем при несрСКВ. При этом пациентки с срСКВ чаще получали гидроксихлорохин и белимумаб, значимых различий по другим препаратам выявлено не было (табл. 4).
Клинико-иммунологические особенности пациенток с разными предикторами формирования СР и разными исходами заболевания демонстрируют следующие клинические наблюдения.
Клиническое наблюдение 1
Пациентка К., 2004 г. р., с дебютом СКВ в возрасте 15 лет, проявлявшимся артритом суставов кистей и коленных суставов, геморрагической сыпью, волчаночным нефритом IV–V морфологического класса, трехростковой цитопенией. Отмечены значительное повышение уровня АТ к дсДНК (123 Ед/мл) и титра АНФ (1:2580), снижение уровня С3-компонента комплемента. На момент дебюта болезни активность СКВ по индексу SLEDAI-2K составляла 22 балла. Пациентка получала пульс-терапию метилпреднизолоном, с переходом на пероральный прием ГК 60 мг/сут в преднизолоновом эквиваленте, гидроксихлорохин по 400–200 мг/сут, метотрексат 25 мг/нед. подкожно с достижением в течение полугода низкой активности заболевания. Доза ГК постепенно редуцирована до 20 мг/сут. Дальнейшие попытки снижения дозы ГК сопровождались отрицательной динамикой клинико-лабораторных показателей, нарастанием протеинурии, в связи с чем была назначена анти-В-клеточная терапия (ритуксимаб). К моменту включения в исследование пациентка получила 4 цикла ритуксимаба в дозе 1000 мг на цикл, что позволило добиться снижения дозы ГК на 2,5 мг/сут и клинико-лабораторной ремиссии (SLEDAI-2K 1 балл). Текущие показатели титра АНФ составили 1:640, АТ к дсДНК — 1,8 Ед/мл. Оценка индекса СР 0,27 соответствовала низкому риску СР, доза преднизолона редуцирована до полной отмены. Применение высоких доз ГК более 3 мес. привело к развитию остеопороза с компрессионными переломами поясничных позвонков, формированию многоочагового АВН (с двусторонним поражением бедренных и большеберцовых костей), что потребовало назначения специфического лечения.
Клиническое наблюдение 2
Пациентка М., 1988 г. р. наблюдается в СПб ГБУЗ «КРБ им. В.А. Насоновой» с 2021 г. В возрасте 29 лет при первой беременности антенатальная гибель плода при сроке гестации 21–22 недели. В возрасте 31 года появление артралгий, язвенных поражений слизистой оболочки полости рта, фотосенсибилизации, в связи с чем направлена к ревматологу. При обследовании выявлены повышение титра АНФ до 1:1280, АТ к дсДНК до 200 Ед/мл, высокий титр антител к кардиолипину. Активность заболевания по индексу SLEDAI-2K 4 балла. Ретроспективная оценка индекса СР составила 0,73, что соответствует высокому риску СР. Пациентке назначена терапия преднизолоном внутрь в дозе 30 мг/сут, гидроксихлорохином 200 мг/сут, на фоне чего отмечено клинико-лабораторное улучшение. Однако при снижении дозы ГК до 20 мг/сут имели место значительное усиление артралгий, рецидивирующие язвенные поражения слизистой ротовой полости, нарастание уровня АТ к дсДНК. Пациентка получала редуцированную пульс-терапию метилпреднизолоном по 250 мг № 3 внутривенно, назначен азатиоприн 100 мг/сут внутрь, на фоне чего отмечено уменьшение язвенных поражений слизистой полости рта. К моменту включения в исследование пациентка продолжала получать преднизолон в дозе 10 мг/сут внутрь, гидроксихлорохин 200 мг/сут. При неоднократных попытках дальнейшего снижения дозы ГК в течение последнего года — рецидив язвенных поражений слизистой. На фоне лечения сформировался синдром Иценко — Кушинга, отмечено развитие АВН. Оценка иммунологического статуса показала повышение титра АНФ до 1:1280, АТ к дсДНК — до 102 Ед/мл. Индекс СР составил 0,57, что также соответствует высокому риску СР. Данный пример демонстрирует СР нежизнеугрожающей формы СКВ с поражением кожи, слизистых оболочек. В указанном случае перспективно применение антиинтерфероновой терапии, например анифролумаба (лечение инициировано).
Клиническое наблюдение 3
Пациент П., 1981 г. р. (данные пациента были проанализированы, но не включены в выборку по половому признаку, представлен как показательный).
В возрасте 27 лет появились папуло-сквамозные высыпания на коже лица, ушных раковин, по данным гистологического исследования кожного биоптата верифицирован диагноз дискоидной волчанки. Получал терапию пероральными ГК в дозе 20 мг/сут, на фоне чего отмечено разрешение высыпаний, доза преднизолона редуцирована до полной отмены. Через 2 года (в 2015 г.) рецидив кожных высыпаний, появление язвенных поражений полости рта, артрита суставов кистей, очаговой алопеции. При обследовании выявлено повышение титра АНФ до 1:640, АТ к дсДНК — до 88 Ед/мл. На основании клинических и лабораторных данных установлен диагноз СКВ высокой активности (SLEDAI-2K 8 баллов), возобновлен прием ГК в дозе 20 мг/сут, начат прием гидроксихлорохина 400 мг/сут с умеренной положительной динамикой. Ретроспективная оценка индекса СР 0,8, что соответствует высокому риску. В дальнейшем развитие лекарственного поражения печени с повышением уровня печеночных транс-аминаз более 3 норм, гидроксихлорохин отменен, назначен метотрексат 15 мг/нед., на фоне чего также отмечено повышение уровня печеночных трансаминаз более 3 верхних границ норм, препарат отменен. Пациент продолжал прием ГК 20 мг/сут, при снижении дозы — рецидив высыпаний, суставного синдрома. В 2018 г. усугубление кожного поражения, алопеции, артритов кистей. Пациент был включен в клиническое исследование, в рамках которого получал комбинированную терапию ритуксимабом и белимумабом с развитием положительного ответа по кожному и суставному синдрому, дозу ГК удалось снизить до 10 мг/сут. При дальнейшем снижении дозы преднизолона отмечался рецидив кожных проявлений, язвенных поражений слизистой оболочки полости рта. В 2022 г. с учетом преобладания кожных проявлений, отсутствия признаков поражения жизненно важных органов пациент переведен на терапию анифролумабом в дозе 300 мг внутривенно 1 раз в 4 нед. Через 1 мес. отмечена значимая положительная динамика кожного процесса, после 12 нед. терапии отмечено восстановление роста волос в зонах алопеции. Доза преднизолона снижена до полной отмены при сохранении клинико-лабораторной ремиссии (SLEDAI-2K 0 баллов). Отмечено снижение иммунологических показателей (титр АНФ 1:160, АТ к дсДНК 6,6 Ед/мл). Текущая оценка индекса СР 0,22 соответствует низкому риску. Осложнением длительного применения средних доз ГК явился метаболический синдром с артериальной гипертензией.
Указанные клинические примеры хорошо отражают полученные нами результаты — все три пациента имели СР, причем в двух из трех случаев СР не ассоциировалась с поражением жизненно важных органов, но привела к длительному применению средних доз ГК, которые оказали не меньший негативный эффект в виде формирования осложнений и коморбидных состояний. Индекс СР хорошо ассоциировался с текущей клинической и лабораторной картиной и отражал потенциал к снижению дозы ГК. В двух из трех случаев удалось полностью отменить ГК. В одном из трех случаев при полирезистентной к лечению (включая цитостатики, ритуксимаб и белимумаб) кожно-суставной форме СКВ СР была преодолена путем назначения антиинтерфероновой терапии.
Обсуждение
Проведенное исследование является продолжением серии работ, посвященных клинико-лабораторным особенностям течения заболевания и коморбидных состояний у больных СКВ с высоким и низким риском СР. В отличие от проведенных ранее исследований, нами выделены факторы, ассоциирующиеся с повышением риска СР, к которым, помимо включенных в индекс СР показателей активности и иммунологического статуса пациенток, следует отнести возраст пациенток на момент расчета СР, текущее снижение уровня С3-компонента комплемента, высокую коморбидность и сердечно-сосудистый риск, бессимптомную ГУ, а также более низкую дозу ГК на момент постановки диагноза при более частом назначении гидроксихлорохина и белимумаба [2, 12, 13].
Пациентки с высоким риском СР были достоверно старше пациенток с низким риском СР при сопоставимой длительности заболевания, что указывает на то, что повышение возраста дебюта уменьшает вероятность достижения поддерживающей суточной дозы ГК. Роль возраста как фактора повышения риска СР, в том числе за счет включения интерферонового механизма действия, была ранее описана в работах Д.Б. Алиева и соавт. [1, 12–14]. Возможно, увеличение с возрастом сывороточного уровня интерферонов I типа изменяет профиль СКВ, определяя повышение риска СР в указанной когорте, одновременно уменьшая эффективность гидроксихлорохина и белимумаба как стероидсберегающих средств [13, 14]. Применение анифролумаба — моноклонального антитела к рецептору ИФН I типа, продемонстрировавшего выраженный стероидсберегаюший эффект по данным клинических исследований и исследования реальной клинической практики, возможно, сможет преодолеть СР у пациентов с СКВ [15–17].
В ходе настоящей работы установлено, что, несмотря на отсутствие значимых различий в структуре органных поражений, больные с высоким риском СР имели достоверно более высокую текущую активность СКВ, в том числе за счет более выраженных иммунологических нарушений. В настоящей работе мы установили, что пациентки с высоким риском формирования СР демонстрировали более выраженные иммунологические отклонения не только на момент расчета индекса СР, но и в момент постановки диагноза СКВ, то есть на момент начала лечения. Традиционно титр АНФ не используется в оценке активности СКВ [9]. Вместе с тем титр АНФ может изменяться с течением времени после постановки диагноза и отражать активность аутореактивных В-клеток, лежащую в основе патогенеза СКВ [18]. Тот факт, что пациентки с высоким риском СР, по нашим данным, имели большие значения титра АНФ и АТ к дсДНК не только на момент текущей оценки, но и на момент постановки диагноза, а также нарастающее снижение уровня С3 в дебюте заболевания у лиц со сформировавшейся в последующем СР, указывает на необходимость включения оценки титра АНФ как фактора, определяющего успех лечения СКВ как на момент постановки диагноза, так и в последующем. Уровень антител к дсДНК и компонентов системы комплемента уже входит в широко используемый индекс оценки активности СКВ SLEDAI-2K и коррелирует с активностью заболевания, используется как предиктор обострения [19]. Включение в подобную оценку титра АНФ является важным для персонализированного лечения пациентов. Особенностью нашего подхода является ранжирование титра АНФ на высокий (от 1:640) и низкий (1:320 и меньше), заложенного в расчет индекса СР. Указанный подход позволил нивелировать неспецифический характер повышения титра АНФ у ряда пациентов по причинам, не связанным с СКВ (инфекции и др.).
Важно, что пациентки с высоким риском СР имели больший индекс коморбидности Чарлсон, чем пациентки с низким риском СР. При СР отмечено повышение сердечно-сосудистого риска, более высокие показатели сывороточного креатинина и МК при сопоставимых показателях скорости клубочковой фильтрации и 24-часовой протеинурии. Уровень МК в дебюте заболевания у пациенток с срСКВ соответствовал уровню бессимптомной ГУ, тогда как на момент включения в исследование пациентки с наличием и отсутствием высокого риска СР имели средний уровень сывороточной МК в пределах референтных значений. По данным некоторых публикаций, ГУ влияет на течение и прогноз СКВ [1]. По нашим данным, наибольшую прогностическую ценность в отношении СР ГУ имеет на момент установки диагноза и начала лечения. Лучше всего роль ГУ при СКВ изучена с точки зрения ее вклада в патогенез и исходы волчаночного нефрита [20], являющегося одним из наиболее грозных проявлений СКВ, требующих активного лечения, предусматривающего исходно высокие дозы ГК. Известно также о влиянии ГУ и на нервную систему, серозные оболочки, сосуды [21–23]. В нашей работе впервые показана независимая от нефрита взаимосвязь между СР и ГУ, определяемая совокупным влиянием активности СКВ, иммунологического статуса и возраста дебюта СКВ на риск не достигнуть снижения дозы ГК до поддерживающей. Из коморбидных состояний при повышении риска СР значительно чаще, чем без риска СР, была зарегистрирована артериальная гипертензия при отсутствии различий в частоте встречаемости ИБС, сахарного диабета 2 типа и остеопороза. Обращает на себя внимание достоверно более частое выявление АВН среди пациенток с срСКВ, значительно снижающее качество жизни больных и приводящее к инвалидизации, что соответствует ранее полученным нами данным и публикациям мировой литературы [24–27]. В целом у больных СКВ и с высоким риском СР были выше значения индекса коморбидности Чарлсон и отмечено повышение риска сердечно-сосудистых катастроф QRISK3, учитывающего в качестве факторов риска прием ГК и наличие заболеваний соединительной ткани, что делает его предпочтительным для оценки пациентов с СКВ и СР [11].
Нельзя не отметить различия в лечении обследованных пациенток с СКВ. Обращает на себя внимание назначение меньших доз ГК в дебюте заболевания пациенткам с СКВ, у которых впоследствии сформировался высокий риск СР, что может объясняться недостаточным контролем над проявлениями болезни и недостижением низкой активности СКВ и, как следствие, несвоевременным снижением дозы ГК. Больший объем назначения болезнь-модифицирующих препаратов, таких как гидроксихлорохин и белимумаб, у пациенток с высоким риском СР, вероятно, требовался в связи с сохраняющейся активностью СКВ, а также может быть связан с недостаточным стероидсберегающим эффектом указанных препаратов у больных с показанной нами высокой исходной иммунологической и клинической активностью.
Абсолютно очевидно, что взаимосвязи между активностью СКВ, иммунологическим статусом пациента, ГУ, возрастом дебюта заболевания, сердечно-сосудистым риском, общей коморбидностью носят сложный многофакторный взаимно потенцирующий характер. А потому мы предлагаем учитывать активность СКВ как фактор, поддерживающий сердечно-сосудистую коморбидность, а коморбидность — как фактор, потенцирующий сохранение активности. При этом и активность СКВ, и коморбидность способствуют формированию повышенного риска СР, которая, в свою очередь, приводит к прогрессированию коморбидности. Из нашего исследования следует, что помимо традиционных способов оценки активности СКВ как прогностически неблагоприятные факторы следует учитывать поздний дебют болезни, повышенные титры АНФ и уровень АТ к дсДНК (как при постановке диагноза, так и на фоне лечения), снижение уровня С3-компонента комплемента, ГУ на любом этапе заболевания, артериальную гипертензию. АВН мы рассматриваем как следствие высокой активности и длительного приема ГК. При этом низкие дозы ГК и назначение монотерапии гидроксихлорохином в начале лечения ассоциируются с формированием СР в дальнейшем. Выявленные нами факторы, ассоциирующиеся с СР, довольно просто выявлять в рутинной клинической практике, в отличие от возможных маркеров СР, таких как гликопротеин P, фактор ингибирования миграции макрофагов, которые предлагали применять коллеги в ранее опубликованных работах [28]. Выявление прогностических маркеров и моделей, доступных к применению в реальной клинической практике, а также анализ модифицируемых факторов, влияющих на развитие СР, представляются перспективными для улучшения контроля над СКВ, снижения риска инвалидизации и экономического бремени на систему здравоохранения и повышения качества жизни пациентов.
Ограничениями настоящего исследования явились ретроспективный характер исследования и женская выборка пациентов. Планируется проспективное исследование с изучением особенностей СКВ и коморбидных состояний при ней в долгосрочной перспективе, а также изучение указанных особенностей при более редко встречающейся СКВ у мужчин.
Заключение
Женщины с СКВ и высоким риском СР по сравнению с пациентками с низким риском СР имели бóльшую продолжительность болезни, более поздний ее дебют и более высокую исходную иммунологическую активность СКВ при большей коморбидности, сердечно-сосудистом риске и ГУ. Несмотря на большую исходную иммунологическую активность, факторами риска развития СР могло быть то, что пациентки с срСКВ получали в начале лечения меньшие дозы ГК и чаще гидроксихлорохин и белимумаб в качестве единственного базисного препарата, а также повышение уровня интерферона с увеличением возраста пациенток с момента дебюта заболевания [29].
Сведения об авторах:
Мусийчук Мария Меджидовна — врач-ревматолог СПб ГБУЗ «КРБ им. В.А. Насоновой»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0009-0001-7694-4740
Гайдукова Екатерина Константиновна — студентка магистратуры Университета Сорбонны; 75006, Франция, г. Париж, ул. Медицинской школы, д. 21; ORCID iD 0000-0001-9025-1214
Алиев Дамир Бурганович — врач-ревматолог СПб ГБУЗ «КРБ им. В.А. Насоновой»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0001-8367-4622
Инамова Оксана Владимировна — к.м.н., главный врач СПб ГБУЗ «КРБ им. В.А. Насоновой»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; заместитель директора НИИ ревматологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, ассистент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-9126-3639
Муштренко Ксения Сергеевна — клинический ординатор по специальности «ревматология» кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0009-0003-8515-5297
Хасанова Альмира Артуровна— клинический ординатор по специальности «ревматология» кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0009-0007-4432-7362
Гайдукова Инна Зурабиевна — д.м.н., заместитель директора НИИ ревматологии, профессор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; СПб ГБУЗ «КРБ им. В.А. Насоновой»; 190068, Россия, г. Санкт-Петербург, ул. Большая Подьяческая, д. 30; ORCID iD 0000-0003-3500-7256
Контактная информация: Мусийчук Мария Меджидовна, e-mail: m.m.musiychuk@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.02.2025.
Поступила после рецензирования 06.03.2025.
Принята в печать 31.03.2025.
About the authors:
Maria M. Musiychuk — rheumatologist of the V.A. Nasonova Clinical Rheumatology Hospital; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0009-0001-7694-4740.
Ekaterina K. Gaydukova — Master Student, Sorbonne University; 21, Rue de l’École de Médecine, Paris, 75006, France; ORCID iD 0000-0001-9025-1214
Damir B. Aliev — rheumatologist of the V.A. Nasonova Clinical Rheumatology Hospital; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0000-0001-8367-4622
Oksana V. Inamova — C. Sc. (Med.), Chief Medical Officer of the V.A. Nasonova Clinical Rheumatology Hospital; 30, Bolshaya Podyacheskskaya str., St. Petersburg, 190068, Russian Federation; Deputy Director for Work with
Clinical Bases of the Research Institute of Rheumatology, I.I. Mechnikov North-Western State Medical University; Assistant Professor of the Department of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-9126-3639.
Kseniya S. Mushtrenko — Rheumatology Resident Doctor of the Department of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care named after E.E. Eichwald, North West State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0009-0003-8515-5297
Almira A. Khasanova — Rheumatology Resident Doctor of the Department of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care named after E.E. Eichwald, North West State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0009-0007-4432-7362
Inna Z. Gaydukova — Dr. Sc. (Med.), Deputy Director of the Research Institute of Rheumatology, Professor of the Department of Internal Medicine, Rheumatology, Examination of Temporary Disability Examination and Quality of Medical Care named after E.E. Eichwald, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; V.A. Nasonova Clinical Rheumatology Hospital; 30, Bolshaya Podyacheskaya str., St. Petersburg, 190068, Russian Federation; ORCID iD 0000-0003-3500-7256.
Contact information: Maria M. Musiychuk, e-mail: m.m.musiychuk@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.02.2025.
Revised 06.03.2025.
Accepted 31.03.2025.
Информация с rmj.ru






