Клинико-иммунологическая эффективность иммуномодуляторов топического и системного действия при хроническом простом бронхите
Е. И. Алтынбаева*, кандидат медицинских наук
С. Н. Теплова**, доктор медицинских наук, профессор
Г. Л. Игнатова***, доктор медицинских наук, профессор
О. В. Родионова***, кандидат медицинских наук
А. Н. Егоров*
*ФГУЗ ЦМСЧ-71 ФМБА, Поликлиника № 3, Озерск, Челябинская область
**ЧГМА, ***УГМАДО, Челябинск
Хроническая обструктивная болезнь легких (ХОБЛ) остается чрезвычайно распространенной болезнью, смертность от которой продолжает увеличиваться (Авдеев А. Н., 2007; Чучалин А. Г., 2010). Основной причиной развития заболевания является вдыхание раздражающих веществ и прежде всего курение (Calverley P. M. A., 2007; Визель А. А., 2009; Barnes Р. J., 2010). В основе развития патофизиологических изменений при ХОБЛ лежит хроническое воспаление в дыхательных путях, приводящее к деструктивным изменениям в легочной паренхиме, ремоделированию легочной ткани и развитию необратимой бронхиальной обструкции. Воспаление развивается по всей дыхательной трубке и обусловлено воздействием поллютанта на генетически восприимчивого человека (Buist A. S., 1996; Викторова Т. В., 2004; Shaker S. B. et al., 2005). Длительное и интенсивное курение при ХОБЛ воздействует в первую очередь на слизистую оболочку ротовой полости, омываемую слюной, на бронхолегочную систему организма и состояние мукозоассоциированной лимфоидной ткани (Barnes P. J., 2003, 2006). Слизистые оболочки верхних дыхательных путей являются входными воротами и постоянной областью персистенции различных микробных возбудителей. Пограничное положение слизистых мембран определяет их ведущую роль в антимикробном ответе организма, тип которого зависит от характера антигена и меняется под влиянием различных агентов внешней биологически агрессивной среды (Теплова С. Н., Алексеев Д. А., 2002).
Общепризнанно (GOLD 2006, 2007, Авдеев А. Н., Чучалин А. Г.) ведущее значение курения в развитии ХОБЛ и персистенции воспалительного процесса в бронхах в результате активации иммунных механизмов и усиления секреции эндогенных провоспалительных факторов (Суркова Е. А., Кузубова Н. А., Сесь Т. П., Тотолян Арег А., 2010). Успехи в развитии лабораторных высокотехнологичных методов исследований определяют возможность точного количественного анализа иммунных белков, продуцируемых на уровне мукозоассоциированной лимфоидной ткани в респираторном тракте, в слюнной жидкости, как в условиях нормы, так и при развитии патологии. Изучение иммунных показателей слюны представляет интерес в связи с неинвазивным взятием исследуемого материала и с непосредственным воздействием табачного дыма на слизистые оболочки ротовой полости, вызывающего изменения функциональной активности мукосаливарного барьера и мукозоассоциированной ткани данной индуктивной зоны мукозального иммунитета.
ХОБЛ — одна из ведущих причин заболеваемости и летальности. Основная причина смерти больных ХОБЛ — тяжелое обострение заболевания и/или острая дыхательная недостаточность. Вирусные инфекции бронхиального дерева являются самой частой причиной обострения ХОБЛ (Ball, 1995), хотя немалую роль играют и неинфекционные факторы (сердечная недостаточность, тромбоэмболии и др.).
Для практической пульмонологии является важным вопрос фармакологической профилактики обострений ХОБЛ и хронического простого бронхита (ХПБ) на ранних стадиях болезни. Не изучено влияние иммуномодуляторов различных типов действия у работающих на крупном радиохимическом предприятии для профилактики инфекционно-воспалительных респираторных эпизодов. Это стало предметом нашего изучения.
Проблема профилактики обострений у больных ХОБЛ на ранних стадиях болезни с целью замедления ее прогрессирования является чрезвычайно актуальной для лиц, работающих на промышленных предприятиях. Для ХОБЛ характерно медленное, но неуклонное прогрессирование бронхообструкции, приводящее к запоздалой диагностике заболевания и назначению лечения. Бессимптомное или стертое течение заболевания в первые 10–15 лет, когда терапия наиболее перспективна, диктует необходимость принципиально новых подходов к диагностике, лечению и разработке эффективной системы профилактики ХОБЛ. Данная проблема представляется особенно важной для пациентов, живущих и работающих в условиях экологической и производственной агрессии.
В современной литературе признается важная роль респираторных вирусов при обострениях ХОБЛ в холодный период года (Шмелев Е. И., 2007). В связи с этим нами для профилактики обострений у лиц с ХПБ и ранними формами ХОБЛ был выбран интраназальный спрей ИРС® 19. Выбор препарата был обусловлен данными литературы о высокой эффективности ИРС® 19 для профилактики сезонных обострений респираторных заболеваний (Земсков А. М., Караулов А. В., 1998). Его действие не изучено с точки зрения профилактики респираторных обострений у больных с ранними формами ХОБЛ, работающих в условиях радиохимического производства.
ИРС® 19 — смесь лизатов бактерий, иммунобиологический препарат, который повышает естественный иммунитет, усиливает факторы неспецифической противоинфекционной защиты: повышает фагоцитарную активность макрофагов, активность лизоцима, усиливает продукцию эндогенного интерферона. При распылении ИРС® 19 образуется мелкодисперсный аэрозоль, который покрывает слизистую оболочку носа, что приводит к быстрому развитию местного ответа со стороны слизистой оболочки и мукозоассоциированной лимфоидной ткани.
Целью исследования является оценка терапевтической эффективности и изменений некоторых показателей мукозального иммунитета при использовании иммуномодуляторов топического и системного действия у пациентов с ХПБ и ХОБЛ, работающих на радиохимическом производстве.
Материалы и методы
Настоящее исследование проводится с 2006 года и по настоящее время в отделении профилактики ФГУЗ ЦМСЧ-71 ФМБА России в рамках периодического медосмотра работников радиохимического производства ПО «Маяк». Под постоянным наблюдением в течение последних 10 лет находится контингент пациентов с ХОБЛ I и II стадий (144 человека, из них мужчин — 115, женщин — 29; средний возраст 50,87 ± 1,14 года) и ХПБ (264 человека, мужчин — 198, женщин — 66; средний возраст 49,67 ± 1,14 года). Из них в настоящее исследование путем рандомизации с помощью компьютерного генератора случайных чисел было включено и углубленно обследовано клинически, инструментально, лабораторно, иммунологически 49 (мужчин — 40, женщин — 9). В качестве контрольной группы было отобрано 27 здоровых человек того же возраста и пола, работающих в тех же условиях, не курящих, без признаков респираторной патологии (средний возраст — 48,58 ± 2,67 года) (рис. 1).
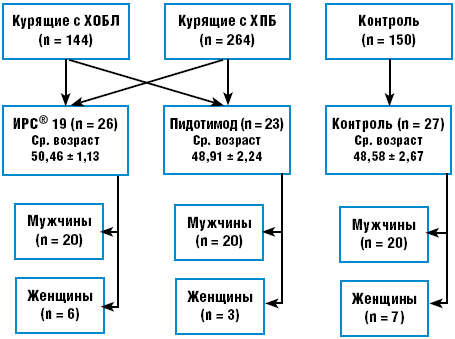
Рис. 1. Дизайн исследования фармакологической профилактики
Диагноз ХПБ устанавливался на основании Российского консенсуса по хроническому бронхиту (Шмелев Е. И., 1997; Лещенко И. В. и соавт., 2001). Диагноз ХОБЛ у работающих на радиохимическом предприятии устанавливался в соответствии со стандартами диагностики GOLD (2003), Федеральной программой «Хроническая обструктивная болезнь легких» (2004) и Стандартами по диагностике и лечению больных хронической обструктивной болезнью легких (2005) на основе определения спирографических показателей, которые являются «золотым» стандартом диагностики и мониторирования прогрессирования заболевания.
Основную группу для изучения воздействия ИРС® 19 составили 26 человек, средний возраст которых 50,46 ± 1,13 года; у всех обследованных индекс курильщика был выше 240. Пациенты получали препарат ИРС® 19, ежедневно впрыскивая по одной дозе в каждый носовой ход два раза в день (утром и вечером) в течение 1 месяца в весенний период.
Основную группу для исследования действия Имунорикса (пидотимода) для сезонной профилактики острых респираторных инфекций составили курильщики с ХПБ и ХОБЛ I и II стадий вне обострения — 23 человека, средний возраст которых составил 50,46 ± 1,13 года; среди них было 20 мужчин (80%) и 3 женщины (20%); у всех обследованных индекс курильщика был выше 240. Режим профилактического назначения препарата Имунорикс (пидотимод) был следующий: в дозе 800 мг (2 флакона) 1 раз в сутки вне приема пищи в течение 14 дней в осенний сезон года с последующим диспансерным наблюдением в течение 6 месяцев с целью контроля эффективности терапии.
Исследованы уровни цитокинов (ИЛ-8, ИЛ-17, ИФН-гамма), аларминов (ИЛ-1 бета, лактоферрина) в слюне, а также IgG2 до и после профилактического назначения иммуномодуляторов в отделении профилактики в период ремиссии. Уровни иммунных белков в слюне определяли с помощью иммуноферментного метода с использованием тест-систем для исследования биологических жидкостей производства Bender MedSystem, Австрия. Количественную оценку ИФН-гамма, ИЛ-1 бета и лактоферрина, IgG2, IL-8 в слюне проводили при помощи наборов для определения уровня этих пептидов в сыворотке крови и других биологических жидкостях (слюне, сперме, спинномозговой жидкости) российского производства. Результаты регистрировали на планшетном спектрофотометре Multiscan Plus (Labsystems) при длине волны 450 нм.
Статистическая обработка проводилась с использованием пакета программ Statistica, версия 6. Межгрупповые сравнения проводились согласно тестам Манна–Уитни и Колмогорова–Смирнова. Различия считались достоверными при p < 0,05.
Результаты и обсуждение
Нами проведен анализ частоты обострений заболевания до и после приема ИРС® 19 (табл. 1). В контрольной группе, не получавшей ИРС® 19, а также в основной группе до лечения число обострений составляло в среднем 3 случая. После проведенного цикла назначения ИРС® 19 число обострений снизилось в полтора раза в течение полугодового наблюдения, в то время как в контрольной группе число респираторных эпизодов осталось на прежнем уровне. По мнению Шмелева Е. И. (2006), применение ИРС® 19 у боль ных ХОБЛ в стабильном состоянии представляется перспективным, т. к. наряду с профилактикой обострений ИРС® 19 обладает способностью ограничивать колонизацию слизистых оболочек респираторного тракта микроорганизмами, что с учетом обсуждавшихся патогенетических связей может влиять на прогрессирование основного заболевания.

В клинической картине после применения препарата ИРС® 19 одышка, кашель, сухие хрипы при аускультации существенно не изменились. Достоверных изменений спирометрических показателей также не установлено.
В соответствии с рекомендациями экспертов Европейского респираторного общества, целями профилактики ХОБЛ являются: облегчение симптомов заболевания, улучшение функции легких, повышение переносимости физической нагрузки, улучшение общего состояния здоровья, предотвращение и эффективная терапия обострений, предотвращение прогрессирования заболевания, снижение смертности (Wijkstra P. J., Jones P. W., 1997).
Далее нами проанализированы спирометрические показатели через 1 месяц после проведения фармакологической профилактики препаратом ИРС® 19. Полученные данные приведены в табл. 2.

Как видно из табл. 3, динамика спирометрических показателей в группе принимавших препарат фармакологической профилактики ИРС® 19 сопровождалась тенденцией к повышению последних.

После проведенного цикла профилактического лечения с помощью препарата ИРС® 19 у пациентов с ХПБ и ХОБЛ показатели адаптивного и врожденного иммунитета на уровне мукозального компартмента иммунной системы, свидетельствующие о выраженном нарушении иммунного гомеостаза, снизились и приблизились к значениям здоровых лиц. Уровень в слюне провоспалительного цитокина ИЛ-8 (77,2 к 12,3 пкг/мл при р = 0,002) упал, что представляет наибольший интерес, т. к. отражает падение уровня эндогенного провоспалительного хемокина в верхних дыхательных путях. Данный цитокин секретируется преимущественно активированными эпителиоцитами и макрофагами, и повышение его уровня в секретах может свидетельствовать о хронизации воспалительного процесса (Yamamoto C. et al., 1997) (рис. 2.).
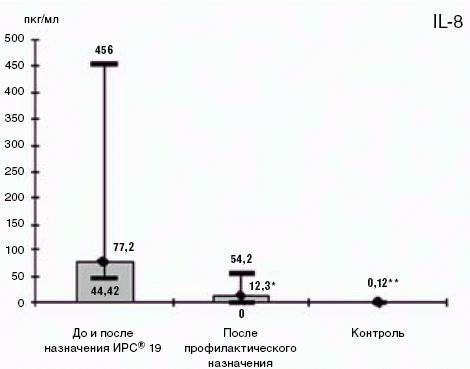
Рис. 2 Показатель секреторного иммунитета ИЛ-8 пкг/мл
Особый интерес представляет изучение уровня эндогенных сигналов повреждения. Так, после профилактического назначения ИРС® 19 снизился уровень лактоферрина (1366 к 523,5 нг/мл при р = 0,004). В свете имеющихся данных литературы, лактоферрин рассматривается в настоящее время не только как микробоцидный фактор биологических жидкостей, но и как эндогенный маркер повреждения, который некоторые авторы относят к аларминам — молекулам, сигнализирующим о повреждении клеток организма (de la Rosa, Yang D., Tewary P., Varadhachary A., Opptenheim J. J., 2008).
Также было установлено, что достоверно увеличилось количество иммуноглобулинов субкласса IgG2, относящихся к противомикробным иммуноглобулинам вторичного иммунного ответа (1,2 к 1,09 мкг/мл при р = 0,03). При корреляционном анализе была выявлена прямая сильная связь между индексом курения (ИК) и субклассом IgG2 в слюне (r = 0,7 при р = 0,03), т. е. чем выше интенсивность курения, тем выше транссудация белка из кровотока (Nadel R., 2005) (рис. 3).
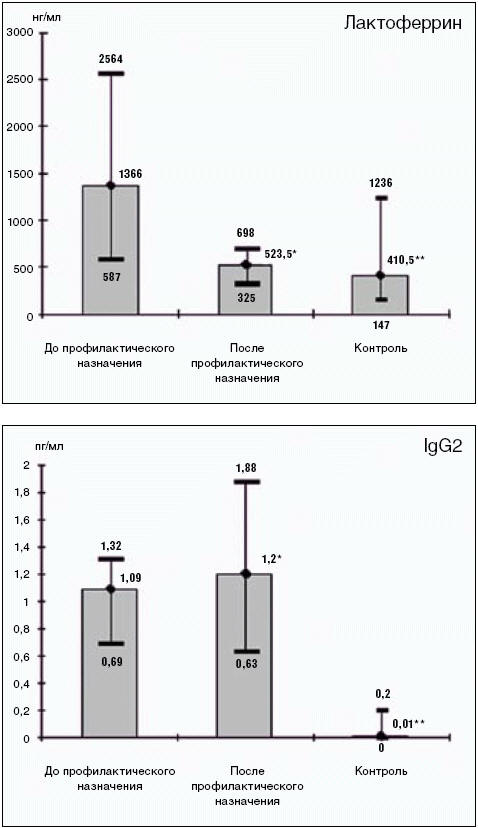
Рис. 3. Показатели секреторного иммунитета (Лактоферрин нг/мл, IgG2 мкг/мл) до и после назначения ИРС® 19
В следующем фрагменте работы нами проанализирована клиническая и иммунологическая эффективность системного иммуномодулятора Имунорикс (пидотимод) у пациентов с ХПБ и ХОБЛ, работающих на радиохимическом производстве.
При анализе клинической эффективности применения системного иммуномодулятора Имунорикс (пидотимод) у больных хроническим бронхитом и ХОБЛ в течение 6 месяцев эпизодов обострения заболевания отмечено не было. В контрольной группе число респираторных эпизодов осталось прежним (табл. 3). Отмечалось улучшение самочувствия пациентов, тенденция к уменьшению кашля, но достоверных различий спирограммы до и после приема препарата не выявлено.
Одним из основных факторов иммунного ответа, действующего в очаге воспаления, являются Т-хелперы (Harrington L. E., Hatton R. D., Mangan P. R., 2005). Различают Т-хелперы 1-го, 2-го и 17-го типов (Th1, Th2 и Th17), а также фолликулярные Т-хелперные клетки. При сопоставлении показателей секреторного иммунитета слюны у пациентов с хроническим простым бронхитом и ХОБЛ после цикла профилактики препаратом Имунорикс (пидотимод) в сравнении с группой, не получавшей фармакологических препаратов, было установлено повышение уровня ИЛ-17, т. е. активации секреторной функции одной из субпопуляций CD3+CD4+ лимфоцитов, а именно Т-хелперов-17. Данные популяции лимфоцитов имеют принципиальное значение в защите организма от внеклеточных патогенов в результате продукции ИЛ-17 (Ley K., Smith E., Stark M. A, 2006; Aujla S. J., 2007), который приводит к активации секреторной функции эпителиоцитов, усилению ими продукции хемокинов, способствующих эмиграции корпускулированного ингалируемого материала из верхних дыхательных путей (рис. 4).
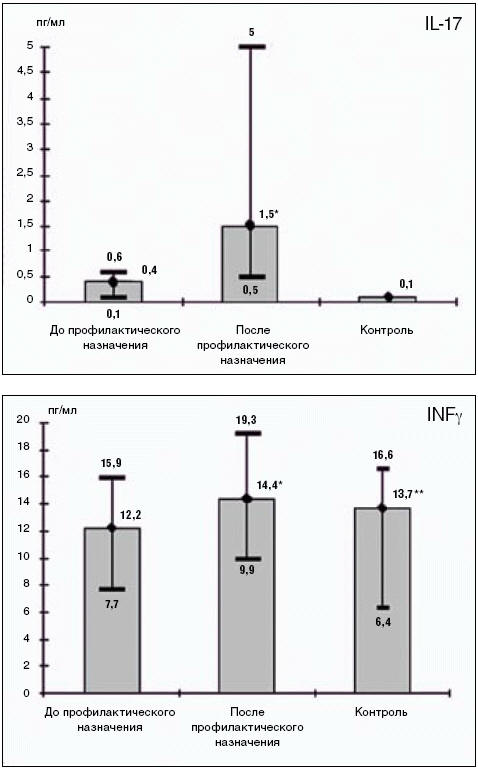
Рис. 4. Показатели секреторного иммунитета (ИЛ-17, ИФН-гамма)
Отмечено достоверное увеличение содержания в слюне провоспалительного цитокина ИФН-гамма — продукта активации Th1-типа, способного оказывать противовирусный эффект, ингибируя вирусную репликацию, а также активировать макрофаги, запуская их микробоцидные механизмы, тем самым отражая более высокую активность Т-хелперов-1, что может объяснить отсутствие респираторно-вирусных эпизодов у пациентов, принимавших пидотимод в профилактических целях.
Обнаруженные изменения можно расценивать как нарушение соотношения Th1- и Th2-лимфоцитов, они также могут являться патогенетическим признаком дисфункции иммунной системы при ХОБЛ, т. к. нормальная работа иммунной системы строится на балансе звеньев Th1 и Th2, основанном на равноценной продукции ими регуляторных цитокинов.
Проведенными исследованиями показана клиническая и иммунологическая эффективность применения фармакологических методов профилактики катаральных обострений препаратами ИРС® 19 и Имунорикс (пидотимод) у пациентов с хроническим простым бронхитом и ранними формами ХОБЛ, работающих на радиохимическом производстве. Дальнейшее изучение действия различных иммуномодуляторов на частоту катаральных обострений хронической обструктивной болезни легких может обосновать патогенетическую терапию заболевания.
Литература
- Хронические обструктивные болезни легких: Федеральная программа Министерства здравоохранения Российской Федерации Всероссийского научного общества пульмонологов. М., 2004. 73 с.
- Хроническая обструктивная болезнь легких. Федеральная программа РФ: Практическое руководство для врачей. 2-е изд. перераб. и доп. / Под. ред. А. Г. Чучалина. M., 2004. 61 с.
- Хроническая обструктивная болезнь легких / Под. ред. А. Г. Чучалина. М.: Атмосфера, 2003. С. 7–18.
- Чучалин А. Г., Арион В. Я., Евсеев Н. Г. и др. Иммунокоррекция в пульмонологии. М., 1989. 256 с.
- Шмелев Е. И. Воспаление — ключевой элемент прогрессирования хронической обструктивной болезни легких // Consilium medicum. 2003. Т. 3, № 3. С. 655–657.
- Шмелев Е. И. Хроническая обструктивная болезнь легких и сопутствующие заболевания // Пульмонология. 2007. № 2. С. 5–9.
- Авдеев С. Н. Хроническая обструктивная болезнь легких как системное заболевание // Пульмонология. 2007. № 2. С. 27–30.
- Суркова Е. А., Кузубова Н. А., Сесь Т. П., Тотолян Арег А. Особенности цитокиновой регуляции очагового и системного воспаления при ХОБЛ // Медицинская иммунология. 2010. Т. 12, № 4–5, с. 340–354.
- Визель А. А., Визель И. Ю. Хроническая обструктивная болезнь легких: воспаление как ключевая проблема // Практическая медицина. 2009. № 3 (35). С. 22–24.
- Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких / Пер. с англ. под ред. Чучалина А. Г. М.: Атмосфера, 2003. 96 с.
- Теплова С. Н., Алексеев Д. А. Секреторный иммунитет. Челябинск, 2002. 200 с.
- Barnes P. J. ABC of chronic pulmonary disease. Future treatments//BMJ, 2006. Vol. 333. P. 246–248.
- Barnes P. J. Chronic obstructive pulmonary disease: New treatments for COPD // Thorax. 2003. Vol. 58, № 9. P. 803–808.
- Ball P. Epidemiology and treatment of chronic bronchitis and its exacerbations // Chest. 1995; 108: 43 S52 S.
- Calverley P. M. A. Respiratory failure in chronic obstructive pulmonary disease // Eur. Respir. J. 2003. Vol. 22 P. 26 S–30 s.
- Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. NHLBI/WHO workshop report/Bethesda, National Heart, Lung and Blood Institute. NIH Publication № 2701. April 2001. 100 p.
- Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease/Executive summary//Bethesda, National Heart, Lung and Blood Institute. 2003. www.goldcopd.com [электронная публикация].
- Global Initiative for Chronic Obstructive Lung Disease (GOLD)/Workshop Report. 2005. www.goldcopd.com [электронная публикация].
- Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease / Executive Summary 2006. Medical Communications Resources, Inc. 2006. P. 1–32.
- Yamamoto C., Yoneda T., Yoshikawa M., Fu A., Tokuyama T., Tsukaguchi K. et al. Airway inflammation in COPD assessed by sputum levels of interleukin-8 // Chest. 1997. Vol. 112. P. 505–510.
- Ley K., Smith E., Stark M. A. IL-17 A-producing neutrophil-regulatory Th lymphocytes // Immunol Res. 2006. Vol. 34, № 3. Р. 229–242.
- Aujla S. J., Dubin P. J., Kolls J. K. Th17 cells and mucosal host defense // Semin Immunol. 2007. № 19. Р. 362–371.
- Harrington L. E., Hatton R. D., Mangan P. R., Turner H., Murphy T. L., Murphy K. M., Weaver C. T. Interleukin-17 producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages // Nat Immunol. 2005. Vol. 6, № 11. P. 1123–1132.
- Weaver C. T., Harrington L. E., Mangan P. R., Gavrieli M., Murphy K. M. Th17: an effector CD4 T cell lineage with regulatory T cell ties // Immunity. 2006. Vol. 24, № 6. P. 677–688.
- Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and prevention of COPD. NHLBI/WHO workshop report/Bethesda, National Heart, Lung and Blood Institute. 2008. www.goldcopd.com.
- Викторова Т. В., Корытина Г. Ф., Янбаева Д. Г. Поиск генетических маркеров ХОБЛ (на примере генной сети ферментов биотрансформации ксенобиотиков) / Тезисы 14 Национального конгресса по болезням органов дыхания. М., 2004. С. 345.
- Buist A. S. Risk factors for COPD//Eur. Resp. Rev. 1996. Vol. 6, № 39. P. 253–258.
- Shaker S. B., Maltbaek N., Brand P. et al. Quantitative computed tomography and aerosol morphometry in COPD and α1-antitrypsin deficiency // Eur. Respir. J. 2005. Vol. 25. P. 23–30.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







