Клиническое значение сосудистого эндотелиального фактора роста у больных с синдромом поликистозных яичников
Е. И. Манухина, кандидат медицинских наук, доцент
М. А. Геворкян, доктор медицинских наук, профессор
И. Б. Манухин, доктор медицинских наук, профессор
Л. Б. Студеная, кандидат медицинских наук, доцент
МГМСУ, Москва
Несмотря на многочисленные исследования, патогенез синдрома поликистозных яичников (СПКЯ) до настоящего времени до конца не изучен. Частота СПКЯ составляет примерно 11–16% среди женщин репродуктивного возраста, а в структуре ановуляторного бесплодия доходит до 75–80% [1, 12]. Длительно существующие в клинической практике критерии диагностики синдрома поликистозных яичников (олигоменорея, гирсутизм, ожирение и увеличенные яичники), в настоящее время выявляются только у 65–70% пациенток [7, 9]. Большинство исследователей приняли критерии диагностики СПКЯ, предложенные на Ротердамской конференции: хроническая ановуляция, гиперандрогения, эхографические признаки поликистозных яичников (ПКЯ). Наличие двух из трех вышеперечисленных критериев позволяет верифицировать диагноз: «Синдром поликистозных яичников».
В последние годы повысилось число пациенток, резистентных к кломифену, который с 60-х годов прошлого столетия и до настоящего времени является первым этапом в индукции овуляции у больных с СПКЯ. Применение в схемах стимуляции овуляции гонадотропинов, несмотря на появление рекомбинантных форм, сопровождается высоким риском развития синдрома гиперстимуляции яичников (СГЯ). В последние годы возрос интерес к поиску маркеров прогнозирования СГЯ, чтобы выбрать щадящий метод стимуляции овуляции у данной группы пациенток [1, 2].
В настоящее время активно изучается роль ангиогенеза и множества других цитокинов в патофизиологии не только СПКЯ, но и СГЯ. По мнению ряда авторов, в основе патогенеза многих заболеваний лежит дисбаланс между факторами, регулирующими процессы пролиферации клеток и ангиогенеза [4]. Среди этих факторов — сосудистого эндотелиального фактора роста (СЭФР), который продуцируется в основном клетками эндотелия, является медиатором неоангиогенеза, играет важную роль в фолликулогенезе и развитии СГЯ. Результаты ряда клинических исследований свидетельствуют о том, что изучение роли СЭФР при СПКЯ следует считать актуальным и перспективным с клинической и научно-исследовательской точки зрения [5, 6].
Целью настоящего исследования явилось изучение содержания СЭФР в сыворотке крови больных с различными формами синдрома поликистозных яичников и определить его клиническое значение.
Материалы и методы
Обследовано 246 пациенток с СПКЯ (средний возраст 27,7 ± 1,4 года) с нарушениями генеративной функции. Критериями включения пациенток в исследование были: ановуляция или редкие овуляции по типу синдрома лютеинизации неовулированного фолликула (СЛНФ), бесплодие I, клинические и/или биохимические проявления гиперандрогении, эхографические признаки ПКЯ. Критерии исключения: метаболический синдром, гиперпролактинемия, болезнь Кушинга. Все пациентки были разделены на две группы с учетом клинико-морфологического типа поликистозных яичников.
I группу составили 119 пациенток с диффузным расположением фолликулов, II — 127 пациенток с периферическим расположением фолликулов по отношению к гиперплазированной строме. III группу — контрольную — составили 30 практически здоровых женщин (средний возраст 25,9 ± 1,7 года).
В ходе работы проводились клинико-лабораторные, инструментальные методы исследования.
Концентрацию СЭФР в сыворотке обследованных больных определяли иммуноферментным методом набором коммерческих реактивов фирмы R&D (США) и измеряли в пг/мл.
На 2–3 день самостоятельной или индуцированной гестагенами менструации всем пациенткам проводили трансвагинальное ультразвуковое исследование яичников с допплерометрией внутрияичникового кровотока на аппарате Sonoline Sienna (Siemens, Германия) с использованием трансвагинального датчика с частотой 6,5 МГц в режимах сканирования в двухмерной серой шкале (B-mode), цветового допплеровского картирования (C-mode).
Проводили радиоиммунологическое исследование гормонов в сыворотке крови (лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), общего тестостерона, эстрадиола, пролактина, инсулина, дегидроэпиандростерон-сульфата (ДГЭА-С), кортизола) иммунохемилюминисцентным методом на автоматическом анализаторе ACS 180. Инсулинорезистентность (ИР) определяли по индексу HOMA, для вычисления которого базальные концентрации глюкозы и инсулина перемножаются и делятся на 22,5. Если полученные показатели составляют более 2,5 — это соответствует ИР.
Статистический анализ полученных результатов исследования проводили на персональном компьютере с использованием пакета программ обработки данных медицинского исследования. Достоверность отличий в группах определяли по t-критерию Стъюдента. Отличия считали достоверными при значениях р < 0,05.
Результаты и обсуждение
Основными причинами, побудившими пациенток обратиться в клинику, были бесплодие и нарушение менструального цикла. Кроме того, они жаловались на избыточное оволосение и угревую сыпь, а также ожирение, которое составило 51% от общего числа больных.
У пациенток с СПКЯ показатели СЭФР оказались достоверно выше, чем в группе практически здоровых женщин: 193,1 ± 27,1 и 92,5 ± 27,9 пг/мл соответственно (табл. 1).
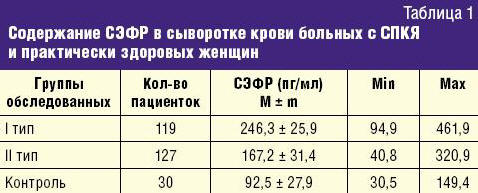
В I группе исследуемых пациенток с диффузным расположением фолликулов уровни СЭФР изменялись в широких пределах от 94,9 до 461,9 пг/мл, составляя в среднем 246,3 ± 25,9 пг/мл. Во II группе пациенток с периферическим расположением фолликулов по отношению к гиперплазированной строме уровни СЭФР варьировали от 40,8 до 320,9 пг/мл, в среднем — 167,2 ± 31,4 пг/мл. В группе контроля результаты исследования составили в среднем 92,5 ± 27,9 пг/мл (от 30,5 до 149,4 пг/мл).
Таким образом, было выявлено, что максимальный уровень СЭФР в сыворотке крови отмечался у пациенток с I типом ПКЯ, что достоверно отличается от показателей СЭФР у пациенток со II типом ПКЯ и здоровых женщин. Полученные данные согласуются с проведенными ранее исследованиями, в которых также получены достоверно более высокие концентрации СЭФР в крови больных с СПКЯ по сравнению со здоровыми женщинами [5, 8].
Для изучения взаимосвязи между содержанием СЭФР в сыворотке крови исследуемых пациенток и различными эхографическим показателями были выбраны наиболее значимые для ПКЯ критерии: объем яичников, количество антральных фолликулов и пиковая систолическая скорость (ПСС) кровотока в стромальных артериях яичников, так же полагают и другие авторы [3, 10, 11]. Было выявлено, что содержание СЭФР в сыворотке крови у пациенток с СПКЯ увеличивалось прямо пропорционально увеличению объема яичников (независимо от типа ПКЯ) (табл. 2)
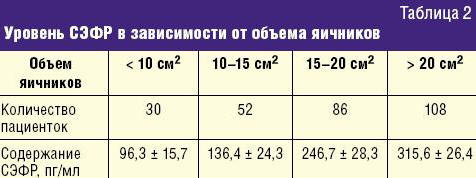
и количеству фолликулов (табл. 3).

Отмечена также положительная корреляционная зависимость между ПСС кровотока и уровнем СЭФР (табл. 4),

что согласуется с результатами исследования других авторов [5, 8].
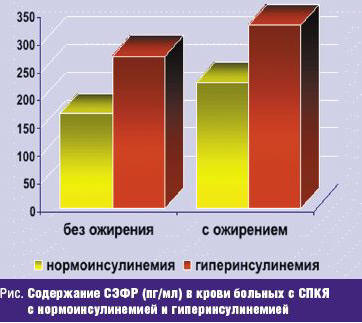
У больных с инсулинорезистентностью содержание СЭФР в сыворотке крови достоверно выше аналогичного показателя женщин контрольной группы (рис.). Кроме того, выявлена тенденция к повышению его уровня у пациенток с ожирением (среднее значение СЭФР 329,2 ± 26,1 пг/мл).
Изучение показателей СЭФР в зависимости от базальных концентраций в крови гонадотропных гормонов выявило, что повышение его уровня положительно коррелировало (r = 0,21) с увеличением содержания ЛГ в сыворотке крови и не зависело от типа ПКЯ (при уровне ЛГ > 18 МЕ/л — 229,6 ± 17,8 пг/мл, а при уровне ЛГ < 18 МЕ/л — 109,4 ± 15,7 пг/мл). В работе Anasti J. N. получены такие же результаты [6]. По данным Назаренко Т. А. высокие концентрации ЛГ (более 15 МЕ/л) свидетельствуют о риске развития СГЯ, на что указывают и результаты настоящего исследования. В то же время Agrawal R. и соавт. в своих исследованиях не обнаружили корреляционной зависимости между повышенными уровнями СЭФР и гормонами крови [5]. Зависимости между концентрациями СЭФР, общего тестостерона, эстрадиола и других стероидов не выявлено.
В заключение можно сказать, что повышенная васкуляризация поликистозных яичников лежит в основе усиленного кровотока, как показали результаты допплеровского картирования, и связана с высоким уровнем СЭФР в сыворотке крови пациенток с СПКЯ. Наличие взаимосвязи СЭФР с уровнем ЛГ, инсулинорезистентностью, пиковой систолической скоростью, объемом яичников, количеством антральных фолликулов свидетельствует о важной роли сосудистого эндотелиального фактора роста в патофизиологии СПКЯ и может указывать на риск развития СГЯ.
Выводы
- Содержание СЭФР в крови пациенток с СПКЯ достоверно выше, чем у практически здоровых женщин репродуктивного возраста. При I типе ПКЯ (с диффузным расположением фолликулов) концентрация СЭФР достоверно выше по сравнению со II типом (периферической локализацией фолликулов).
- Высокие уровни СЭФР в сыворотке крови у пациенток с ПКЯ положительно коррелировали с пиковой систолической скоростью кровотока, объемом яичников и количеством фолликулов.
- Пациенток с СПКЯ и уровнями ЛГ > 18 МЕ/л, а также гиперинсулинемией и высоким содержанием в крови СЭФР следует относить к группе риска развития синдрома гиперстимуляции яичников, что в свою очередь указывает на необходимость дифференцированного подхода к выбору метода стимуляции овуляции, с целью профилактики развития синдрома гиперстимуляции яичников.
Литература
- Манухин И. Б., Тумилович Л. Г., Геворкян М. А. Клинические лекции по гинекологической эндокринологии. М.: ГЭОТАР-Медиа, 2006. 320 с.
- Назаренко Т. А. Синдром поликистозных яичников: современные подходы к диагностике и лечению бесплодия. М.: МЕД пресс-информ, 2005. 208 с.
- Смирнова А. А. Прогнозирование исхода индукции овуляции у пациенток с синдромом поликистозных яичников: Автореф. канд. мед. наук. М., 2004. 21 с.
- Чеботникова Т. В., Холодова Ж. Л. Синдром поликистозных яичников. М., 2008. С. 3–27.
- Agrawal R., Sladkevicius P., Engrmann L. et al. Vascular endothelial growth factor concentrations and ovarian stromal blood flow are increased in women with polycystic ovaries // Hum. Reprod. 1998. № 10. P. 651–655.
- Anasti J. N., Kalantaridou S. N., Kimzey L. M. et al. Human follicle fluid vascular endothelial growth factor concentrations are correlated with luteinization in spontaneously developing follicles // Hum. Reprod. 1998. Vol. 13. P. 1144–1147.
- Balen A. H., Mac Dougall J., Jacobs H. S. Polycystic ovaries and their relevance to assisted concepction // A textbook of in vitro fertilization and assisted reproduction. 1999. P. 109–130.
- Battaglia C., Artini P. G., Genazzani A. D. Color Doppler analysis in lean and obese women with polycystic ovary syndrome // Ultrasound Obstet. Gynecol. 1996. Vol. 7. P. 342–346.
- De Leo V., la Marca A., Ditto A. et al. Effects of metformin on gonadotropin-induced ovulation in women with polycystic ovary syndrome // Fertil. Steril. 1999. Vol. 72. № 2. P. 282–285.
- Fulghesu A. M., Ciampelli M., Belosi C. et al. A new ultrasound criterion for the diagnosis of polycystic ovarian syndrome: the ovarian stroma/total area ratio // Fertil. Steril. 2001. Vol. 76. № 2. P. 326–331.
- Homburg R. Diagnosis and management of polycystic ovary syndrome // Springer US. 2009. P. 238.
- Lobo R А. What is new in the area of androgen excess // Fertil Steril. 2007. № 13. P. 127–133.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru






