Клинические возможности комплексного подхода в лечении рецидива хронической боли в коленных суставах у пациентов с коморбидными заболеваниями
Актуальность проблемы
Важной тенденцией клинической медицины в XXI в. стала глобальная распространенность коморбидной патологии. Результаты масштабного исследования были опубликованы в журнале The Lancet в 2015 г. Группа ученых во главе с Тео Вос из университета Вашингтона (Сиэтл) для исследования глобального уровня заболеваний в мире проанализировала источники информации о проблемах здоровья за 1990–2013 гг. Полученные данные продемонстрировали значительное увеличение доли коморбидных больных, а также увеличение количества заболеваний, приходящихся на одного больного (индекса коморбидности). Каждый третий человек страдает пятью заболеваниями и более. Причем чем старше человек, тем индекс коморбидности выше, а чем выше индекс коморбидности, тем хуже прогноз. Так, при 3–4 хронических заболеваниях риск смерти составляет 25%, а при 5 и более — 80%.
Сегодня коморбидность не может рассматриваться только как некая суммация нозологических единиц. Множество патофизиологических процессов, одновременно протекающих в организме, обусловливает развитие определенного набора заболеваний, которые взаимно отягощают друг друга, что приводит к снижению качества жизни либо к ее сокращению. Подобный подход отражен в обзоре R. Yancik (рис. 1) [1].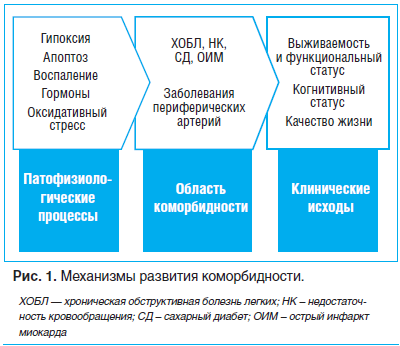
Такой взгляд на развитие коморбидности позволяет объяснить столь частое и типичное сочетание некоторых заболеваний, например кардиоваскулярных болезней и болезней костно-суставной системы, в частности остеоартрита (ОА). Так, исследование, проведенное в Южной Корее, показало, что распространенность ОА коленного сустава у пациентов с артериальной гипертензией (АГ) была значительно выше, чем у пациентов без АГ (ОШ=1,26, 95% ДИ 1,08–1,48). Такая же закономерность прослеживалась и у пациентов с сахарным диабетом (СД) 2 типа (ОШ=1,19, 95% ДИ 1,00–1,41) [2].
Центральным патогенетическим звеном в развитии и прогрессировании как ОА, так и кардиоваскулярных заболеваний является системное воспаление. В ответ на эндотелиальную дисфункцию, нестабильность атеросклеротических бляшек, гипергликемию, повышение артериального давления (АД) происходит избыточный синтез провоспалительных цитокинов. Провоспалительные цитокины активируют рецепторы на хондроците, что, в свою очередь, приводит к синтезу металлопротеиназ, ИЛ-1, 6, 8, ФНО-a, молекул оксида азота и в итоге — к деградации хряща, апоптозу хондроцитов и новому синтезу провоспалительных медиаторов. Исследователи M.Y. Lee et al. выделили трансмембранный белок Z39Ig из атеросклеротической бляшки сонной артерии, а также синовиальной жидкости сустава у пациентов с ОА, что также подтверждает единство механизмов повреждений [3]. Было показано, что у пациентов с СД 2 типа хондроциты при гипергликемии не способны регулировать перенос глюкозы глюкозным транспортером типа 1 (GLUT-1). Нарушение регуляции GLUT-1, в свою очередь, ведет к дегенерации хондроцитов, тем самым ускоряя прогрессирование ОА у пациентов с СД 2 типа [4].
Кроме того, синовиальная оболочка способна депонировать липопротеины низкой плотности, так же как и эндотелий сосудов, что инициирует развитие воспаления и боли — значимого клинического симптома, который, с одной стороны, выполняет защитную функцию, свидетельствуя о неблагополучии. С другой стороны, при длительном сохранении боли защитный механизм переходит в патологический процесс.
Боль — особенно неблагоприятный фактор для коморбидных пациентов с сердечно-сосудистыми заболеваниями (ССЗ). Известно, что хроническая боль активирует симпатоадреналовые реакции. Клинически это проявляется увеличением частоты сердечных сокращений, повышением АД. Если лечение болевого синдрома не будет адекватным и своевременным, то возрастет риск развития кардиоваскулярных осложнений. Данные, опубликованные в Европейском журнале сердца, демонстрируют увеличение рисков развития инфаркта миокарда с ОШ 3,09, 95% ДИ (2,69–3,54); инсульта 2,47 (2,22–2,75); хронической сердечной недостаточности (ХСН) 2,40 (2,06–2,79) и кардиоваскулярной летальности 1,71 (1,49–1,98) у пациентов с ОА [5].
Безусловно, при обсуждении купирования боли в суставах препаратами выбора являются нестероидные противовоспалительные препараты (НПВП). Однако в лечении болевого синдрома у коморбдных пациентов с ССЗ не все так однозначно, и прежде всего потому, что все НПВП за счет своего действия на ЦОГ-1 и ЦОГ-2 опосредованно изменяют соотношение антитромбогенных и протромбогенных факторов в сторону увеличения последних, тем самым повышая кардиоваскулярный риск. Например, риск сердечно-сосудистых осложнений составляет 1,09 (1,02–1,16) для напроксена, 1,17 (1,08–1,27) для целекоксиба, 1,2 (1,07–1,33) для мелоксикама и 2,05 (1,45–2,88) для эторикоксиба [6]. Еще больше кардиоваскулярный риск возрастает при совместном приеме НПВП и антиагрегантов или антикоагулянтов. Так, при добавлении НПВП к ацетилсалициловой кислоте риск сердечно-сосудистых осложнений возрастает на 46%, к клопидогрелю — на 75%. Наиболее высокий риск отмечен при применении комбинации оральных антикоагулянтов (ОАК) и диклофенака. На сегодняшний день применение ОАК, двойной или тройной антиагрегантной терапии, а также анамнестические данные о перенесенном ранее оперативном вмешательстве на крупных артериях являются противопоказаниями к применению НПВП. С другой стороны, хорошо известна гастро-, гепато- и нефротоксичность НПВП. Все это крайне сужает возможности применения НПВП у пациентов с ОА и коморбидными ССЗ.
Возникает вопрос: как лечить рецидив болевого синдрома при ОА у коморбидного пациента? Европейские, американские и российские рекомендации единогласно говорят о необходимости использования немедикаментозных методов, включающих аэробику, упражнения на растяжку, бальнеотерапию, лечебную ходьбу. При этом разные коллективы ученых показали, что аэробика имеет более высокий эффект обезболивания по сравнению с НПВП (0,67 и 0,29 соответственно) [7]. Показательны данные Кохрейновских систематических обзоров 2015 г.: уменьшение болевого синдрома по сравнению с исходным уровнем составляет 10% при медикаментозной терапии, тогда как на фоне лечебной физкультуры — 12% [8]. Этот эффект имеет патогенетическое обоснование. Как известно, суставной хрящ в своем строении лишен кровеносных сосудов, и весь метаболизм осуществляется посредством циркулирующей синовиальной жидкости. Чем активнее сустав, тем лучше циркуляция жидкости, а значит, и метаболизм в хряще. Таким образом, поступление питательных веществ и лекарственных препаратов в хрящевую ткань прямо пропорционально объему двигательной активности суставов, достигаемой ходьбой в объеме не менее 10 тыс. шагов в день и регулярными физическими упражнениями.
Еще одну интервенцию, которую надо обсуждать при ОА, особенно у пациентов, имеющих противопоказания к НПВП, — это назначение симптоматических медленно действующих препаратов. M.C. Hochberg в проведенном им исследовании показал сопоставимую с эффектом НПВП анальгетическую эффективность комбинированного применения хондроитина сульфата (ХС) и глюкозамина сульфата (ГС) в течение 6 мес. [9]. Чуть позже, в 2015 г., был опубликован систематический Кохрейновский обзор, продемонстрировавший превосходство комбинации ХС и ГС над плацебо по влиянию на боль в суставах при ОА [10]. V. Calamia et al. (2010) в исследовании, проведенном на культуре хондроцитов, показали синергетический эффект ХС и ГС: определенные белки (HSPB1, DPYL2, PGAM1, TAGL2), отвечающие за передачу сигнала, энергетический потенциал клетки, синтез, окислительно-восстановительные и обменные процессы в хондроцитах, синтезируются только при совместном использовании ХС и ГС [11].
Таким образом, совместное применение немедикаментозных методов и комбинации ХС и ГС у пациентов с коморбидными кардиоваскулярными заболеваниями имеет патогенетическое обоснование [12–15]. Это и явилось поводом для проведения исследования.
Цель исследования: оценить результаты комплексного подхода — медикаментозного (интермиттирующая схема парентерального введения ХС и ГС) и немедикаментозного (ежедневная ходьба и комплекс физических упражнений) — у пациентов с рецидивом хронической боли в коленных суставах.
Материал и методы
Исследование проведено как открытое проспективное сравнительное IV фазы. Из участвовавших в скрининге 118 человек с хронической болью в спине и суставах в исследование были отобраны 70 больных, которые соответствовали критериям включения и исключения. Они были рандомизированы на 2 равные группы методом случайных чисел.
Критерии включения: ОА коленных суставов II–III рентгенологической стадии по Kellgren — Lowrence; интенсивность боли в коленных суставах по визуальной аналоговой шкале (ВАШ) >40 мм; готовность отказаться от приема иных обезболивающих препаратов, кроме назначенных в исследовании; согласие следовать требованиям протокола в течение всего периода исследования, в т. ч. быть доступными для консультаций и наблюдения в течение всего периода исследования начиная с момента включения в него; подписание информированного согласия на участие в исследовании.
Критерии исключения: отчетливый невропатический и/или психогенный компонент болевого синдрома; онкологические заболевания любой локализации; СД 1 типа; хроническая болезнь почек с выраженной почечной недостаточностью (уровень креатинина ≥180 ммоль/л, скорость клубочковой фильтрации
Для изучения эффективности и безопасности комплексного применения медикаментозной (интермиттирующая схема парентерального введения ХС и ГС) и немедикаментозной (ежедневная ходьба и комплекс физических упражнений) терапии у пациентов с рецидивом хронической боли в коленных суставах были определены следующие первичные и вторичные точки оценки.
Первичные точки: доля пациентов с ответом на терапию в виде уменьшения боли по общепринятой стандартной оценке (уменьшение боли по ВАШ на ≥50%); оценка динамики боли по ВАШ; сроки наступления обезболивания, удовлетворяющего пациента.
Вторичные точки: изменение качества жизни; влияние на основные биохимические параметры (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), глюкоза крови, креатинин крови), динамика уровня С-реактивного белка (СРБ) в 1-й группе, частота нежелательных явлений (НЯ).
Пациенты были разделены на 2 равные по численности группы. Пациентам 1-й группы (n=35) была назначена интермиттирующая схема парентерального введения ХС (Хондрогард®) по 2,0 мл (200 мг) в/м № 20 через день и ГС (Сустагард® Артро) по 3,0 мл (200 мг на 2,0 мл действующего вещества и 1,0 мл растворителя) в/м № 20 через день. Препараты вводили в режиме чередования по дням: 1, 3, 5, 7-й и т. д. — ХС; 2, 4, 6-й и т. д. — ГС. Консилиумом терапевта, реабилитолога и врача лечебной физкультуры (ЛФК) разработаны индивидуальные комплексы упражнений для коленного сустава. Первые 10 занятий проходили в клинике, далее до конца исследования упражнения выполнялись под контролем инструктора ЛФК. Также в немедикаментозную программу была включена ежедневная ходьба с индивидуальной интенсивностью (от 5000 до 12 000 шагов в сутки), согласованная консилиумом специалистов. У большинства пациентов данную физическую нагрузку корректировали в зависимости от переносимости с минимумом 10 000 шагов в сутки к концу 3-й нед. терапии.
Пациентам 2-й группы (контроль, n=35) была назначена стандартная терапия НПВП, подобранными с учетом клинического и фармакологического анамнеза. Два (5,7%) пациента этой группы, имевшие противопоказания к НПВП (ОАК для профилактики тромботических осложнений при неклапанной фибрилляции предсердий), получали парацетамол в дозе до 3 г/сут. Остальным пациентам были назначены следующие НПВП: кетопрофен — 7 (35%) пациентам, лорноксикам — 8 (22,9%), диклофенак — 10 (28,6%), ибупрофен — 8 (22,9%). Дозы определяли индивидуально и титровали в зависимости от чувствительности и переносимости. Терапию НПВП и парацетамолом продолжали до достижения обезболивающего эффекта, удовлетворяющего больного, что соответствует стандартным амбулаторным стратегиям лечения обострений болевого синдрома. Для профилактики НПВП-гастропатии назначали пантопразол 20 мг/сут.
Клинические данные, характеристика болевого синдрома и тяжесть ОА больных представлены в таблице 1, из которой видно, что обе группы были сопоставимы по полу и возрасту, антропометрическим и клиническим показателям, а также по коморбидным заболеваниям.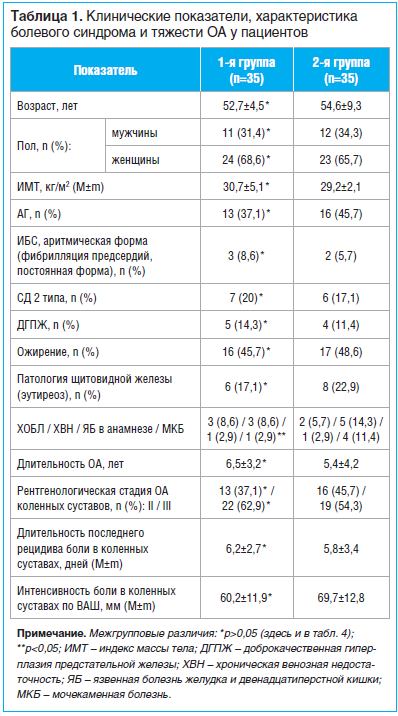
Пациенты также были сопоставимы по характеристикам болевого синдрома и тяжести ОА.
В начале исследования, на 10-й, 20-й дни, через 6 нед. и через 6 мес. от начала исследования оценивали эффективность лечения по ВАШ 100 мм; тяжесть ОА коленных суставов — по валидизированной шкале WOMAC; качество жизни — по валидизированной русскоязычной версии общего опросника EuroQol-5D.
Для анализа безопасности терапии в начале и в конце исследования были изучены уровни глюкозы в крови натощак, АЛТ, АСТ, креатинина. Кроме того, регистрировали частоту любых НЯ. У пациентов 1-й группы дополнительно изучали уровень СРБ в сыворотке крови.
База данных создана в программе Microsoft Eсxel 2011 для MacOS. Вычисляли средние значения и стандартные отклонения. Достоверность различий оценивали по критерию Стьюдента (двухпарный с неравным отклонением). Анализ данных проводили в программах Microsoft Exсel.
Результаты исследования
Все пациенты полностью закончили исследование. К 10-му дню терапии у пациентов обеих групп отмечено отчетливое улучшение. Однако, как показано в табл. 2, у пациентов 1-й группы при использовании комплексной программы (интермиттирующая схема парентерального введения ХС и ГС в совокупности с ежедневной ходьбой и индивидуальным комплексом физических упражнений) наблюдалось более значимое уменьшение боли в коленных суставах (p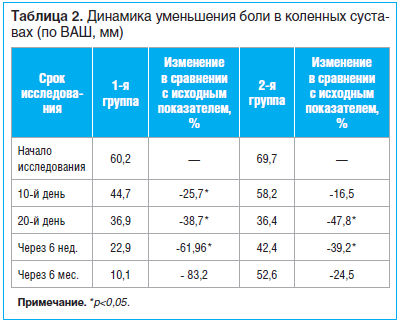
У пациентов 2-й группы НПВП отменены в среднем через 17,6±4,7 дня. Два пациента принимали парацетамол на протяжении 6 нед. исследования. К концу приема НПВП боль в суставах уменьшилась на 47,8% (p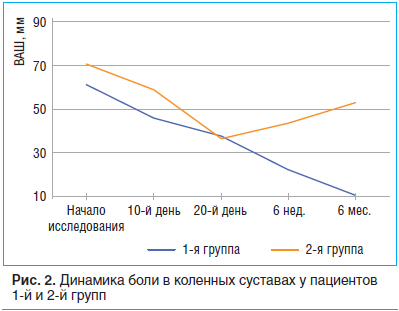
Межгрупповая разница в уменьшении боли к 6-й нед. наблюдения в коленных суставах составила 22,7% (p
К 6-му мес. наблюдения сохранялось снижение интенсивности болевого синдрома по ВАШ: 10,1 мм — средний показатель в 1-й группе, 52,6 мм — во 2-й группе. В группе контроля 6 пациентам потребовалось возобновление приема НПВП. Полученные данные демонстрируют сохранение эффекта терапии на протяжении полугода, что позволяет рекомендовать интермиттирующую схему терапии ХС и ГС курсовыми приемами 2 р./год.
Интенсивность боли и степень функциональной недостаточности коленных суставов, оцененные по опроснику WOMAC в начале и в конце исследования, имели достоверные различия в обеих группах (табл. 3). Так, на 6-й нед. исследования в 1-й группе наблюдалось снижение интенсивности боли на 76,5% (p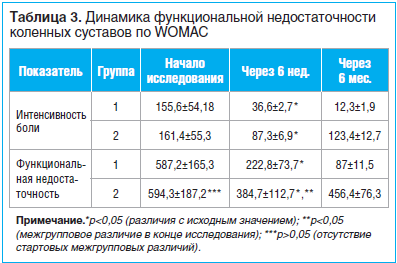
Динамика показателя качества жизни по валидизированной русскоязычной версии общего опросника EuroQol-5D показала его прирост на 39,1% к концу инъекционного курса в 1-й группе и на 8,2% — в группе контроля (p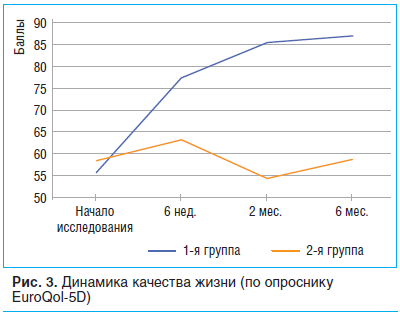
На фоне терапии лекарственными препаратами контролировались основные биохимические показатели, значимых изменений не отмечено (табл. 4). Отдельно была проанализирована динамика уровня глюкозы в крови натощак у 7 пациентов с СД 2 типа: в начале и конце исследования не отмечено достоверных изменений (6,4±0,7 и 6,2±0,4 ммоль/л соответственно). Это свидетельствует об отсутствии влияния интермиттирующей схемы ХС и ГС на развитие гипергликемии, что благоприятно для коморбидных пациентов с ОА и СД 2 типа.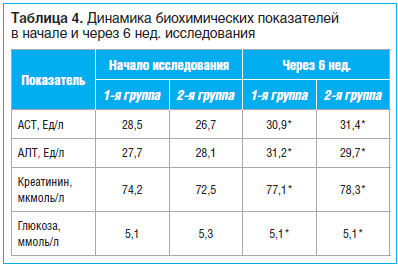
Интенсивность системного воспаления на фоне проводимой терапии у пациентов 1-й группы определяли по концентрации СРБ, было отмечено ее снижение на 25,5% (p
У больных 1-й группы не выявлено серьезных НЯ. Три (8,6%) пациента отметили дискомфорт в месте инъекций, однако это не послужило поводом для отмены терапии. Во 2-й группе 6 (17,1%) пациентов указали на дискомфорт в эпигастральной области, что потребовало увеличения дозы пантопразола до 40 мг/сут. У 2 больных, которым в начале исследования был назначен ибупрофен, к 5-му дню лечения эффект отсутствовал, и они были переведены на терапию диклофенаком натрия.
Заключение
Таким образом, комплексный подход (медикаментозный — интермиттирующая схема парентерального введения препаратов Хондрогард® и Сустагард® Артро и немедикаментозный — ежедневная ходьба и комплекс физических упражнений) у пациентов с рецидивом хронической боли в коленных суставах оказался высокоэффективным, безопасным, что позволяет рекомендовать его как альтернативу НПВП у коморбидных пациентов с ограничениями или противопоказаниями к приему последних. А сохраняющийся до 6 мес. после лечения обезболивающий эффект позволит уменьшить риски, связанные с полипрагмазией у пациентов с коморбидной отягощенностью.
1 Фармакопейная субстанция CS-Bioactive©, Биоиберика С.А.У., Испания, — препарат Хондрогард® (Сотекс).
2 Фармакопейная субстанция Биоиберика С.А.У., Испания, — препарат Сустагард® Артро (Сотекс).
Информация с rmj.ru




