Содержание статьи
Клинические особенности иксодовых клещевых боррелиозов у детей
И. В. Куимова, доктор медицинских наук, профессор
О. А. Радионова
Е. И. Краснова, доктор медицинских наук, профессор
ГБОУ ВПО НГМУ МЗ РФ, Новосибирск
Иксодовые клещевые боррелиозы (ИКБ) (синонимы: болезнь Лайма, Лайм-боррелиоз) в настоящее время рассматриваются как группа природно-очаговых инфекций, с трансмиссивным механизмом передачи, характеризующаяся полисистемным поражением и большим полиморфизмом клинических проявлений.
До открытия возбудителя ИКБ проявления болезни описывались как отдельные синдромы или самостоятельные заболевания с неясной этиологией: лимфоцитарный менингорадикулит (синдром Баннварта), серозный менингит, хронический артрит, клещевая эритема, лимфоцитома и т. д. (A. Bannwarth, V. Sedlacek и др.). В России нозологическую самостоятельность иксодовые клещевые боррелиозы получили с 1991 года, а с 1992 года — были введены в форму статистической отчетности по инфекционным заболеваниям [1, 2].
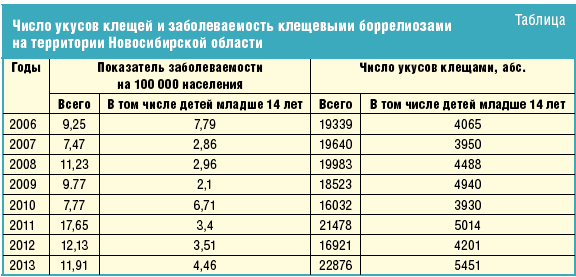
Иксодовые клещевые боррелиозы — самые частые, связанные с клещами, заболевания в умеренных температурных зонах северного полушария [3–5]. Только в Европе ежегодно описывается около 85 000 случаев клещевых боррелиозов. Однако это число в значительной мере недооценено, поскольку сообщения противоречивы, и многие случаи могли быть не диагностированы. В США ежегодно регистрируется около 15 000–20 000 случаев заболевания, и болезнь встречается в 15 штатах [6]. В России анализ заболеваемости (согласно официальной статистике Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека) показал, что ежегодно в течение последних лет регистрируется от 7,2 до 9,7 тысячи случаев заболеваний клещевыми боррелиозами. В 2011 г. заболеваемость клещевыми боррелиозами в России составила в абсолютных показателях 9957 случаев (из них детей до 17 лет — 847) или 7,02 на 100 000 населения. Новосибирская область в последние годы имеет отчетливый тренд по увеличению числа укусов клещей и заболеваемостью клещевыми боррелиозами, в том числе у детей. Этот показатель увеличился с 7,47 на 100 000 населения в 2007 г. до 17,65 на 100 000 в 2011 г. и 12,13 на 100 000 населения в 2012 г. (табл.). Высокий уровень заболеваемости клещевыми боррелиозами населения Новосибирской области в том числе обусловлен проживанием людей на эндемичных территориях и недостаточным объемом противоклещевых обработок мест массового посещения жителями (парки, кладбища, садовые участки).
Проводимые исследования в самих природных очагах как на территории Российской Федерации, так и в странах Европы показывают увеличение численности клещей и усиление активности циркуляции самого возбудителя [1, 5], что определяет тенденцию к повышению заболеваемости клещевыми боррелиозами в настоящее время.
Этиология клещевых боррелиозов
Сегодня известно (Johnson и соавт., 1984), что спирохеты, вызывающие клещевые боррелиозы, относятся к роду Borrelia. Данный род представляет собой гетерогенную популяцию микроорганизмов и подразделяется на две большие подгруппы:
1) возбудители возвратной клещевой лихорадки: B. recurrentis, B. duttoni, B. parkeri, B. turicatae, B. hermsii, B. miyamotoi и др.;
2) возбудители Лайм-боррелиозов: B. burgdorferi sensu stricto, B. garinii, B. afzelii, B. usitaniаe, B. valaisiana, B. andersonii, B. bissettii, B. japonica, B. tanukii, B. turdi, B. inica.
Указанные виды боррелий вследствие высокого фенотипического и генетического сходства были объединены в единый комплекс B. burgdorferi sensu lato [7]. Хотя этот комплекс сегодня включает до 18 видов Borrelia, только три из них являются явно патогенными: B. afzelii, B. burgdorferi и B. garinii (в том числе B. garinii OspA, тип 4, или B. bavariensis) [8, 9]. Зараженность клещей боррелиями в природных очагах варьирует от 10% до 80% [7, 10, 11]. В Новосибирской области как в природном очаге, так и у больных иксодовыми клещевыми боррелиозами чаще выявляется ДНК Borrelia garinii и Borrelia afzelii.
Основной механизм заражения при ИКБ — трансмиссивный, боррелии попадают в организм человека со слюной инфицированных клещей при кровососании. Пути передачи: трансмиссивный, алиментарный, контактный (через микротравмы кожных покровов при снятии и раздавливании клеща) и трансплацентарный. Сезонность заболевания — весенне-летняя, обусловленная периодом активности клещей. Иммунитет нестерильный, возбудитель способен к длительной персистенции в организме, возможны супер- и реинфекции [11]. После укуса клеща вероятность сероконверсии у человека находится в диапазоне от 3% до 6%. Клинически манифестные формы заболевания возникают в 0,3–1,4% случаев от всех укусов клещей.
Учитывая, что входными воротами инфекции при клещевых боррелиозах является кожа, где происходит размножение возбудителя с последующим лимфогенным распространением его в ближайшие лимфатические узлы и развитием регионарного лимфаденита, в месте присасывания клеща возникает первичный аффект с образованием эритемы [11–13]. Согласно статистическим данным, по мнению и отечественных и зарубежных авторов [3, 14], эритемные формы заболевания наблюдаются в клинической картине ИКБ в 40–70% случаев. При анализе заболеваемости трансмиссивными клещевыми инфекциями 125 детей в возрасте от 1 до 18 лет, проживающих в Новосибирской области, за 13 лет (период с 1999 по 2011 годы), было установлено, что иксодовыми клещевыми боррелиозами заболели 78,5% из них (95 человек). Заболевание протекало в эритемной форме у 94 больных ИКБ (98,9%). Диагноз выставлялся в соответствии с МКБ 10-го пересмотра на основании клинико-эпидемиологических, общеклинических, специфических (серологического — иммуноферментный анализ (ИФА), молекулярно-генетического — полимеразная цепная реакция (ПЦР)) и биохимических методов обследования.
Поражением кожи — мигрирующей эритемой — характеризуется период ранних локализованных проявлений (стадия локальной инфекции) при ИКБ. Эритема обычно возникает через 7–14 дней от момента укуса клеща (от 3 до 30 дней), локализуется вокруг места укуса, имеет округлую или овальную форму и тенденцию к распространению. В месте эритемы возможно возникновение кожного зуда, парестезий, повышение местной температуры. В отсутствие антибактериальной терапии эритема спонтанно угасает в сроки от нескольких дней до нескольких недель (в среднем — около 4 недель). У 10–30% больных мигрирующая эритема сопровождается неспецифическими симптомами, такими как недомогание, субфебрильная температура, кратковременные мигрирующие боли в мышцах и небольших суставах, утомляемость [15].
По нашим данным, в 44 случаях (46,3%) первыми признаками заболевания при ИКБ у детей явилось именно покраснение в месте укуса клеща. При наблюдении за детьми с эритемной формой иксодовых клещевых боррелизов, эритема появлялась в месте укуса клеща в срок до 45 дней (максимально) от момента присасывания клеща к коже, в среднем — на 11 ± 7 день. Размеры эритемы составляли от 1,5 до 20 см (в среднем — 6,6 ± 4 см). В редких случаях отмечался рост эритемы в размерах за период наблюдения. Эритема сохранялась на коже максимально до 36 дней, в среднем 8 ± 5 дней, с момента начала антибактериальной терапии угасала в среднем через 7 ± 4 дней. В 11 случаях (11,6%) эритема угасала с последующим шелушением. В двух случаях отмечалась эритема в виде двойного кольца, у троих детей отмечалось повышение местной температуры в области мигрирующей эритемы. В 5 случаях (5,3%) кожные проявления были представлены экзантемой (петехиальные, крупно- и среднепятнистые элементы сыпи), в сочетании с эритемой в месте присасывания клеща. Во всех пяти случаях сочетания эритемы и сыпи на туловище, у больных отмечалась лихорадка до фебрильных цифр и довольно интенсивные проявления интоксикации.
Наличие мигрирующей эритемы является патогномоничным симптомом клещевого боррелиоза. В последующем происходит диссеминация возбудителя: гематогенно, лимфогенно и периневрально боррелии распространяются на другие участки кожи, во внутренние органы (печень, селезенку, почки, сердце), суставы, оболочки мозга, центральную и периферическую нервную системы.
Генерализация инфекции (стадия диссеминации боррелий) у взрослых наиболее часто характеризуется поражением нервной системы в виде менингорадикулоневрита (синдрома Баннварта): сочетание серозного менингита, радикулита и поражения черепномозговых нервов (чаще всего в виде одно- или двустороннего периферического паралича лицевого нерва). Генерализованная стадия заболевания может протекать также с формированием кардита, лимфоцитомы (доброкачественная опухоль красно-фиолетового цвета), которая обычно локализуется на мочке уха у детей, а у взрослых в области ареол, мошонки, носа и предплечий.
К поздним и персистирующим клиническим проявлениям ИКБ (стадия органных поражений) относятся хронический атрофический акродерматит (acrodermatitis chronica atrophicans of Herxheimer, ACA) и хронический артрит, а также полинейропатии, хронический прогрессирующий менингоэнцефалит и мультифокальный церебральный васкулит, которые характеризуются необратимым неврологическим дефицитом и прогредиентным течением болезни. Обычно такие проявления развиваются не более чем у 5% пациентов, перенесших нейроборрелиоз. Также редко описываются случаи экстрапирамидных нарушений на фоне хронической боррелиозной инфекции. Суставные поражения могут возникать отсроченно, при отсутствии терапии, через несколько месяцев и даже лет после укуса клеща и обычно протекают в виде хронического олигоартрита, с ассиметричным поражением одного из суставов (чаще коленных и локтевых). Хронические формы иксодовых клещевых боррелиозов являются наиболее сложными с точки зрения диагностики и лечения. Это связано с тем, что заболевание имеет неспецифические симптомы, которые могут быть характерны также для заболеваний другой этиологии (например, артрит, энцефаломиелит или периферическая невропатия), которые не позволяют уточнить диагноз при отрицательных или сомнительных лабораторных и клинических критериях.
У детей в течении ИКБ можно выделить следующие клинические особенности.
- Наиболее часто ИКБ заболевают дети в возрасте от 3 до 10 лет.
- Мигрирующая эритема развивается у детей в 70–80% случаев и у большинства больных имеет кольцевидную форму.
- Характерной локализацией эритемы у детей является волосистая часть головы, околоушная область, лицо, верхняя часть туловища.
- Общеинфекционный синдром наблюдается у 60–70% больных ИКБ детей и обычно более выражен, чем у взрослых.
- У большинства больных детей наблюдается увеличение регионарных к месту укуса клеща лимфатических узлов.
- У 10% больных детей с острым течением ИКБ наблюдается вовлечение в патологический процесс мозговых оболочек с развитием серозного менингита.
- Развитие хронического течения после перенесенных острых ИКБ у детей наблюдается в 15–20% случаев.
Диагностика ИКБ
Для постановки диагноза ИКБ необходимо учитывать сведения эпидемиологического анамнеза (присасывание клеща, посещение мест с высокой вероятностью нападения клеща — выезд на природу, выход в лес) с учетом времени года (весенне-осенний период), клинические проявления: появление мигрирующей кольцевидной эритемы, увеличение регионарных лимфоузлов, наличие неврологической, суставной и кардиальной симптоматики.
Для подтверждения диагноза используются тесты лабораторной диагностики. На сегодняшний день в арсенале практического врача имеются диагностические тесты, направленные на прямую диагностику возбудителя, и серологические тесты по выявлению антител к возбудителю в разных биологических средах организма человека. Непосредственное обнаружение возбудителя возможно с помощью прямой микроскопии, но этот метод не получил широкого практического применения, так как результаты световой микроскопии субъективны и противоречивы. В исследуемых образцах может содержаться небольшое количество боррелий, кроме того, они могут терять четкость морфологии при окраске и фиксации мазка — все это затрудняет диагностику. Культуральный метод хотя и считается «золотым стандартом», но также не выполняет требований практического здравоохранения ввиду его длительности (от 3–4 до 10 недель), дороговизны и недостаточной эффективности [7]. Молекулярные методы диагностики с использованием ПЦР чаще используются на тех стадиях инфекционного процесса, где серологический метод диагностики недостаточно информативен: Лайм-артрит, ранний боррелиоз и нейроборрелиоз. При этом существенное ограничение в использовании молекулярных методов диагностики определяет вариабельность участков генома боррелий, циркулирующих в Европе и России [3, 7].
Более доступны в практическом применении серологические методы диагностики. К наиболее распространенным методам определения антиборрелиозных антител относят иммуноферментный анализ (ИФА и ELISA), метод непрямой иммунофлюоресценции, реакция связывания комплемента, реакция пассивной гемагглютинации, а также иммуноблоттинг.
При ИКБ антитела класса IgM в максимальном количестве вырабатываются к 3–4 неделе болезни, ко второму месяцу появляются антитела класса IgG. У некоторых больных синтез IgM может задерживаться или отсутствовать вообще [3, 7, 11, 16]. Сероконверсия наблюдается у 20–50%, а по некоторым данным, у 80% больных ранним боррелиозом [8]. Наличие IgM-антител к боррелиям в сыворотке крови, как правило, указывает на раннюю инфекцию. Наличие IgG-антител указывает на диссеминацию боррелий или на переход в стадию хронического персистирования. Оба класса антител могут определяться в течение длительного времени (до 10 лет), в том числе и после успешно проведенной антибактериальной терапии [17–19].
С целью повышения диагностической точности американским Центром контроля болезней было предложено проверять положительные или пограничные результаты скрининговых тестов с помощью иммунноблоттинга, используя стандартизированные критерии серопозитивности метода [20]. Основным скрининг-тестом в этой схеме является ИФА. Исследуемые образцы с положительными или сомнительными результатами в ИФА обязательно дополнительно тестируют методом иммунного блоттинга [3, 7, 20, 21]. Согласно этим рекомендациям, серологическое тестирование на болезнь Лайма считается положительным, если в одной сыворотке как скрининговый метод, так и иммунноблоттинг дали положительные результаты. В РФ не имеется таких стандартизированных критериев диагностики, однако, учитывая сложный иммунопатогенез при боррелиозах, не следует основываться для постановки диагноза лишь на одном диагностическом тесте. Расширенное обследование с использованием всех доступных методов дает преимущество, особенно в диагностике безэритемных форм и поздних стадий заболевания, а также позволяет избежать диагностических ошибок, связанных с ложноположительными реакциями.
Своевременная диагностика и раннее назначение этиотропных препаратов являются эффективным средством предупреждения развития органных поражений и хронизации заболевания. Раннее назначение антибактериальной терапии при иксодовых клещевых боррелиозах позволяет достоверно снизить риск развития неврологических, суставных и кардиальных осложнений.
Лечение и профилактика ИКБ
В настоящее время стандартом терапии иксодовых клещевых боррелиозов считается использование у детей старше 8 лет и взрослых пациентов доксициклина (100 мг 2 раза в сутки) или амоксициллина (500 мг 3 раза в сутки) в течение 14 дней при острых ИКБ. При генерализованных формах (нейроборрелиоз) терапия проводится парентеральным введением пенициллина или препаратов группы цефалоспоринов (цефотаксим, цефтриаксон) не менее 14 дней. Эффективность антибактериальной терапии оценивается по характеру клинических проявлений.
Попытки создания вакцин против клещевого боррелиоза были предприняты в США, но оказались неэффективными в связи с большим разнообразием геновидов возбудителя. В настоящее время работы по созданию вакцин продолжаются [22].
Наиболее эффективными профилактическими мерами являются мероприятия по защите от укусов инфицированных клещей при посещении мест их вероятного обитания: специальная одежда, использование защитных репеллентов, акарицидные обработки лесопарковых зон, само- и взаимоосмотры [23]. Укусов клещей также можно избежать путем тщательного осмотра и удаления клещей с домашних животных [24].
При обнаружении клеща необходимо как можно скорее удалить его с помощью пинцета, избегая раздавливания насекомого. Удалять клеща необходимо полностью, поскольку оставшиеся в коже части насекомого могут привести к аллергическим реакциям и вторичной бактериальной инфекции. Использование вазелина при удалении клеща для нарушения функции дыхания у насекомого не является эффективным, поскольку клещи имеют низкую частоту дыхания (3–15 вдохов в час) и время, требуемое для гибели насекомого, может быть достаточным для передачи возбудителя человеку [25].
Возможность и необходимость превентивной антибиотикопрофилактики после укуса инфицированного клеща в настоящее время широко обсуждается отечественными и зарубежными авторами. В США антибиотикопрофилактика после укуса инфицированного клеща проводится, если:
- клещ находился на коже более 72 часов;
- продолжительность питания клеща неизвестна;
- клещ отпал сам после насыщения.
Превентивная антибиотикотерапия не показана, если:
- укус клеща случился вне эндемичных территорий;
- клещ находился на коже менее 24 часов;
- с момента укуса прошло более 72 часов.
Если клещ находился на коже от 24 до 72 часов, вопрос решается в индивидуальном порядке, например, если сделан анализ клеща и он заражен боррелиями. Для антибиотикопрофилактики используется доксициклин 200 мг — однократный прием. Для детей старше 8 лет доза составляет 4 мг/кг массы тела до максимальной 200 мг. Беременным и кормящим женщинам, детям до 8 лет назначают амоксициллин. Время до начала приема антибиотика должно составлять не более 72 часов после удаления клеща.
В России предлагаются следующие варианты антибактериальной профилактики:
- доксициклин в дозе 0,1 г 2 раза в день курсом от 3 до 5 дней, альтернативными препаратами с целью терапии и профилактики ИКБ могут быть ампициллин, азитромицин (Н. Н. Воробьева, Э. И. Коренберг) [12];
- тетрациклин по 0,5 г 4 раза в сутки 5 дней, бензатина бензилпенициллин + бензилпенициллин прокаина + бензилпенициллин 1,2–2,4 млн ЕД внутримышечно однократно, бензатина бензилпенициллин в дозе 2,4 млн ЕД внутримышечно однократно, доксициклин по 0,1 г 2 раза в сутки в течение 10 дней, амоксициллин + клавулановая кислота по 0,375 г 4 раза в сутки в течение 5 дней. Лечение проводят не позже 5-го дня от момента укуса. Риск возникновения заболевания уменьшается до 80% (Ю. В. Лобзин, С. С. Козлов, А. Н. Усков) [26].
Если говорить о выборе оптимального препарата для профилактики ИКБ, то антибиотик, используемый в этих целях, должен обладать, с одной стороны, высокой активностью в отношении боррелий даже при однократном приеме, с другой — благоприятным спектром безопасности. Доксициклин является наиболее часто применяемым для профилактики ИКБ препаратом, так как отвечает обоим требованиям. В целях минимизации риска побочных явлений предпочтительно использовать доксициклин в форме его нейтральной соли — моногидрата, который практически не ассоциирован с развитием кислотозависимых заболеваний ЖКТ (таких, как эзофагит, язва пищевода). Кроме того, доксициклина моногидрат, представленный в форме солютаб, характеризуется максимальным удобством применения, что немаловажно для пациентов, получающих антибиотик без отрыва от повседневной активности.
Резюмируя вышесказанное, можно заключить, что тактика ведения пациентов с риском развития клещевого боррелиоза должна предусматривать рациональное назначение эффективного антибактериального препарата, позволяющего предотвратить заболевание и его потенциальные осложнения.
Литература
- Арумова Е. А., Воронцова Т. В. Клещевой боррелиоз (болезнь Лайма) в России // Дезинфекционное дело. 2000. № 2.
- Коренберг Э. И. Инфекции группы Лайм-боррелиоза — иксодовые клещевые боррелиозы в России // Мед. паразитология и паразитар. болезни. 1996. № 3. С. 14–18.
- Ананьева Л. П. Лайм-боррелиоз, или иксодовые клещевые боррелиозы. I часть: этиология, клиника, диагностика // Инфекции и антимикробная терапия. Том 4. № 2.
- Оберт А. С., Дроздов В. Н., Рудакова С. А. Иксодовые клещевые боррелиозы: нозогеографические и медико-экологические аспекты. Новосибирск: Наука, 2001. 110 с.
- Lindgren E., Tälleklint L., Polfeldt T. Impact of climatic change on the northern latitude limit and population density of disease-transmitting European tick Ixodes ricinus // Env Health Perspect. 2000. V. 108. Р. 119–123.
- Steere A. C. Lyme disease // The New England Journal of Medicine. 2001. V. 345. Р. 115–125.
- Манзенюк И. Н., Манзенюк О. Ю. Клещевые боррелиозы (болезнь Лайма). Кольцово, 2005. 85 с.
- Rauter C., Hartung T. Prevalence of Borrelia burgdorferi sensu lato genospecies in Ixodes ricinus ticks in Europe: a metaanalysis // Appl Environ Microbiol. 2005; 71 (11): 7203–7216.
- Stanek G., Reiter M. The expanding Lyme Borrelia complex–clinical significance of genomic species? // Clin Microbiol Infect. 2011; 17 (4): 487–493.
- Коренберг Э. И. Изучение и профилактика микст-инфекций, передающихся иксодовыми клещами // Вестн. РАМН. 2001. № 11. С. 41–45.
- Лукашова Л. В., Лепёхин А. В., Жукова Н. Г., Карпова М. Р., Пирогова Н. П., Киюцина Т. А., Добкина М. Н., Портнягина Е. В. Иксодовые клещевые боррелиозы (этиология, эпидемиология, патогенез, клинические проявления, диагностика, лечение, профилактика). Учебно-методическое пособие для врачей, ординаторов, интернов и студентов. Томск: ТГУ, 2004. 76 с.
- Воробьева Н. Н. Клиника, лечение и профилактика иксодовых клещевых боррелиозов. Пермь, 1998. 136 с.
- Мебель В. Д., Бентришвили Г. А., Живич М. Б. и др. Клиника острого периода клещевого боррелиоза Лайма // Мед. паразитология и паразитар. болезни. 1998. № 3. С. 30–33.
- Nau R., Christen H. J., Eiffert H. Lyme disease — current state of knowledge // Dtsch Arztebl Int. 2009; 106 (5): 72–81.
- Satz N. Klinik der Lyme-Borreliose. Verlag Hans Huber, Bern, 2. Auflage, 2002.
- Усков А. Н., Байгеленов К. Д., Бургасова О. А., Гринченко Н. Е. Современные представления о диагностике клещевых инфекций // Сибирский медицинский журнал. 2008. № 7. С. 148–152.
- Скрипникова И. А., Ананьева Л. П., Барскова В. Г., Ушакова М. А. Иммунологический гуморальный ответ у больных Лаймской болезнью // Терапевт. арх. 1995. № 11. С. 53–57.
- Федотов Е. С., Барскова В. Г., Ананьева Л. П. и др. Механизмы регуляции воспаления и иммунитета в патогенезе болезни Лайма // Клиническая медицина. 1999. № 6. С. 14–20.
- Brown S. L., Hansen S. L., Langone J. J. // JAMA. 1999.Vol. 282. P. 62–66.
- Centers for Disease Control and Prevention. Recomendations for test performance and interpretation from the Second National Conference on Serologic Diagnosis of Lyme disease // MMWR Morb. Mortal Wkly Rep. 1995. 44: 590–591.
- Fix A. D., Strickland G. T., Grant J. Tick bites and Lyme disease in an endemie setting: problematic use of serologic testing and prophylactic antibiotic therapy // JAMA. 1998. V. 279. P. 206–210.
- Barrett A. D. T., Stanberry L. R. Vaccines for biodefense and emerging and neglected Diseases. 1 st ed. London: Academic Press; 2009.
- Clark R. P., Hu L. T. Prevention of Lyme disease and other tick-borne infections // Infect Dis Clin North Am. 2008; 22 (3): 381–396.
- Fritz C. L. Emerging tick-borne diseases // Vet Clin North Am Small Anim Pract. 2009; 39 (2): 265–278.
- Pitches D. W. Removal of ticks: a review of the literature. Euro Surveill. 2006; 11 (33): pii. 3027. Available from: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=3027.
- Лобзин Ю. В., Усков А. Н., Козлов С. С. Лайм-боррелиоз (иксодовые клещевые боррелиозы). СПб: Фолиант, 2000. 160 с.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru