Клинические фенотипы бронхиальной астмы у подростков:
трудности диагностики и терапии. Часть 2.
Н. Г. Астафьева, доктор медицинских наук, профессор
И. В. Гамова, кандидат медицинских наук
Е. Н. Удовиченко, кандидат медицинских наук
И. А. Перфилова, кандидат медицинских наук
И. Э. Михайлова
О. С. Наумова
ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
Преобладающим вариантом болезни (96% подростков) была атопическая
бронхиальная астма (БА), у 4% больных отмечался низкий уровень общего IgE, не
было выявлено специфической сенсибилизации при кожном тестировании и анализе
in vitro, не было отчетливых клинических проявлений, характерных для
аллергической патологии. Тяжесть неатопической БА у этих пациентов была
различной, они не отличались от других больных ни возрастом дебюта болезни, ни
другими характеристиками. У 3 больных БА протекала с крайне тяжелыми,
жизнеугрожающими обострениями.
Автор делает вывод о том, что степень тяжести БА от дебюта до
постпубертатного периода меняется незначительно вне зависимости от проведения
адекватной базисной терапии. Ремиссия болезни в подростковом возрасте отмечена у
8% больных атопической бронхиальной астмой легкой степени, симптомы бронхиальной
астмы сохраняются в возрасте 20 лет у 83% заболевших в детстве, у половины из
них болезнь имеет персистирующее течение. Ежедневные симптомы болезни отмечаются
в молодом возрасте у 88% больных тяжелой БА в детстве.
Таким образом, клинико-эпидемиологические исследования подчеркивают
вариабельность астмы. Это многомерное явление, которое включает изменчивость в
возрастной эволюции, клинических, физиологических и патологических параметрах.
На сегодняшний день рассмотрение этих разрозненных доменов в единой модели
весьма затруднительно. Новые возможности многостороннего подхода для выявления
эволюции астмы и ее отдельных фенотипов предоставляют современные методы
биостатистики, в том числе факторный, кластерный анализ и др.
Кластерный анализ бронхиальной астмы у подростков
Концепция неоднородности астмы, обсуждаемая активно в последние годы,
обретает все более четкие характеристики благодаря использованию новых
статистических и математических методов для фено/эндотипирования (факторный,
кластерный анализ). Фенотип преимущественно определяется по интеграции
клинически изучаемых характеристик (в том числе таких клинических параметров,
как возраст, пол, раса, начало заболевания, воздействия факторов курения,
профессии, менструального периода у женщин, коморбидности) и связанных с
взаимодействием генов пациента со средой. Эндотипы могут быть потенциально
определены как кластеры клинических признаков в их взаимосвязи с физиологией,
иммунологией, патологией, фармакогенетикой, ответом на лечение, прогнозом и
другими компонентами заболевания. В современных клинических руководствах
представлен ряд хорошо очерченных фенотипов астмы:
- Аллергическая БА — чаще возникает в детском возрасте, ассоциирована в
прошлом с и/или семейным анамнезом аллергических заболеваний, таких как
экзема, аллергический ринит, пищевая и лекарственная сенсибилизация. В
мокроте, как правило, большое количество эозинофилов — хороший ответ на иГКС. - Неаллергическая БА — часть взрослых, страдающих БА, не имеют связи с
аллергическими заболеваниями. Клеточный профиль мокроты содержит нейтрофилы,
эозинофилы или несколько типов воспалительных клеток (пангранулоцитарный). Эта
часть пациентов хуже отвечает на терапию иГКС. - Астма с поздним началом — часть взрослых, преимущественно женщины,
заболевают в более зрелом возрасте. Эти пациенты, как правило, не имеют связи
с аллергией, часто требуются более высокие дозы иГКС, поскольку пациенты более
рефрактерны к терапии иГКС. - Аспиринчувствительная астма — приблизительно 5–10% всех взрослых
астматиков, чаще встречается при неатопической астме, редко встречается у
детей. - Астма с фиксированным ограничением воздушного потока — некоторые длительно
болеющие пациенты развивают этот фенотип, который, как полагают, связан с
ремоделированием дыхательных путей. - Поздняя астма с ожирением — некоторые пациенты с избыточной массой,
страдающие БА, имеют более выраженные симптомы и незначительное эозинофильное
воспаление в дыхательных путях.
Важной характеристикой клинических фенотипов являются и патобиологические
механизмы, при этом внимание обращают на тип воспаления (эозинофильный,
нейтрофильный, смешанный или малогранулоцитарный), степень ремоделирования
дыхательных путей; низкий объем фиксированного выдоха за 1-ю секунду (ОФВ1),
фиксированную обструкцию дыхательных путей, высокую готовность дыхательных путей
к коллапсу, скорость падения функции внешнего дыхания (ФВД) [10].
Признание гетерогенности астмы, плохого ответа на лечение и отсутствие
контроля у больных побудило к поиску дальнейшего детального фено/эндотипирования
астмы, особенно при тяжелой астме, сначала у взрослых пациентов, а затем и в
детской популяции [26].
Кластерный анализ у взрослых пациентов с тяжелой астмой выделяет 4–5
фенотипов [11, 12], а в самом упрощенном виде фенотипическую классификацию
тяжелой астмы у взрослых с использованием кластерного анализа можно представить
в виде двух основных категорий — клинических фенотипов и фенотипов, определяемых
характером воспаления.
Клинические фенотипы тяжелой астмы у взрослых:
- астма с часто повторяющимися тяжелыми обострениями;
- астма с фиксированной обструкцией дыхательных путей;
- кортикостероид-зависимая астма (случаи астмы, требующие системных
кортикостероидов для текущего контроля).
Воспалительные фенотипы:
- персистирующая тяжелая эозинофильная астма (> 3% эозинофилов в мокроте);
- неэозинофильная тяжелая астма с увеличением нейтрофилов (> 61% нейтрофилов
в мокроте; - тяжелая малогранулоцитарная астма (с низким содержанием эозинофилов и
нейтрофилов: Э < 1–2,75% и Н < 51–65%).
Для фенотипической классификации астмы у детей были предложены следующие
подходы.
В соответствии с возрастным диапазоном:
- свистящее, хрипящее дыхание у детей дошкольного возраста (0–5 лет);
- астма у детей школьного возраста (6–11 лет);
- астма у подростков (от 12 до 17 лет).
В соответствии с ответом на лечение.
В соответствии с течением заболевания:
- астма с редкими, но тяжелыми обострениями;
- «хрупкая» (brittle) астма;
- тяжелая астма с сенсибилизацией к аллергенам плесневых грибов.
Воспалительные фенотипы:
- при стабильной астме (малогранулоцитарная и эозинофильная астма;
нейтрофильная у детей — редко); - при острой астме (обострение — преобладает эозинофильный вариант).
Предлагаемые фенотипические классификации детской астмы имеют серьезные
ограничения, но они могут быть полезны для правильного понимания болезни и
улучшения стратегии лечения, в том числе и у подростков.
Исследовательской группой по тяжелой БА у детей [27] было выделено 4
кластера, имеющих определенное сходство с клиническими фенотипами БА у взрослых:
1 — позднее появление симптомов атопической астмы
с нормальной легочной функцией;
2 — раннее появление симптомов атопической астмы с нормальной легочной функцией;
3 — раннее появление симптомов атопической астмы с легкими нарушениями
ограничения воздушному потоку и коморбидностью;
4 — раннее появление симптомов атопической астмы с выраженными нарушениями
ограничения воздушному потоку.
Согласуются с этими данными продольные когортные исследования на корейской
популяции. 724 субъекта были включены в анализ, среди которых тоже было
идентифицировано 4 кластера (астма у курильщиков; астма с тяжелой степенью
обструкции; астма атопическая с ранним появлением симптомов; астма легкого
течения с поздним появлением симптомов) [28].
Широкий возрастной диапазон детской астмы (от рождения до 15–18 лет)
означает, что симптомы, патофизиология, диагностические инструменты и
терапевтический арсенал будут существенно различаться. Так, у подростков (12–17
лет) тяжелая астма, также как и в других возрастных группах, часто ассоциирована
с атопией, выраженностью бронхиальной обструкции, ответом на бронходилататоры и
метахолин. Но базальный уровень ОФВ1 у тяжелых астматиков подростков ниже, чем
теоретическое значение для их возрастной группы, и в отличие от детей
дошкольного и школьного возраста не всегда полностью обратим после
бронходилататоров, что дает возможность предполагать наличие паттерна
ремоделирования дыхательных путей, формирующегося еще в доподростковом периоде
[29].
Необходимым условием для оптимального лечения БА у подростков становится
концепция, объединяющая генетику с механизмом заболевания и терапевтическим
эффектом. Относительный вклад генетических факторов нередко сложно определить.
Поэтому молекулярно-генетическое исследование фенотипов астмы представляет
особый интерес. К астме имеют отношение более 100 генов, в том числе в таких
областях, как выработка аллергенспецифических IgE (атопия), проявления
бронхиальной гиперреактивности (БГР), образование медиаторов воспаления,
цитокинов, баланс между Th1/Th2-опосредованными типами иммунного ответа.
Интенсивно изучаются генетические факторы в фармакотерапии астмы, ответе на
противоастматическое лечение (гены, кодирующие β-рецепторы, регулирующие ответ
на глюкокортикостероиды, антилейкотриеновые препараты и т. д.).
Молекулярно-генетическое исследование генов, кодирующих бета-2
адренергические рецепторы (ADRB2), липоксигеназу 5 (ALOX5*5/4), фактор некроза
опухоли альфа (TNFA*308А), у 72 детей с астмой было включено в программу
иерархического кластерного анализа. Используя 16 бинарных переменных,
характеризующих динамику и основные клинические проявления БА, исследователи
выявили 4 кластера БА, характеризующие особенности динамики БА в ассоциации с
определенными генетическими полиморфизмами [44].
I фенотип БА
Мальчики и девочки с тяжелой БА, у 60% избыточная масса тела. У половины
снижение функции легких с возрастом, но обратимость обструкции высокая. БА
остается тяжелой. Резистентность к терапии иГКС у 57% (ассоциация с генотипами
ADRB2*79CG, TNFA*308А, ALOX5*5/4, ALOX5*5/5, не встречается комбинация
ADRB2*79GG + ADRB2*46GG).
II фенотип БА
Преимущественно мальчики с нормальной массой тела. Тяжелая рефрактерная к
лечению БА, тяжесть не меняется с возрастом. На фоне прогрессивного снижения
функции легких у трети больных отмечается снижение обратимости обструкции
(ассоциация с генотипами ADRB2*79CG, TNFA*308А, ALOX5*5/4, ALOX5*5/5 (как и в I
кластере), но здесь наиболее часто встречается комбинация ADRB2*79GG +
ADRB2*46GG, ни у кого не выявлен генотип ALOX5*5/6).
III фенотип БА
Преимущественно мальчики с нормальным индексом массы тела. Легкое и
среднетяжелое течение БА, без динамики с возрастом, снижение функции легких и
формирование необратимой обструкции отмечается редко. Хороший ответ на базисную
терапию (ассоциация с генотипами ALOX5*5/6, TNFA*308А, ADRB2*79CG, ADRB2*46AG,
редко встречаются GR*1220G и комбинация ADRB2*79GG + ADRB2*46GG).
IV фенотип БА
Мальчики и девочки с БА различной тяжести, чаще нетяжелой, с нормальной
массой тела. Снижение функции легких с возрастом происходит редко, бронхиальная
обструкция обратима. БА течет легче с возрастом. Резистентность к терапии не
характерна (ассоциация с генотипами GR*1220G, ALOX5*5/4, ALOX5*5/5, ADRB2*79CG +
ADRB2*46AG, ADRB2*79CG, ADRB2*46AG, редко TNFA*308А, комбинация ADRB2*79GG +
ADRB2*46GG, Alox5*5/6).
Таким образом, фенотип тяжелой БА с прогрессирующим снижением функции легких
и снижением к подростковому возрасту обратимости бронхиальной обструкции
ассоциируется с сочетанием аллелей G в гомозиготном состоянии в двух локусах
гена бета2-адренергического рецептора (ADRB2*79GG и ADRB2*46GG). Уменьшение
тяжести БА с возрастом при сохранении нормальных функции легких и обратимой
бронхиальной обструкции отмечается при отсутствии аллеля TNFA*308А полиморфизма
308G > A.
Становится очевидным, что разнородные данные, полученные в отдельных
исследовательских программах и клинических наблюдениях, требуют создания единой
платформы для обмена, обсуждения и интерпретации результатов проектов на основе
консенсуса и использования глобальных стандартных операционных процедур. Для
того чтобы лучше понять ситуацию с тяжелой астмой, определить фенотипы,
связанные с обострениями или стабильным течением астмы, прогрессированием
заболевания, определить, как отличается течение болезни от человека к человеку,
в том числе от ребенка к подростку и взрослому, необходим анализ и сравнение
симптомов и биомаркеров в образцах от людей с тяжелой астмой и людей без астмы.
С целью ответа на эти вопросы, а также получения новой информации для развития
идей, способных привести к созданию новых эффективных методов лечения, был
инициирован большой исследовательский проект, в который вовлечены ученые из
университетов, научно-исследовательских институтов, фармацевтической
промышленности, отдельных компаний. Для реализации целей европейского проекта
U-BIOPRED (Unbiased Biomarkers for the Prediction of Respiratory Disease Outcome,
Объективные биомаркеры для прогнозирования заболеваний органов дыхания) в рамках
инновационной медицинской программы Innovative Medicines Initiative (IMI)
планируется проанализировать более 3 млн образцов, полученных от 300 детей и 700
взрослых с тяжелой и нетяжелой БА, а также без БА. Инновационный диагностический
алгоритм, основанный на данных, полученных с использованием инвазивных
(бронхиальная биопсия) и неинвазивных тестов (периферическая кровь, биомаркеры
выдыхаемого воздуха, мокроты), во взаимосвязи с клиническими симптомами позволит
правильно идентифицировать пациентов с тяжелой астмой и будет способствовать
более подробному фенотипированию БА во взрослой и педиатрической практике [30].
Другой европейский проект MeDALL (Mechanisms of the Development of Allergy,
Механизмы развития аллергии), одобренный Всемирной организацией здравоохранения,
направлен на формирование инновационного подхода к изучению IgE-ассоциированных
фенотипов в клинической практике, начиная от инициирования аллергии с раннего
детства до молодого и зрелого возраста [31, 32]. В основе этого подхода
адекватный диагноз, наличие и доступность лечения, восприимчивость к лечению,
выявление сопутствующих заболеваний и факторов риска.
Ведущие специалисты в клинической аллергологии, занимающиеся проблемами
аллергических заболеваний, астмы, атопического дерматита, пищевой аллергии у
детей и взрослых, на основе достижений эпидемиологии, генетики, иммунологии,
молекулярной биологии, биохимии аллергенов, биоинформатики готовы к разработке
нового ступенчатого многомерного подхода, объединяющего предыдущие и текущие
проекты для определения фенотипов тяжелых аллергических (и связанных с ними)
заболеваний, что крайне важно для клинической практики, научных исследований (в
том числе эпидемиологических), общественного здравоохранения, образования и
открытия новых видов лечения.
Широкое поле исследований будет направлено на открытие профилей биомаркеров (fingerprints
— «отпечатки пальцев») в уже известных классических и новых вновь выявляемых
аллергических фенотипах и будет осуществляться в многоступенчатом процессе с
использованием эпигенетики, таргетной протеомики и объективной транскриптомики.
(Примечание: fingerprinting — метод фингерпринтов, или «отпечатков пальцев»,
связан с анализом первичной структуры ДНК, РНК и рибонуклеопротеидов путем
последовательного хроматографического и электрофоретического разделения
олигонуклеотидов, образующихся под действием ДНКаз или РНКаз; первоначально был
разработан для сравнительного анализа первичной структуры гомологичных белков и
заключался в разделении пептидов, образующихся после расщепления белков
протеазами, с помощью двумерного электрофореза; наиболее распространенный
вариант — метод генетических «отпечатков пальцев» — DNA fingerprint technique).
Профили биомаркеров («отпечатки пальцев») будут широко оцениваться в разных
подгруппах: в тех, которые связаны с валидизированными аллергическими
фенотипами, и в других неаллергических популяциях. Релевантные профили
биомаркеров (соответствующие «отпечатки пальцев») будут объединены в
фенотипическую сеть биомаркеров («handprints» — «ладошек») с использованием
системного биологического подхода и валидации в достаточном количестве образцов.
Результаты могут быть представлены в новых интеграционных сложных
математических моделях, чтобы оценить наилучшие биомаркеры для ранней
диагностики и профилактики аллергии, ассоциированных заболеваний, таких как
астма и атопический дерматит.
На основе изучения IgE-ассоциированных фенотипов у детей и подростков, их
возрастной эволюции были выявлены ранние жизненные риски, истоки которых были
связаны не столько с первыми днями и месяцами жизни, сколько с процессами
внутриутробного развития и течением беременности у матери.
На основании патобиологических критериев отдельных фенотипов/эндотипов,
выделены Th2- и не-Th2-связанные фенотипы астмы. Th2-молекулярные фенотипы более
детально охарактеризованы, они доминируют у подростков, для них описаны
соответствующие клинические характеристики, биомаркеры и даже конкретные
молекулярные пути, цитокиновые профили. Не-Th2-связанные фенотипы астмы остаются
менее определенными, включают больных с нейтрофильным или малогранулоцитарным
типом воспаления, астму курильщиков, плохо отвечающих на терапию
глюкокортикостероидами, а также астму, ассоциированную с ожирением, по крайней
мере у взрослых пациентов. Вполне вероятно, что для таких больных более
значимыми являются такие механизмы развития, как нейрогенное воспаление,
оксидативный стресс, и альтернативные пути вовлечения в процесс реакций
врожденного и адаптивного иммунитета [33, 34].
Как показали последние исследования, и при тяжелой астме у детей и подростков
также выявляются различные молекулярные фенотипы, не только Th2-обусловленные,
но и фенотип, который не имеет четкого Th1- или Th2-паттерна [27, 35]. К такому
молекулярному фенотипу относится детская и подростковая астма, ассоциированная с
ожирением [36, 37]. Тучные девочки имеют повышенный риск и более серьезные
симптомы астмы, чем мальчики. Было обнаружено, что астма у детей,
ассоциированная с ожирением, отличается от атопической астмы и характеризуется
Th1-поляризацией [38, 39].
Исследование экспрессии рецепторов врожденного иммунитета у детей-астматиков
с ожирением и нормальным весом показало, что у тучных пациентов, страдающих
астмой, выявляются более высокие уровни TLR2 и TLR9 по сравнению с другими
астматиками. В этом пуле тучных астматиков с высокой экспрессией Toll-рецепторов
отмечено снижение продукции Th1-цитокинов и выявлена только тенденция к
увеличению профиля Th2-ответа. То есть эти пациенты не соответствовали ни одному
из фено/эндотипов, описанных выше. Авторы этого первого исследования,
показывающего высокую экспрессию TLR2 и TLR9 у тучных детей с астмой, считают,
что необходимо изучение других цитокинов в этой группе, чтобы понять, насколько
полученные дополнительные характеристики соответствуют уже известным описанным
фенотипам или эти пациенты могут быть выделены в отдельный эндотип [40].
Отсутствие четких критериев для выбора эффективных терапевтических
вмешательств, неопределенность патобиологических процессов, вовлеченность в
процесс реакций врожденного и адаптивного иммунитета позволили авторам описанный
фенотип отнести к детской астме, трудной для лечения.
За последние годы стремительно растет число исследований фено/эндотипов
астмы. Основной акцент падает на пациентов с тяжелой астмой, из-за ее серьезного
клинического и социально-экономического бремени. Многие из фенотипов астмы
выявляются в разных возрастных группах, в том числе и у подростков.
На рис. 2 представлен возможный спектр сочетаний клинических кластеров
бронхиальной астмы в разные возрастные периоды (дети, подростки, взрослые)
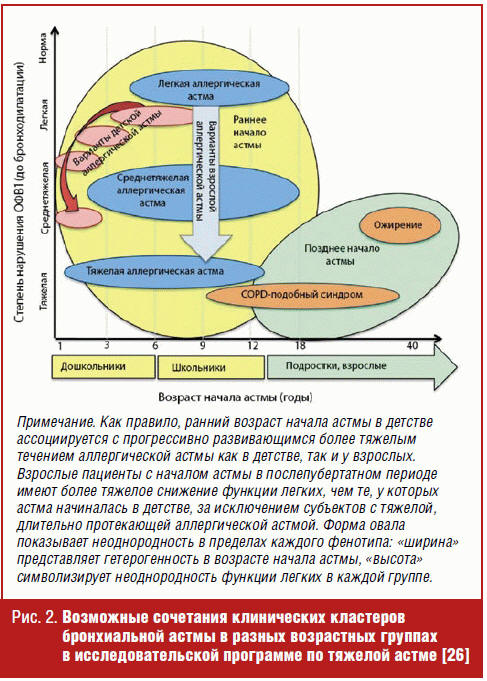
Несмотря на большое число публикаций по развитию аллергии и астмы, пока не
удается связать в единую концепцию и стройную систему представлений полученные
результаты, в связи с чем в этом поле исследований активно развиваются
мегапроекты, которые направлены на снижение такой фрагментации.
Для успешной клинической практики при ведении подростков с гетерогенными
фенотипами астмы требуется систематизированная оценка функции внешнего дыхания.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru






