Содержание статьи
Введение
Стопа Шарко, или диабетическая остеоартропатия (ДОАП), описана более двух столетий назад, но она до сих пор является наиболее трудной для диагностики и непредсказуемой по течению формой синдрома диабетической стопы (СДС). ДОАП сопровождается высоким уровнем ампутаций и летальности, а также значительно повышает процент инвалидизации пациентов с СДС [1, 2].
Ошибки в диагностике ДОАП связаны с недостаточной осведомленностью врачей, не специализирующихся на лечении СДС, об этом патологическом состоянии, а также с отсутствием специфичных клинических признаков и тестов лабораторной диагностики [3, 4]. Особую трудность представляет верификация тех форм ДОАП, которые осложнены остеомиелитом [5, 6].
Ряд авторов считает, что «золотым стандартом» диагностики остеомиелита является биопсия кости, так как она обеспечивает получение гистологических и микробиологических данных [7, 8]. Патогистологические изменения являются составной частью нескольких шкал для диагностики остеомиелита у пациентов с сахарным диабетом (СД) [9–11]. Однако, по данным A. Tiemann et al. [12], корреляция между предоперационным клиническим и окончательным патогистологическим диагнозом составляет всего 68%. Ряд авторов указывает на низкую чувствительность и низкую специфичность патогистологического исследования для диагностики остеомиелита на фоне ДОАП, что связано со схожестью некоторых морфологических признаков этих двух процессов [13, 14].
Другой проблемой является субъективность трактовки патоморфологами обнаруженных изменений. Так, в работе A.J. Meyr et al. [7] приводятся данные о заключениях 4 врачей-патологов, которым при исследовании 39 образцов ткани требовалось независимо друг от друга исключить, предположить или подтвердить диагноз остео-
миелита при СДС. Совпадения результатов были зарегистрированы только в 13 (33,33%) случаях.
Отсутствие стандартизированной оценки морфологических критериев остеомиелита свидетельствует о необходимости разработки четкого, комплексного подхода, основанного на совокупности признаков представленных в балльной, а не в описательной форме. Наиболее объективной считается предложенная A. Tiemann et al. [12] шкала гистопатологического счета остеомиелита (Histopathological Osteomyelitis Evaluation Score, HOES). Вопрос патогистологических изменений при ДОАП и остеомиелите обсуждается российскими авторами редко. Сведений о применении шкалы HOES в отечественной клинической практике нами в литературе не найдено [15–18].
Цель исследования: оценить клиническую значимость патогистологического исследования при остеомиелите костей стопы на фоне ДОАП.
Материал и методы
Материалом исследования послужили данные 17 пациентов (9 мужчин и 8 женщин; средний возраст — 49,1 года) с клиническими, лабораторными и инструментальными признаками остеомиелита на фоне ДОАП [18], на основании которых пациенты были направлены на оперативное лечение, а также операционный материал этих пациентов, полученный в ходе резекционных вмешательств.
Из 17 пациентов СД 1 типа был у 6 (средний возраст — 42,2 года, стаж СД 1 типа — 26 лет); СД 2 типа — у 11 (средний возраст — 52,6 года, стаж СД — 9,2 года). Средний стаж ДОАП до развития осложнений составил 2,14 года, но в большинстве случаев признаки осложненной ДОАП проявлялись в течение 1 года. У 4 пациентов остеомиелит развился на фоне хронической ДОАП, у остальных — на фоне острой/подострой ДОАП. Провоцирующими факторами развития артропатии послужили в 2 случаях травмы, в остальных — перенесенная в анамнезе инфекция диабетической стопы.
В зависимости от анамнеза заболевания (тип и стаж СД, наличие/отсутствие язвенных дефектов в анамнезе, наличие/отсутствие оперативных вмешательств, травм в анамнезе), жалоб пациента, местного статуса, лабораторных показателей и данных визуализирующих методик, согласно нашему алгоритму, пациенты исходно разделены на 3 группы [19]: 1-я — острый остеомиелит / обострение остеомиелита (n=12); 2-я — хронический остеомиелит вне обострения (n=2); 3-я — ДОАП + инфекция мягких тканей (n=3). Преимущественными зонами поражения были средний и задний отделы стопы (n=16). При этом у пациентов из 2-й группы имелась деформация стоп, в связи чем они были направлены на операцию с целью выполнения артродеза. У пациентов из 3-й группы были признаки инфекции мягких тканей в сочетании с поражением кости, но с низкой клинической вероятностью острого остеомиелита.
Операционный материал фиксировали в 10% нейтральном забуференном формалине 12–24 ч. Проводили макроскопическое описание резектатов. В каждом случае забирали от 3 до 7 кусочков тканей для проведения стандартного гистологического исследования. Проводка (процесс обезвоживания и пропитки тканей парафином) материала, создание парафиновых блоков, микротомирование и окрашивание срезов с последующим заключением под пленку осуществляли на оборудовании Sakura. Гистологические срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону. Гистологические препараты исследовали на бинокулярном светооптическом микроскопе Nikon Eclipse 50i при увеличении ×5, ×10, ×20, ×40.
Все пациенты пронумерованы от № 1 до № 17. Проведена балльная оценка изменений по HOES [12]. Так же как и авторами этой шкалы, нами были выделены ключевые признаки острого остеомиелита (А-1 — остеонекроз; А-2 — некроз мягких тканей; А-3 — гранулоцитарная инфильтрация) и признаки хронического остеомиелита (С-1 — костный нео-
генез и фиброз; С-2 — лимфоцитарная, макрофагальная инфильтрация). Для каждого критерия оценивали степень его выраженности по шкале от 0 до 3 баллов. Оценка проведена в полуколичественном режиме, где 0 — нет изменений, 1 — изменения легкие (занята одна треть секционной области); 2 — умеренные (две трети секционной области); 3 — тяжелые (вся область). Сумма баллов А1–А3: ≥4 была признаком острого остеомиелита; А1–А3 и С1–С2: ≥6 — хронического выраженного (т. е. активного) остеомиелита; С1–С2: ≥4 — хронического остеомиелита; С1–С2: ≤4 — затухающего остеомиелита; С1–С2: ≤1 — отсутствие признаков остеомиелита.
Секционной областью в нашей работе была площадь покровного стекла. Для каждого случая подсчет проведен на 5 препаратах.
В последующем проведено сопоставление клинического диагноза и патогистологического заключения. Определяли чувствительность, специфичность, положительную и отрицательную прогностическую ценность шкалы HOES [20, 21].
Статистический анализ полученных данных проведен с помощью программы Statistica для Windows Версия 12.0 (Statsoft, Inc., США).
Результаты исследования
На основании результатов комплексного патогистологического исследования выделены 2 группы заболеваний: остеомиелит на фоне ДОАП и ДОАП без остеомиелита. В группу остеомиелита вошло 14 наблюдений: 13 случаев хронического остеомиелита, 1 случай острого остеомиелита на фоне ДОАП. При остеомиелите в воспалительный процесс вовлекались все структурные элементы кости и окружающие мягкие ткани. Характер и выраженность воспалительной реакции зависели от фазы заболевания.
При остром остеомиелите в костной ткани определялись очаги дистрофии, бесклеточной резорбции и секвестры разной формы. В костномозговых промежутках отмечались очаги и участки нейтрофильных гранулоцитов, полиморфноклеточная инфильтрация стенок сосудов. В окружающих мягких тканях в разной степени было выражено гнойное воспаление (рис. 1).
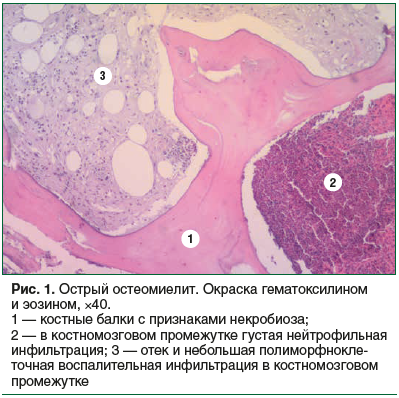
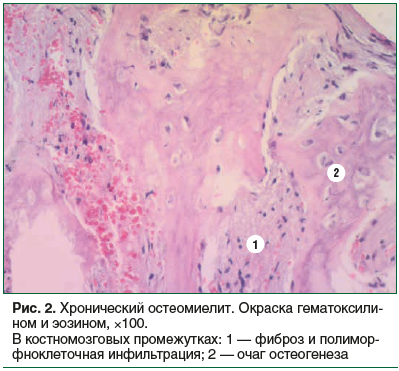
При хронической форме остеомиелита определяли костные балки неравномерной толщины, мозаичной окраски, часть остеоцитов была с нечеткими контурами. Во всех случаях определялись очаги костной резорбции. Преобладающим вариантом остеолизиса был бесклеточный, преимущественно гладкий, в одном наблюдении — пазушный; в отдельных случаях — очаги остеокластической резорбции кости. В костномозговых промежутках очаги и участки созревающей грануляционной ткани, фиброзной ткани; разной степени выраженности инфильтрация из лимфоцитов, макрофагов, плазматических клеток, фибробластов, гистиоцитов; продуктивный васкулит. Наряду с очагами деструкции костной ткани у некоторых пациентов определялись очаги остеогенеза. В окружающих мягких тканях наблюдались участки фиброза с умеренным продуктивным васку ebитом, гиперкератоз и акантоз многослойного плоского эпителия
(рис. 2).
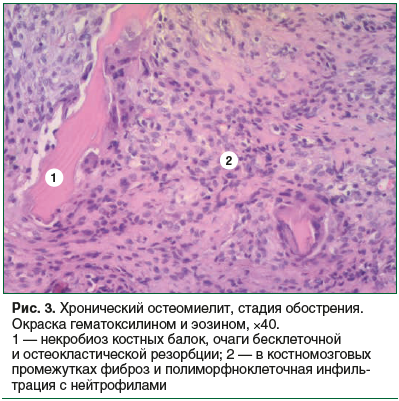
При обострении хронического остеомиелита на этом фоне определялись очаги полиморфноклеточной инфильтрации с большим или меньшим количеством нейтрофилов, с участками нейтрофильной инфильтрации. Параллельно в окружающих тканях было выявлено разной степени выраженности воспаление (рис. 3).
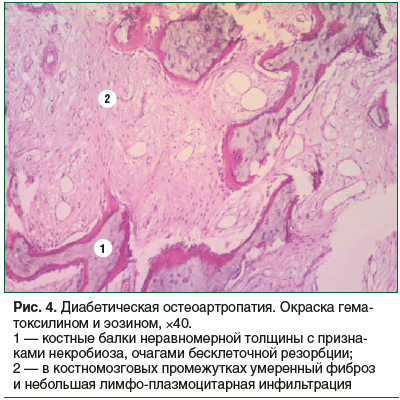
К ДОАП без признаков остеомиелита были отнесены 3 случая. Морфологическими субстратами заболевания являлась дистрофия и в той или иной степени выраженности регенераторный процесс. При ДОАП развивалась асептическая деструкция костной ткани (дистрофия, очаги бесклеточной и клеточной резорбции костной ткани) и очаги остеогенеза. В костномозговых промежутках обнаружена соединительная ткань с мононуклеарной инфильтрацией. Характерным для ДОАП было поражение суставного хряща (дистрофия, истончение и трещины) (рис. 4).
После проведения патогистологического счета получены следующие результаты (см. таблицу).
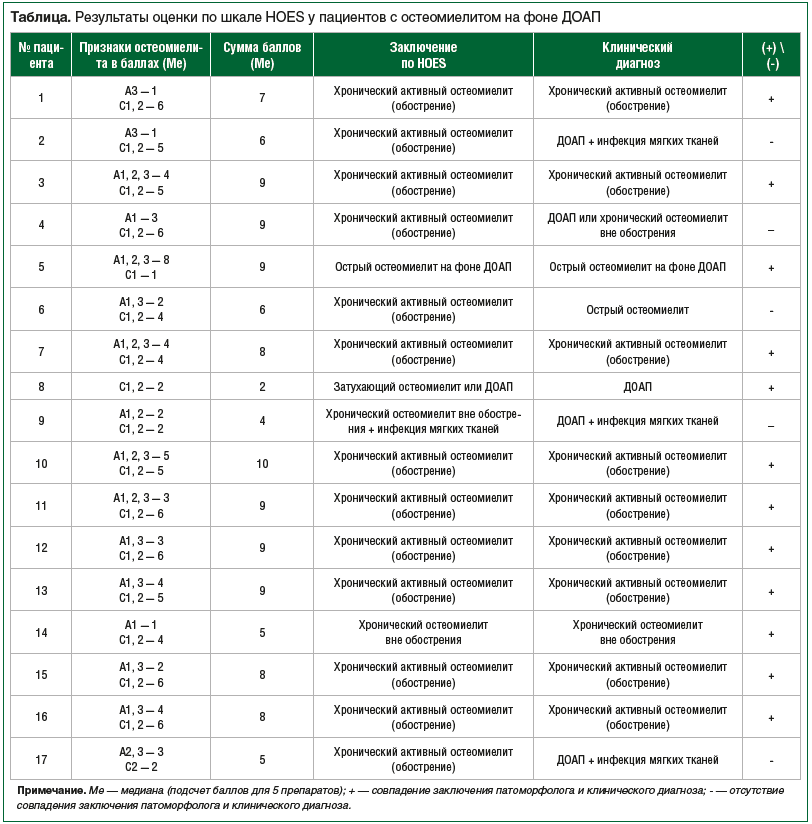
Таким образом, выявлено, что в 13 случаях по шкале HOES у пациентов были признаки обострения хронического остеомиелита (сумма баллов А1–А3 и С1–С2 от 5 до 10), в 1 случае — острый процесс (сумма баллов А1–А3≥4), в 1 случае — затухающий остеомиелит (сумма С1–С2 — 2), в 2 случаях — хронический остеомиелит вне обострения (сумма С1–С2 — 4–5). При анализе таблицы и подсчете характеристик шкалы ее чувствительность составила 68,4%, специфичность — 20%, положительная прогностическая ценность — 64,7%, отрицательная прогностическая ценность — 11,8%.
При сопоставлении клинического диагноза и патогистологического заключения мы получили следующие результаты. Пациенты из 1-й группы были разделены на 2 подгруппы: 1а — острый остеомиелит (n=2) и 1б — обострение хронического остеомиелита (n=10). В подгруппу 1а вошли пациенты, которые имели вероятные клинические признаки остеомиелита: глубокий язвенный дефект с гнойным отделяемым, видимая кость в ране, в 1 случае — гнойное отделяемое из кости. Маркеры воспаления (СОЭ и С-реактивный белок (СРБ)) были значимо повышены в обоих случаях. В первом случае деструкция таранной кости, видимая при рентгенографии, привела к деформации стопы и формированию ее подвывиха. Яркая клиническая картина не потребовала использования дополнительных визуализирующих методик. С учетом высокой Ц 2ероятности остеомиелита проведено оперативное вмешательство — резекция кости. Клинический и патоморфологический диагноз: острый остеомиелит. В последующем, через 6 мес. пациентке выполнена реконструктивная операция с формированием артродеза. Второму пациенту проведена МРТ-диагностика, выявлена совокупность МР-симптомов, характерных для остеомиелита. Выполнено оперативное вмешательство — резекция кубовидной кости в связи с ее пролабированием на подошвенную поверхность «стопы-качалки». Клинический диагноз: острый остеомиелит. Патоморфологический диагноз: обострение хронического остеомиелита. Расхождение диагнозов не повлияло на тактику ведения пациента.
Практически все пациенты подгруппы 1б (9 из 10) имели язвенные дефекты стопы. Глубокие язвы зафиксированы у 8 пациентов, однако положительный тест на зондирование кости зарегистрировали только у половины из них (n=4). Только 1 пациент не имел язвенного дефекта, но значимое повышение маркеров воспаления в сочетании с развитием острой почечной недостаточности послужило поводом для ампутации стопы по Шопару. Маркеры воспаления также были значимо повышены у половины пациентов этой группы (n=5). СЦ eвокупность МРТ-критериев не исключала наличие остеомиелита во всех случаях. Высокая вероятность остеомиелита в сочетании с деформацией стопы потребовали выполнения оперативного вмешательства.
Совпадение клинического и патогистологического диагнозов было в этой подгруппе в 9 случаях из 10. Еще в 1 случае при гистологическом исследовании был выявлен затухающий остемиелит или ДОАП. Клинически у этого пациента имелся глубокий язвенный дефект с положительным тестом на зондирование кости. Однако маркеры воспаления не были повышены, а совокупность МРТ-симптомов была недостаточно убедительна в плане остеомиелита. Пациенту были выполнены хирургическая обработка раны и интраоперационная биопсия кости.
Оба пациента из 2-й группы (хронический остеомиелит) не имели язвенных дефектов, маркеры воспаления повышены не были. На МРТ выявлен отек костного мозга, одинаково характерный для остеомиелита и активной артропатии. Так как пациенты имели деформации, затрудняющие ходьбу, им проведены резецирующие операции с формированием артродеза. Совпадение клинического диагноза с патоморфологическим было только в одном случае. У второго пациента обнаружены патоморфологические признаки обострения хронического остеомиелита с явлениями выраженного остеонекроза.
В 3-й группе (ДОАП, осложненная инфекцией мягких тканей) все пациенты имели глубокий язвенный дефект, в 1 случае был положительным тест на зондирование кости. Маркеры воспаления были повышены. В 1 случае артропатии, осложненной некротической флегмоной стопы, у пациентки на заместительной почечной терапии гемодиализом отмечено повышение уровня СРБ до 418 мкмоль/л. При МРТ во всех случаях не получено убедительных данных за остеомиелит. Двум пациентам выполнена хирургическая обработки раны, некрэктомия с интраоперационной биопсией измененной кости. В 1 случае в связи с прогрессированием гнойно-некротического процесса на фоне деформированной неопорной конечности выполнена высокая ампутация.
Обсуждение
Поводом для проведения исследования было желание уточнить диагностическую ценность патогистологической шкалы HOES для последующего ее внедрения в повседневную практику работы врача кабинета «Диабетическая стопа», так как вопросы дифференциальной диагностики остеомиелита и ДОАП (остеомиелит на фоне ДОАП) в некоторых случаях остаются без ответов. При описании патогистологических препаратов характерной особенностью ДОАП было поражение суставного хряща: дистрофия, истончение и трещины. Данную особенность подчеркивают также Т.А. Ступина и соавт. [18], которые при исследовании костно-хрящевых фрагментов суставов стоп Шарко выявили структурные изменения субхондральной кости и синовиального паннуса, что вело к необратимой деструкции хряща. Однако в повседневной клинической практике не всегда возможно исследование зоны сустава, особенно при биопсии кости.
Остальные патогистологические признаки, в частности остеонекроз, ремоделирование кости и фиброз, присущи как ДОАП, так и остеомиелиту. Клеточная инфильтрация лимфоцитами и полиморфноядерными лейкоцитами, характерная для инфекции, также выявляется и во время воспалительной фазы остеоартропатии Шарко. И наоборот, если развившаяся на фоне артопатии инфекция лечится антибиотиками, эти патогистологические признаки могут быть нивелированы [13, 14]. Следовательно, простое описание патогистологического препарата может завершиться ошибочным заключением.
Наш опыт подтверждает тот факт, что врач кабинета «Диабетическая стопа» встречается с пациентами, которые уже получали антибактериальную терапию на первичном этапе медицинской помощи. Так, в проведенном нами исследовании из 17 пациентов с ДОАП до операции ни у одного не было выявлено сразу всех признаков, характерных для остеомиелита. Клиническая картина у пациентов полноценно не укладывалась в рамки шкалы, приведенной A. Markanday (2014) [10].
Среди больных, у которых по результатам анализа шкалы НОЕS подтверждено наличие острого остеомиелита / обострение хронического остеомиелита, только у 2 до операции имелись костный фрагмент и гнойное отделяемое из раны, а также значимое повышение уровня маркеров воспаления. Этого было достаточно для постановки предоперационного диагноза острого остеомиелита с высокой степенью вероятности. У остальных пациентов диагноз остеомиелита вызывал определенные сомнения.
Поводом для оперативных вмешательств были различные обстоятельства, но, прежде всего, активную хирургическую тактику диктовало наличие глубокого язвенного дефекта с гнойным отделяемым и некрозом мягких тканей. В 2 случаях операция была выполнена по ортопедическим показаниям в связи с деформацией стопы. У 3 пациентов из-за неясности интраоперационной картины была взята биопсия кости. У остальных пациентов резекционные вмешательства выполнялись на основе предоперационных клинических и визуализирующих данных и интраоперационной ревизии кости.
Значимым морфологическим критерием остеомиелита на фоне ДОАП являлась выраженная нейтрофильная инфильтрация костного мозга. При хроническом, даже активном, остеомиелите других значимых критериев нами не найдено.
Подсчет по шкале HOES дал определенный результат, говорящий о том, что эта шкала может быть использована в качестве дополнительного инструмента диагностики, но не единственного, так как ее чувствительность составила всего 68,4%, положительная прогностическая ценность — 64,7%, а специфичность была очень низкой — 20%. В целом полученные данные согласуются с цифровыми данными и мнением авторов шкалы [11]. Подтвержденная нами очень низкая специфичность шкалы делает ее малоценной для дифференциальной диагностики между ДОАП и ДОАП + остеомиелит.
Заключение
Таким образом, с учетом схожей патогистологической картины, особенно в случае хронического остеомиелита, заключение патолога не может являться единственным критерием верификации диагноза остеомиелита на фоне ДОАП. Диагностику процесса логично строить на совокупности клинических, лабораторных и визуализирующих методик. Для дифференциальной диагностики ДОАП и остеомиелита на фоне ДОАП необходимо использовать комплекс признаков, обладающих наибольшей прогностической f6енностью, чтобы избежать необоснованных резекционных вмешательств. Эффективность проводимого лечения может быть оценена при динамическом клиническом наблюдении до конечного результата (переход острой артропатии в хроническую стадию, эпителизация трофической язвы, малые/большие ампутации и др.). Считаем целесообразным использование патогистологического исследования и шкалы HOES для ретроспективной оценки диагностической ценности неинвазивных методов диагностики ДОАП и остеомиелита на фоне ДОАП, в частности МРТ или диффузионно-взвешенной МРТ.
.
Информация с rmj.ru






