Итоги длительного наблюдения больных хроническим гастритом после эрадикации инфекции H. pylori
Т.Л. Лапина1, А.С. Тертычный2, Э.Р. Насретдинова1, И.М. Картавенко1, А.В. Параскевова1, Е.Ю. Юрьева1, О.А. Сторонова1, А.С. Трухманов1, В.Л. Ивашкин1
1 Кафедра пропедевтики внутренних болезней лечебного факультета и НИО инновационной терапии ГБОУ ВПО «Первый государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Российская Федерация
2 Кафедра патологической анатомии ГБОУ ВПО «Первый государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Российская Федерация
Лапина Татьяна Львовна — кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова». Контактная информация: lapinata(а)mail.ru; 119991, Москва, ул. Погодинская, д. 1, стр. 1. Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова»
Насретдинова Эльмира Равильевна — соискатель кафедры пропедевтики внутренних болезней лечебного факультета ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова»
Nasretdinova Elmira R — doctoral candidate, Chair of internal diseases propedeutics, medical faculty, Sechenov First Moscow state medical university
Картавенко Илона Михайловна — научный сотрудник НИО инновационной терапии ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова»
Kartavenko Ilona М — research associate, Scientific and educational clinical center of innovative therapy, Sechenov First Moscow state medical university
Цель публикации. На примере клинических наблюдений проанализировать тактику длительного ведения больных хроническим гастритом после эрадикации инфекции Н. pylori для профилактики рака желудка.
Основные положения. Тактика ведения пациентов с хроническим гастритом после ликвидации Н. pylori представлена на примере больных с различным риском развития рака желудка. Через полтора года после успешной эрадикационной терапии у женщины 57 лет подтверждена легкая атрофия и кишечная метаплазия антрального отдела без атрофии и кишечной метаплазии тела желудка. При отсутствии других факторов риска возникновения рака дальнейшее эндоскопическое наблюдение не требуется. Пятилетнее наблюдение за мужчиной 62 лет после успешной эрадикационной терапии продемонстрировало стабильную морфологическую картину без прогрессирования предраковых изменений. Учитывая выраженную атрофию и кишечную метаплазию антрального отдела и легкую атрофию тела желудка, а также отягощенный семейный анамнез пациенту показано ежегодное выполнение эзофагогастроскопии с биопсией.
Заключение. Прогноз и тактика ведения больных хроническим гастритом после эрадикации инфекции Н. pylori определяются в зависимости от выраженности атрофии и кишечной метаплазии антрального отдела и тела желудка, а также другими факторами риска развития рака, например отягощенным семейным анамнезом.
Ключевые слова: хронический гастрит, Н. pylori, атрофия, кишечная метаплазия, эрадикационная терапия.
Атрофический гастрит — доказанное предраковое заболевание желудка, и этот факт открывает возможности для создания успешных программ профилактики и ранней диагностики рака желудка [1-5]. Наиболее значимым этиологическим фактором хронического гастрита служит бактерия Н. pylori. Эпидемиологические исследования и несколько мета-анализов продемонстрировали, что инфекция Н. pylori (текущая или перенесенная) ассоциирована с высоким риском развития рака желудка по сравнению с неинфицированными лицами: отношение шансов (ОШ) 2,97; 95% доверительный интервал (ДИ) 2,34-3,77 [6].
Положение о том, что атрофия и кишечная метаплазия повышают риск развития рака, было признано задолго до описания Р. Соггеа (1988) каскада патологических явлений в слизистой оболочке желудка, ведущих к карциноме кишечного типа [1]. Современные возможности диагностики предраковых изменений слизистой оболочки желудка и эрадикационной терапии Н. pylori определяют актуальный тренд таких исследований и огромное количество накопленных фактов, которые позволяют оценить прогностическую важность атрофического гастрита и кишечной метаплазии.
В когортном исследовании 4655 здоровых добровольцев с длительностью наблюдения в среднем более 7 лет было зарегистрировано 45 случаев рака желудка. Риск его развития увеличивался в зависимости от выраженности атрофии: у Н. рylori-позитивных лиц без атрофического гастрита он составил по показателю пропорционального риска (hazard rate) 7,13 (95% ДИ 0,95-53,33), у Н. рylori-позитивных лиц с атрофией — 14,85 (1,96-107,7), а при выраженной атрофии и кишечной метаплазии, когда Н. pylori уже невозможно определить, достигал 61,85 (5,6-682,64) [7]. При длительном наблюдении (в среднем около 8 лет) 1246 больных с явлениями кишечной метаплазии в слизистой оболочке желудка относительный риск карциномы составил 6,4 (95% ДИ 2,6-16,1) [8]. В европейском исследовании у 61 707 пациентов с кишечной метаплазией за 10 лет наблюдения было установлено 874 случая рака желудка (1,8%) [9].
То, что атрофический гастрит с кишечной метаплазией повышают риск рака желудка, для многих врачей стало аксиомой. Тем не менее практическое ведение пациентов с атрофическим гастритом вызывает целый ряд затруднений. Возникают вопросы, связанные с оценкой опасности выявленных изменений и медицинским прогнозом, необходимостью повторных эндоскопических исследований и взятия биоптатов, временным интервалом эндоскопического наблюдения, интерпретацией показателей пепсиногена I, пепсиногена II и гастрина 17 в сыворотке крови, целесообразностью назначения других методов исследования.
Целью настоящей публикации служит анализ тактики длительного ведения больных хроническим гастритом после эрадикации инфекции Н. pylori для профилактики рака желудка на примере клинических наблюдений.
Клиническое наблюдение № 1
Больная X. 57 лет поступила в Клинику пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ПМГМУ им. И.М. Сеченова с жалобами на ноющие боли в эпигастрии без четкой связи с приемом пищи, ощущение распирания после еды. Эти жалобы появились в 2012 г. В августе того же года обратилась в поликлинику по месту жительства, где была выполнена эзофагогастродуоденоскопия (ЭГДС), при которой сделано заключение о поверхностном гастрите и отмечена гиперплазированная складка в препилорическом отделе желудка, из которой взят биоптат. В биоптате выявлены умеренная атрофия и явления тонкокишечной метаплазии.
Пациентка самостоятельно стала искать информацию об атрофическом гастрите, в интернете прочитала о том, что атрофический гастрит служит предраковым заболеванием, а кишечная метаплазия — это предраковое изменение слизистой оболочки желудка. Больная восприняла эти сведения очень эмоционально, испугавшись, что она обязательно заболеет раком желудка. Обратилась в поликлинику по месту жительства и настояла на назначении ей лечения по устранению Н. pylori.
В декабре 2012 г. был проведен 10-дневный курс эрадикационной терапии пантопразолом (Нольпаза®), амоксициллином и кларитромицином (Фромилид®). Несмотря на удовлетворительное самочувствие, беспокойство не оставляло пациентку, и в феврале 2012 г. она обратилась с просьбой о проведении повторной ЭГДС. Заключение после выполненного исследования: поверхностный гастрит, гиперплазированная складка в препилорическом отделе, при повторной биопсии из этой области — умеренно выраженный хронический гастрит.
Больная продолжала искать возможность консультации у гастроэнтеролога, так как хотела предотвратить развитие рака желудка и определить необходимый интервал проведения гастроскопии и биопсии. В сентябре 2013 г. обратилась в Клинику пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ПМГМУ им. И.М. Сеченова.
Обследование в Клинике было направлено на то, чтобы дать оценку риска возникновения рака желудка и создать адекватную индивидуальную программу профилактики для конкретного случая. В первую очередь, следовало определить, успешно ли прошла эрадикационная терапия в 2012 г. Необходимо было установить, есть ли иные факторы риска рака желудка, кроме инфекции Н. pylori, например курение, профессиональные вредности, наследственная предрасположенность [10].
Для оценки атрофии и кишечной метаплазии слизистой оболочки желудка недостаточно биопатата лишь из гиперплазированной складки антрального отдела. Требуется проведение ЭГДС с биопсией минимум из пяти точек (по большой и малой кривизне антрального отдела, по малой кривизне в области incisura angularis, по большой и малой кривизне проксимального отдела тела желудка) с последующей оценкой прогноза по системе OLGA. Прогностическая система OLGA (Operative Link for Gastritis Assessment) предложена для облегчения диагностики и стандартизации определения прогноза хронического гастрита, в первую очередь для оценки риска развития рака желудка. Этот подход предусматривает использование визуально-аналоговой шкалы Сиднейской классификации. Для определения стадии гастрита соотносят гистологическую выраженность атрофии с ее топографией: стадия 0 означает минимальный риск канцерогенеза, а стадия IV — соответственно максимальный [11, 12].
13С-уреазный дыхательный тест у пациентки был отрицательным, что свидетельствовало об успешности эрадикационной терапии, проведенной в 2012 г. При ЭГДС в сентябре 2013 г.: пищевод проходим, зубчатая линия выражена, кардия смыкается не плотно. Складки желудка рельефные, невысокие, расположены продольно. Слизистая оболочка пятнисто гиперемирована в антральном отделе. Угол желудка не изменен. Привратник проходим. Луковица двенадцатиперстной кишки не деформирована. Гистологическое заключение при исследовании биоптатов тела желудка: хронический, слабо выраженный, неактивный поверхностный гастрит. В антральном отделе в собственной пластинке минимальный лимфоплазмоцитарный инфильтрат. В одном из биоптатов очаги кишечной метаплазии общей площадью не более 5%. При исследовании биоптатов из угла желудка — хронический, слабо выраженный, неактивный поверхностный гастрит. Отсутствие признаков гистологической активности служит косвенным признаком, подтверждающим эрадикацию Н. pylori. Сформулирован клинический диагноз: функциональная диспепсия, хронический гастрит с легкой атрофией антрального отдела — Н. pylori-негативный после эрадикационной терапии в 2012 г.
Таким образом, атрофии антрального отдела по анализу двух биоптатов антрального отдела и биоптата из угла желудка (атрофия не более 5%) присваиваем 1-ю степень (легкая атрофия), что при отсутствии атрофии тела желудка (нулевой уровень) соответствует I стадии по системе OLGA. Это минимальная стадия атрофического гастрита. Согласно рекомендациям экспертов — авторов системы OLGA, программы эндоскопического наблюдения должны быть применены для пациентов с III-IV стадиями атрофии, отличающимися максимальным риском рака желудка [11, 12].
Успешная эрадикация инфекции Н. pylori у больной с минимально выраженной атрофией антрального отдела желудка определяет благоприятный прогноз в данном клиническом наблюдении. Больная не курит, у нее нормальный индекс массы тела (ИМТ), отсутствует влияние профессиональных вредностей, нет близких родственников, которым установлен диагноз рака желудка. То есть основные факторы риска развития рака отсутствуют. Требуется ли пациентке периодические эндоскопические наблюдения с проведением биопсии? По заключению Европейского общества гастроинтестинальной эндоскопии в настоящее время нет доказательств, чтобы рекомендовать их больным с легкой и умеренной атрофией или кишечной метаплазией слизистой оболочки, ограниченной только антральным отделом желудка [13]. Таким образом, наблюдаемая пациентка не нуждается в периодических эндоскопических осмотрах, ей необходимо следовать общим гигиеническим рекомендациям по соблюдению здорового образа жизни.
Клиническое наблюдение № 2
Пациент X. 65 лет поступил в Клинику пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ПМГМУ им. И.М. Сеченова с жалобами на боль в эпигастрии без четкой связи с приемом пищи, боль в правом подреберье, как правило, после еды, отрыжку воздухом, вздутие и урчание в животе, беспокоящими в течение более пяти лет.
В 2009 г. при амбулаторном обследовании проведена ЭГДС, состояние расценено как «гастродуоденит». Принимал висмута трикалия дицитрат с положительным эффектом, который проявлялся в уменьшении симптомов диспепсии.
С ноября 2010 г. вновь отметил усиление боли в эпигастрии, после выполненной ЭГДС сделано заключение об Н. рylori-ассоциированном гастрите с лимфоидной гиперплазией. Проведена 10-дневная стандартная тройная терапия пантопразолом (Нольпаза®) 40 мг 2 раза в сутки в сочетании с кларитромицином (Фромилид®) 500 мг 2 раза в сутки и амоксициллином 1000 мг 2 раза в сутки, усиленная висмута трикалия дицитратом. Впервые был госпитализирован в гастроэнтерологическое отделение Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ПМГМУ им. И.М. Сеченова в ноябре 2010 г. и с тех пор наблюдается в ней с плановыми госпитализациями в 2011, 2013 и 2014 гг. Провести диагностику на наличие Н. pylori для оценки эффективности эрадикационной терапии удалось в 2011 г., так как в 2010 г. соответствующие тесты решено было не применять в связи с приемом ингибиторов протонной помпы (ИПП) по поводу диспептических жалоб. Быстрый уреазный тест и 13С-уреазный дыхательный тест оказались отрицательными.
Таким образом, мы представляем итоги пятилетнего наблюдения за пациентом с гастритом после устранения инфекции Н. pylori и продемонстрируем сравнительные результаты обследования.
Пациент родился в 1948 г. Работал инженером-строителем. Влияния профессиональных вредностей не имел, курил с 1960 по 1970 г. по 10 сигарет в день, употреблял спиртные напитки по 200 г. 3 раза в неделю, с 2003 г. прием алкоголя отрицает. Страдает гипертонической болезнью, регулярно принимает бисопролол по 2,5 мг. Наследственный анамнез: мать умерла в возрасте 64 лет от острого нарушения мозгового кровообращения, отец умер в возрасте 75 лет от рака желудка.
При поступлении в Клинику в ноябре 2014 г. состояние удовлетворительное. ИМТ — 25 кг/м2. Кожные покровы нормальной окраски, чистые, умеренной влажности. Дыхание везикулярное, хрипов нет, частота дыхания — 16 в минуту. Тоны сердца ясные, ритм правильный, частота сердечных сокращений — 72 в минуту. АД — 130/80 мм рт. ст. Живот мягкий, болезненный в эпигастрии. При пальпации слепая кишка безболезненная, определяется урчание, сигмовидная ободочная кишка гладкая, эластичная, болезненная. Печень не выступает из-под края реберной дуги, селезенка не пальпируется.
В общем анализе крови (19.11.2014): Нb — 166 г/л, эритроциты — 4,9х1012/л, гематокрит — 47,35%, объем эритроцита (MCV) — 96,6 фл, цветовой показатель — 1,02; лейкоциты — 8,57х109/л, сегментоядерные нейтрофилы — 62,6%, лимфоциты — 28,6%, моноциты — 6,7%, эозинофилы — 1,6%, базофилы — 0,6%, тромбоциты -183,4х109/л, СОЭ — 6 мм/ч. В биохимическом анализе крови: общий белок — 77 г/л, альбумин — 49 г/л, железо — 23,4 мкмоль/л, щелочная фосфатаза — 124 ЕД/л, АлАТ — 21 ЕД/л, Ac AT — 21 ЕД/л, глюкоза 5,5 ммоль/л, креатинин — 1,1 мг/дл, общий билирубин — 19,4 мкмоль/л, амилаза — 55,4 ЕД/л.
Цветовой показатель в 2010, 2011 и 2013 гг. составлял соответственно 1,03, 0,99 и 1,03, MCV 98,5, 99,2 и 96,8 фл. Для объяснения тенденции к макроцитозу мы исключали дефицит витамина В12 и фолиевой кислоты. В 2013 г. показатель фолиевой кислоты равнялся 14 нмоль/л, уровень витамина В12 был снижен — 128 пмоль/л (при норме 142-725), после курса цианкобаламина в 2014 г. он повысился до 199 пмоль/л. В качестве основной причины дефицита В12 мы рассматривали атрофический гастрит тела желудка, аутоиммунная природа которого была исключена (антитела к париетальным клеткам желудка и внутреннему фактору не обнаружены).
При оценке результатов УЗИ органов брюшной полости констатирован билиарный сладж. Фиброколоноскопия проведена в ноябре 2013 г.: в сигмовидной ободочной кишке выявлены мелкие дивертикулы до 0,4 см без воспалительных изменений слизистой оболочки. Для исключения мальабсорбции витамина В12 в рамках синдрома избыточного бактериального роста проведен дыхательный водородный тест — результат отрицательный.
Эндоскопическая картина за время наблюдения существенно не менялась. При ЭГДС от 21.11.2014 г. пищевод свободно проходим, слизистая оболочка розовая. Кардия смыкается полностью. В просвете желудка умеренное количество желчи. Слизистая оболочка неравномерно окрашена, складки ее невысокие, ровные; в нижней трети желудка гиперемирована и истончена, там же видны множественные очаги кишечной метаплазии. Привратник округлой формы. Луковица двенадцатиперстной кишки средних размеров, слизистая оболочка гиперемирована, постбульбарный отдел проходим. Область большого дуоденального сосочка визуально не изменена. Заключение: гастрит с атрофией слизистой оболочки и наличием кишечной метаплазии, дуоденогастральный рефлюкс.
В 2010, 2011, 2013 и 2014 гг. была выполнена биопсия из пяти точек для оценки прогноза по системе OLGA. В 2010 г. в антральном отделе выявлена атрофия и кишечная метаплазия, занимающая 100%, 80% и 40% площади биоптатов, в теле желудка — поверхностный гастрит с очаговым кистозным расширением просвета отдельных желез по типу полипа фундальных желез. В 2011 г. — атрофия антрального отдела с распространенной кишечной метаплазией (100%, 100% и 0%), материал тела желудка скудный. В 2013 г. в антруме — хронический атрофический гастрит с распространенной кишечной метаплазией (более 90% и более 75% площади биоптатов) — рис. 1 а, б; в теле желудка — хронический поверхностный гастрит с очаговым кистозным расширением просвета отдельных желез по типу полипа фундальных желез — рис. 2 а, б. В 2014 г. в материале из антрального отдела и угла желудка — хронический атрофический гастрит с диффузной кишечной метаплазией (до 100%). В биоптате из верхней трети тела желудка по малой кривизне -хронический слабо выраженный поверхностный гастрит с одиночными мелкими кистами и мелкими лимфоидными скоплениями, по большой кривизне — хронический атрофический гастрит (убыль желез до 50%) с очаговой пилорической метаплазией и формированием лимфоидных скоплений.

Рис. 1. Гистологическое исследование антрального отдела желудка (2013 г.): а — х100, окраска гематоксилином и эозином; б — х100, окраска гематоксилином и эозином
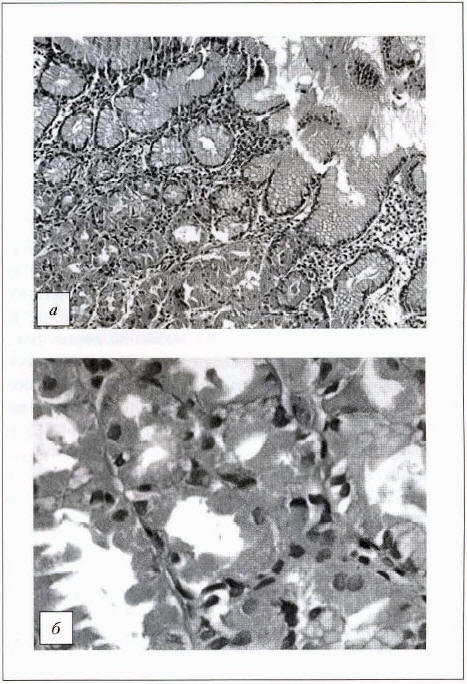
Рис. 2. Гистологическое исследование тела желудка (2013 г.): а — х100, окраска гематоксилином и эозином; б — х400, окраска гематоксилином и эозином
Сывороточные маркёры состояния слизистой оболочки коррелируют с морфологическими данными и позволяют оценить функциональные возможности желудка [14]. Пепсиноген I находится в пределах нормальных значений — 64,6 мкг/л (N 30-165), пепсиноген II — 3,4 мкг/л (N 3-15), соотношение пепсиногена I/II — 19 (N 3-20). Таким образом, атрофия тела желудка не имеет функционального эквивалента в виде снижения показателей сывороточного пепсиногена I и соотношения пепсиногена I/II. Гастрин 17 был низким — 1,2 пмоль/л (N1-10), гастрин 17 стимулированный — 17 пмоль/л (N 5-30), что свидетельствует об атрофии антрального отдела. Анти-H. pylori IgG — 37 ЕД (N 0-30), что отражает длительную циркуляцию антител после эрадикации инфекции.
По данным 24-часовой рН-метрии желудка (рис. 3), регистрируется нормацидность, время с рН в теле желудка <4 составляет 40%. Имеется кратковременный дуоденогастральный щелочной рефлюкс в ночные и утренние часы, время с рН >7 в теле желудка — 6,3%.
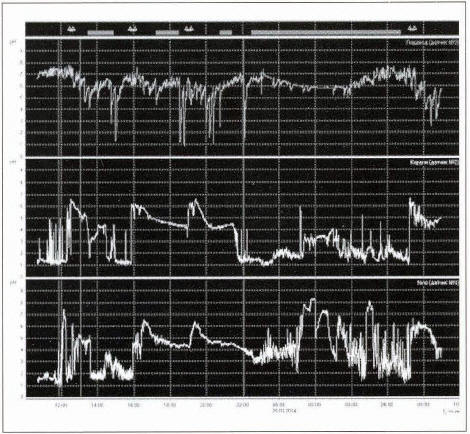
Рис. 3. 24-часовое мониторирование рН в пищеводе и желудке
Был сформулирован клинический диагноз: хронический гастрит с выраженной атрофией и кишечной метаплазией антрального отдела и легкой атрофией тела желудка — H. pylori-негативный после курса эрадикационной терапии в 2010 г. Дивертикулы толстой кишки, без признаков дивертикулита. Гипертоническая болезнь II стадии. Атеросклероз аорты, коронарных артерий.
Таким образом, у пациента с успешно проведенной эрадикацией Н. pylori наблюдается достаточно стабильная морфологическая картина: атрофия и кишечная метаплазия антрального отдела и тела желудка спустя пять лет после устранения инфекции не прогрессируют. Это ожидаемый результат. Согласно нашим данным, гистологическое исследование через полтора года после успешной антигеликобактерной терапии показало, что регресс атрофии не достигнут, но прогрессирования процессов атрофии и кишечной метаплазии нет [15]. Одно из положений доклада согласительной конференции Европейской группы по изучению Helicobacter (Маастрихтский консенсус IV) гласит, что эрадикация Н. pylori ликвидирует воспалительный ответ и замедляет, а возможно, и останавливает прогрессирование атрофии. Предполагается, что в некоторых случаях ликвидация инфекции даже может привести к обратному развитию атрофии [2].
Следует отметить адекватный подбор лекарственных препаратов для многокомпонентной схемы эрадикационной терапии в 2010 г., который обеспечил уничтожение Н. pylori и длительное положительное влияние на слизистую оболочку желудка, что мы можем сейчас констатировать. Такой ИПП, как пантопразол, представленный на отечественном фармацевтическом рынке препаратом Нольпаза®, служит классической основой для режимов эрадикационной терапии. Так, в мета-анализе (n>500 пациентов) эффективность тройной схемы лечения с пантопразолом составила 83% [16]. Пантопразол отличается высокой безопасностью из-за крайне низкой вероятности наступления лекарственного взаимодействия. Это объясняется низкой аффинностью препарата к цитохрому Р-450 (гораздо ниже, чем у омепразола) и особенностями биотрансформации [17]. Современная тенденция эрадикационной терапии, направленная на повышение ее эффективности, связана с назначением 4 препаратов. Выбор схемы с пантопразолом, усиленной висмутом трикалия дицитратом [18], у пациента, находящегося на гипотензивной терапии, обеспечил эффективность четырехкомпонентного режима с минимальным риском лекарственного взаимодействия.
Атрофия тела желудка в рассматриваемом наблюдении по данным морфологического исследования выражена незначительно. Минимальная атрофия подтверждена также нормальным уровнем сывороточного пепсиногена I, соотношением пепсиногена I/II и результатами 24-часовой рН-метрии, при которой не выявлено гипохлоргидрии. Интересно подчеркнуть, что даже минимальная атрофия тела желудка, вероятно, смогла стать причиной снижения уровня витамина В12, что потребовало назначения цианкоболамина с последующей нормализацией показателей.
Вместе с тем оценка по системе OLGA указывает на неблагоприятный индивидуальный прогноз, особенно с учетом отягощенного наследственного анамнеза. Принимая во внимание выраженную атрофию антрального отдела желудка (степень 3) и легкую атрофию тела желудка (степень 1), у нашего пациента диагностируется IV стадия по системе OLGA, что соответствует высокому риску развития рака желудка (увеличен в 5-6 раз) [11, 12]. Это, безусловно, свидетельствует о необходимости периодических эндоскопических осмотров. Согласно рекомендациям Европейского общества гастроинтестинальной эндоскопии, больным с выраженной атрофией и/или кишечной метаплазией (например, атрофией и/или кишечной метаплазией антрального отдела и тела желудка) должно быть предложено эндоскопическое наблюдение раз в три года [13]. У наблюдавшегося нами пациента имеются обстоятельства, усугубляющие отмеченный риск. Доказано, что наличие близких родственников, больных раком желудка, увеличивает риск онкологического заболевания (ОШ 1,98, 95% ДИ 1,36-2,88) [19]. С учетом отягощенного наследственного анамнеза по раку желудка мы предложили больному проходить ЭГДС с морфологическим контролем 1 раз в год.
В качестве ключевых положений, важных для ведения пациентов с хроническим гастритом, перечислим следующие.
Эрадикация Н. pylori — необходимая мера, позволяющая предотвратить или замедлить прогрессирование предраковых изменений слизистой оболочки желудка. Во всех случаях ведения больных хроническим гастритом следует убедиться в том, что эрадикационная терапия прошла успешно и инфекция Н. pylori устранена.
Невозможно установить полный диагноз гастрита и определить прогноз исходя из данных единичной биопсии. Требуется взятие биоптата минимум из пяти точек, что позволяет объективно оценить состояние слизистой оболочки тела и антрального отдела желудка, сформулировать правильный диагноз и оценить прогноз.
Частота и временные интервалы эндоскопического наблюдения зависят от выраженности атрофии и кишечной метаплазии слизистой тела и антрального отдела желудка.
Серологические маркёры пепсиноген I, пепсиноген II, гастрин 17 могут быть полезными для оценки состояния слизистой оболочки желудка конкретного пациента и дополнять данные морфологического исследования.
Список литературы
1. Correa P., Blanca Piazuelo M. The gastric precancerous cascade. J Clin Exp Pathol 2013; 3:147.
2. Malfertheiner P., Megraud F., O’Morain C, et al. Management of Helicobacter pylori infection — the Maastricht IV / Florence Consensus Report. Gut 2012; 61:646-664.
3. Баранская Е.К., Ивашкин В.Т. Клинический спектр предраковой патологии желудка. Рос. журн. гастроэнт. гепатол. колопроктол. 2002; 12 (3):7-14.
3. Baranskaya Ye.К., Ivashkin V.T. Clinical spectrum of premalignant diseases of the stomach. Ros. zhurn. gastroenterol. gepatol. koloproktol. 2002; 12(3):7-14.
4. Ивашкин В.Т., Лапина Т.Л., Шептулии А.А., Трухманов А.С, Драпкина О.М., Абдулхаков Р.А., Алексеева О.П., Алексеенко С.А., Зайцев СВ., Корочанская И.В., Курилович С.А., Маев И.В., Осипенко М.Ф., Сайфутдинов Р.Г., Сарсенбаева А.С. Практические шаги по профилактике рака желудка в Российской Федерации: алгоритм ведения пациентов с хроническим геликобактерным гастритом (Материалы и резолюция Совета экспертов, 9 декабря 2013 г.). Рос журн гастроэнт гепатол колопроктол. 2014; 24(2): 102-4.
4. Ivashkin V.T., Lapina T.L., Sheptulin A.A., Trukhmanov A.S., Drapkina O.M., Abdulkhakov R.A., Alekseyeva О.Р., Alekseyenko S.A., Zaytsev S.V., Korochanskaya N.V., Kurilovich S.A., Mayev I.V., Osipenko M.F., Sayfutdinov R.G., Sarsenbayeva A.S. Practical steps on prevention of stomach cancer in the Russian Federation: algorithm of management of chronic H.pylori-associated gastritis (Proceedings and resolution of experts panel, December, 9, 2013). Ros zhurn gastroenterol gepatol koloproktol 2014; 24(2): 102-4.
5. Park Y.H., Kim N. Review of atrophic gastritis and intestinal metaplasia as a premalignant lesion of gastric cancer. J Cancer Prev 2015;20(l):25-40.
6. Parkin D.M. The global health burden of infection-associated cancers in the year 2002. Int J Cancer 2006; 118:3030-44.
7. Ohata H., Kitauchi S., Yoshimura N., Mugitani K., I wane M., Nakarnura H., et al. Progression of chronic atrophic gastritis associated with Helicobacter pylori infection increases risk of gastric cancer. Int J Cancer. 2004;109:138-43.
8. Uemura N., Okamoto S., Yamamoto S., et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001; 345(10:784-9.
9. de Vries A.C., Kuipers E.J. Epidemiology of premalignant gastric lesions: implications for the development of screening and surveillance strategies. Helicobacter. 2007; 12(suppl 2):22-31.
10. Yoon H., Kim N. Diagnosis and management of high risk group for gastric cancer. Gut Liver. 2015; 9(1):5-17.
11. Rugge M., Correa P., di Mario F., El-Omar E., Fiocca R., Geboes K. et al. OLGA staging for gastritis: a tutorial. Dig Liver Dis. 2008; 40(8):650-8.
12. Rugge M., Meggio A., Pennelli G. et al. Gastritis staging in clinical practice: the OLGA staging system. Gut 2007; 56(5): 631-636.
13. Dinis-Ribeiro M., Areia M., de Vries А.С et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Endoscopy 2012; 44(1): 74-94.
14. Iijima K., Abe Y., Kikuchi R., Koike Т., Ohara S., Sipponen P., Shimosegawa T. Serum biomarker tests are useful in delineating between patients with gastric atrophy and normal, healthy stomach. World J Gastroenterol 2009; 15(7):853-9.
15. Лапина Т.Л., Коньков М.Ю., Ивашкин В.Т., Пюрвеева К.В., Склянская О.А., Серова А.Г. Отдаленные результаты эрадикационной терапии Н. pylori при атрофическом гастрите. Врач 2009;3:47-50.
15. LapinaT.L., Kon’kovM.Yu., Ivashkin V.T., Pyurveyeva К. V., Sklyanskaya О.A., Serova A.G. Late results of H. pylori eradication at atrophic gastritis. Vrach 2009; 3:47-50.
16. Gisbert J.P., Khorrami S., Calvet X., Pajares J.M. Pantoprazole based therapies in Helicobacter pylori eradication: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2004; 16(0:89-99.
17. Steinijans V.W., Huber R., Hartmann M., et al. Lack of pantoprazole drug interactions in man: an updated review. Int J Clin Pharmacol Ther. 1996; 34 (Suppl.l):S31-50.
18. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А. и соавт. Рекомендации Российской Гастроэнтерологической Ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых. Рос журн гастроэнт гепатол колопроктол. 2012; 22(0:87-9.
18. Ivashkin УЛ., Mayev I.V., Lapina ТЛ., Sheptulin А.А. et al., Diagnostics and treatment of Helicobacter pylori infection in adults: Guidelines of the Russian Gastroenterological Association. Ros zhurn gastroenterol gepatol koloproktol 2012; 22(0:87-9.
19. Rokkas Т., Sechopoulos P., Pistiolas D., Margantinis C, Koukoulis G. Helicobacter pylori infection and gastric histology in first-degree relatives of gastric cancer patients: a meta-analysis. Eur J Gastroenterol Hepatol. 2010; 22(9): 1128-33.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru





