ИССЛЕДОВАНИЕ ЭЛЕКТРОХИМИЧЕСКОГО ОСАЖДЕНИЯ ПОКРЫТИЙ НИКЕЛЬ-ФОСФОР
ИЗ ЭЛЕКТРОЛИТОВ С РАЗЛИЧНЫМИ ИСТОЧНИКАМИ ФОСФОРА
Научная статья
Перевозников С.С.1, *, Яковлев И.В.2
1 ORCID: 0000-0002-1098-0116;
1 Научно-исследовательский институт физико-химических проблем Белорусский государственный университет, Минск, Республика Беларусь;
2 Институт катализа им. Борескова СО РАН, Новосибирск, Россия
* Корреспондирующий автор (PerevoznikovS[at]yandex.ru)
Аннотация
В работе исследована возможность электрохимического синтеза фосфидов никеля для использования в качестве катализаторов в реакциях дегидрооксигенации растительных масел. Исследованы процессы электрохимического осаждения покрытий никель–фосфор из электролитов никелирования, содержащих фосфористую кислоту или гипофосфит натрия. Получены зависимости содержания фосфора в покрытиях от концентрации фосфорсодержащего компонента. Проведено исследование катодных процессов, протекающих при осаждении сплава Ni–P методом записи поляризационных кривых. Методом рентгеноструктурного анализа исследован фазовый состав свежеосажденных покрытий Ni-P и продуктов их термического разложения, образующихся при прогреве при 350 и 420 ºС.
Ключевые слова: электрохимическое осаждение, вольтамперные кривые, рентгеноструктурный анализ, аморфная структура, покрытия никель-фосфор.
AN INVESTIGATION OF ELECTROCHEMICAL DEPOSITION OF NICKEL-PHOSPHORUS COATINGS
FROM ELECTROLYTES WITH VARIOUS PHOSPHORUS SOURCES
Research article
Perevoznikov S.S.1, *, Yakovlev I.V.2
1 ORCID: 0000-0002-1098-0116;
1 Research Institute for Physical Chemical Problems of the Belarusian State University, Minsk, Republic of Belarus;
2 Boreskov Institute of Catalysis of the Siberian Branch of the Russian Academy of Sciences, Novosibirsk, Russia
* Corresponding author (PerevoznikovS[at]yandex.ru)
Abstract
The current article investigates the possibility of electrochemical synthesis of nickel phosphides for use as catalysts in dehydro-oxygenation reactions of vegetable oils. The study explores the processes of electrochemical deposition of nickel–phosphorus coatings from nickel electroplating electrolytes that contain phosphoric acid or sodium hypophosphite. The authors obtain the dependences of the phosphorus content in the coatings on the concentration of the phosphorus-containing component. The article also contains research of the cathode processes occurring during the deposition of the Ni–P alloy by the method of recording polarization curves. The phase composition of freshly deposited Ni-P coatings and their thermal decomposition products formed during heating at 350 and 420 ° C was studied via X-ray diffraction analysis.
Keywords: electrochemical deposition, current-voltage curves, X-ray diffraction analysis, amorphous structure, nickel-phosphorus coatings.
Введение
Фосфиды никеля – семейство бинарных соединений никеля и фосфора, атомарное соотношение которых может варьироваться в широких пределах от 3:1 до 1:3 [1]. Все фосфиды никеля обладают металлическим характером проводимости, для большинства из них характерен парамагнетизм Паули. Наиболее хорошо изучены богатые никелем фазы (Ni/P > 1), нашедшие практическое применение в различных областях техники. Фосфиды никеля и композитные материалы на их основе применяются в качестве анодных материалов литий-ионных батарей [2], [4], [5], светопоглощающих поверхностей оптических приборов [6].
Большое внимание в настоящее время направлено на исследование возможности применения фосфидов никеля в области гетерогенного катализа в реакциях гидроочистки биомассы. Так, фосфиды никеля Ni3P, Ni2P и Ni5P4 являются перспективными катализаторами гидродеоксигенации [7], [8], [9], гидрообессеривания [10], [13], [15] и других процессов гидрогенации [16], [18], [19] благодаря их более высокой активности и стабильности по сравнению с катализаторами на основе металлического Ni.
На каталитические свойства фосфидов никеля большое влияние оказывают их морфология и фазовый состав. Поэтому в литературе уделяется внимание не только изучению свойств различных фаз фосфидов никеля, но и разработке методик их синтеза [5], [12], [21]. Наиболее распространенными среди них являются методики пропитки носителя соединениями никеля и фосфора с последующим их восстановлением в температурно-программируемом режиме в вакууме или восстановительной среде, используются также гидротермальные методики.
Электрохимический синтез покрытий никель–фосфор, впервые предлагаемый для получения катализаторов реакции гидродеоксигенации растительных масел, имеет ряд преимуществ, так как позволяет надежно иммобилизировать катализатор на любой токопроводящей подложке, обладает высокой скоростью проведения процесса, воспроизводимостью, масштабируемостью и не требует использования дорогостоящего оборудования. Электрохимически осажденные покрытия никель–фосфор известны и широко изучались с середины прошлого века. Однако, данные, полученные разными исследователями, о зависимости состава и свойств покрытий от условий их получения значительно отличаются и зачастую носят противоречивый характер, что свидетельствует о сложности процессов, протекающих при совместном электроосаждении никеля и фосфора. Известно, что состав покрытий никель–фосфор можно варьировать в широких пределах изменяя состав электролита и условия электроосаждения.
Методы и принципы исследования
Для исследований был выбран раствор, содержащий 180 г/л NiSO4·7H2O, 10 г/л NiCl2·6H2O, 13,6 г/л KH2PO4, 10 г/л H3PO4, 0,1 г/л лаурилсульфата натрия, 0 – 23,6 г/л фосфористой кислоты или моногидрата гипофосфита натрия. рН электролита поддерживали на уровне 2 с помощью 10 %-ного раствора серной кислоты или 2,5 М раствора гидроксида калия. Осаждение проводили на полированные до зеркального блеска пластины из алюминиевого сплава Д16 размером 25×25 мм, толщиной 5 мм. Плотность тока во всех опытах была неизменна и составляла 3 А/дм2. Содержание фосфора в покрытиях определяли с помощью рентгенофлюоресцентного спектрометра Epsilon 1 фирмы PANalytical с использованием специального программного обеспечения Stratos®, предназначенного для проведения анализа состава и толщины тонких пленок и покрытий. Поляризационные кривые записывали с помощью потенциостата ПИ-50 Pro 2 производства Elins (г. Черноголовка, РФ) с использованием стеклянной электрохимической ячейки с разделенным катодным и анодным пространствами. Прогрев образцов покрытий в сушильном шкафу Snol. Исследование фазового состава покрытий проводили с помощью дифрактометра ДРОН-3 в монохроматизированном СuКα–излучении.
Основные результаты
Проведенный анализ состава покрытий, полученных из электролитов с различной концентрацией фосфористой кислоты, показал, что введение уже 0,005 моль/л фосфористой кислоты приводит к включению в покрытие более 6 ат. % фосфора (рис. 1, кр. 1). Дальнейшее увеличение концентрации фосфористой кислоты в электролите до 0,04 приводит к быстрому росту содержания фосфора в покрытии до 16 ат. %. Последующее увеличение концентрации кислоты вплоть до 0,22 моль/л вызывает медленный рост содержания фосфора до 20 ат.%. При использовании в качестве источника фосфора гипофосфита натрия картина несколько иная: наблюдается стремительный рост содержания фосфора, которое достигает максимума (21,5 ат. %) уже при концентрации соли 0,04 моль/л и при дальнейшем введении гипофосфита натрия в электролит практически не меняется.
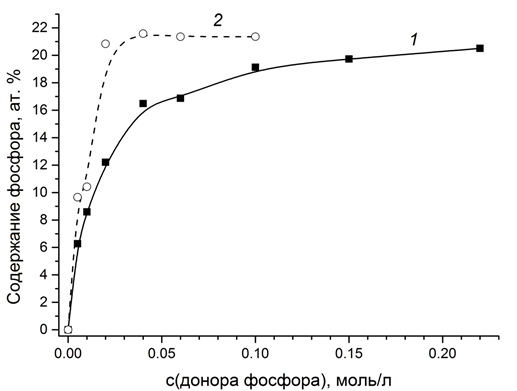
Рис. 1 – Зависимость содержания фосфора в покрытии Ni–P
от концентрации в электролите фосфористой кислоты (1) и гипофосфита натрия (2)
Для установления природы полученных закономерностей были проанализированы вольтамперные кривые, полученные для фонового электролита и для электролитов с различным содержанием источников фосфора (рис. 2). Единственным катодным процессом для фонового электролита (вместо солей никеля содержит соли натрия) является восстановление водорода, и из приведенных кривых видно, что начальные стадии этого процесса довольно сильно различаются при протекании на никелевом электроде и электроде Ni–P, а начиная с плотности тока около 12 мА/см2 становятся схожими. При замене солей натрия в фоновом электролите на соли никеля ход катодной поляризационной кривой существенно изменяется: используемая при осаждении плотность тока 30 мА/см2 достигается при гораздо меньших потенциалах (рис. 2, кр. 3), что обусловлено параллельно протекающим процессом восстановления никеля. Введение в электролит фосфористой кислоты практически не оказывает влияния на перенапряжение в области плотностей тока 25 – 45 мА/см2 (кроме электролита с ее содержанием 0,1 моль/л, (рис. 2, кр. 8)). В то же время наблюдается значительное облегчение катодных процессов, протекающих при низких плотностях тока. Причем с увеличением концентрации кислоты, значение этих плотностей тока растет и для электролита, содержащего 0,1 моль/л кислоты, облегчение катодных процессов наблюдается уже при «рабочей» плотности тока 30 мА/см2.
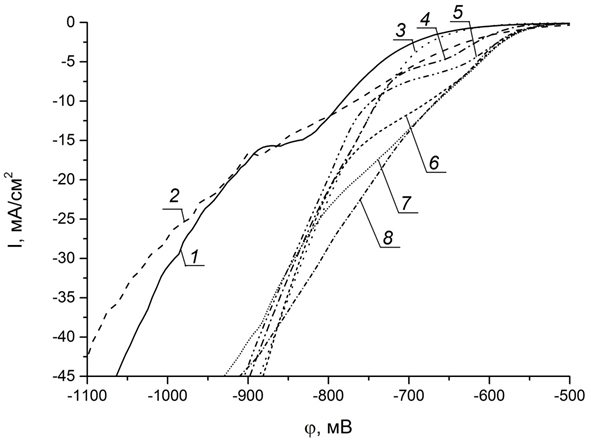
Рис. 2 – Вольтамперные кривые, полученные для фонового электролита на никелевом электроде (1)
и электроде Ni–P (2) и для электролитов, содержащих различные концентрации фосфористой кислоты (моль/л):
0 – 3; 0,005 – 4; 0,01 – 5; 0,02 – 6; 0,04 – 7; 0,06 – 8
Наблюдающуюся тенденцию можно объяснить влиянием двух факторов. Во-первых, фосфористая кислота является кислотой средней силы, и увеличение ее концентрации увеличивает буферную емкость электролита, что предотвращает подщелачивание приэлектродного слоя и снимает диффузионные ограничения при восстановлении ионов водорода. Во-вторых, развертка потенциала проводится на электродах с различным химическим составом, соответствующим содержанию фосфористой кислоты в электролите (рис. 1), а перенапряжение выделения водорода на таких электродах также может значительно отличаться. В любом случае, введение фосфористой кислоты в электролит облегчает процесс катодного выделения водорода и практически не оказывает влияния на процесс восстановления никеля.
Проведенное рентгенографическое исследование осажденных покрытий (рис. 3) показало, что осаждающееся никелевое покрытие имеет кубическую гранецентрированную решетку, является крупнокристаллическим и имеет ярко выраженную текстуру роста вдоль кристаллографических направлений 200. Включение фосфора в состав никелевого покрытия приводит к уширению дифракционных максимумов, что может быть связано как с уменьшением размера областей когерентного рассеяния, так и увеличением напряжений кристаллической решетки покрытий, также происходит перераспределение интенсивностей дифракционных максимумов, что говорит об изменении текстуры роста. При содержании фосфора в покрытии около 9 ат. % на дифрактограмме от покрытия, осажденного из электролита, содержавшего фосфористую кислоту, наблюдаются признаки формирования смешанной аморфно-кристаллической структуры (рис. 3, кр. 3). В то же время покрытие, осажденное из электролита, содержащего гипофосфит натрия и также содержащее около 9 ат. % фосфора имеет рентгеноаморфную структуру.
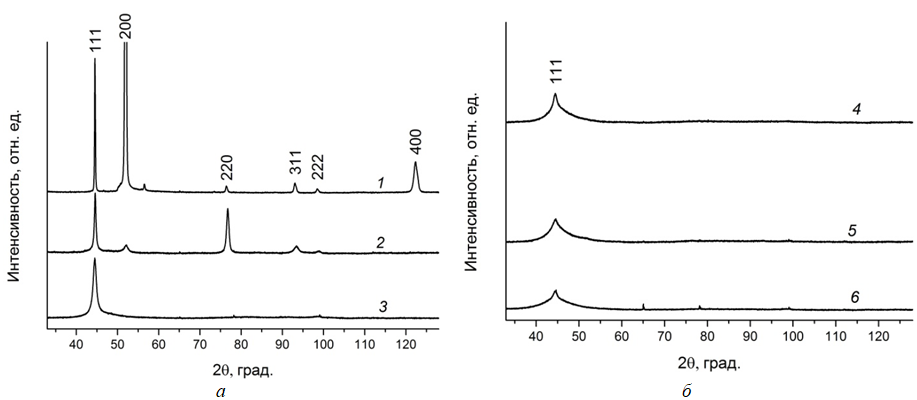 Рис. 3 – Дифрактограммы никелевого покрытия (1) и покрытий никель‑фосфор, содержащих фосфора (ат. %):
Рис. 3 – Дифрактограммы никелевого покрытия (1) и покрытий никель‑фосфор, содержащих фосфора (ат. %):
6,3 – 2; 8,6 – 3; 12,2 – 4; 9,7 – 5; 21,4 – 6, полученных из электролитов,
содержащих фосфористую кислоту (2 – 4) и гипофосфит натрия (5, 6)
Таким образом, установлено, что структура покрытия определяется не только содержанием в нем фосфора, но и способом его получения.
Для определения температур фазовых переходов в покрытиях никель–фосфор были получены кривые дифференциальной сканирующей калориметрии для покрытий с различным содержанием фосфора (рис. 4).
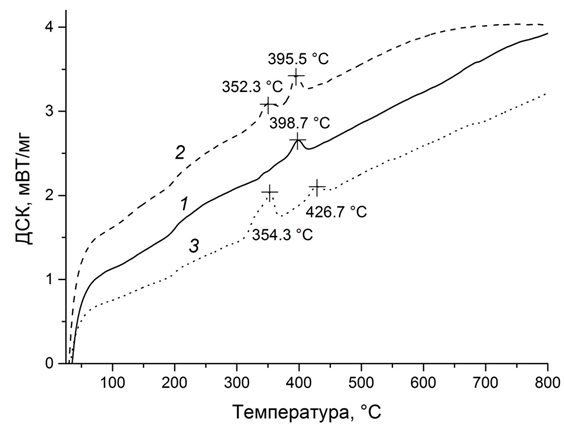
Рис. 4 – Кривые дифференциальной сканирующей калориметрии покрытий никель–фосфор
с содержанием фосфора 5,5 (1), 13,0 (2) и 21,5 (3) ат. %
На ДСК-кривой покрытия Ni–P с содержанием фосфора 6 ат. % (рис. 4, кр. 1) наблюдается единственный экзотермический пик при 398,7 °С, в то время как для покрытий с большим содержанием фосфора регистрируется также экзотермический пик при меньшей температуре 352 – 355 °С, причем чем больше содержание фосфора в покрытии, тем больше интенсивность низкотемпературного пика. Для установления природы термостимулированных процессов, протекающих при указанных температурах, был проведен прогрев покрытий с различным содержанием фосфора при температуре 350 °С и 420 °С в течение одного часа, после чего были записаны рентгенограммы указанных покрытий (рис. 5). Несмотря на то, что для покрытия, содержащего 5,5 ат. % фосфора, фазовые превращения на кривой ДСК происходят при 398,7 °С, прогрев при 350 °С приводит к полному разложению твердого раствора внедрено-замещенного типа с формированием фазы фосфида никеля Ni3P и фазы чистого никеля.
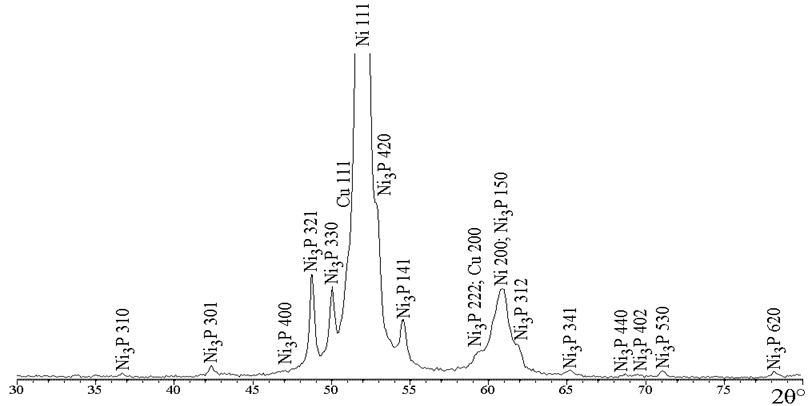
Рис. 5.1 – Фрагменты рентгеновских дифрактограмм (CoKα) покрытий Ni-Р, прогретых при 350 °С,
содержащих ат. % фосфора 5,5
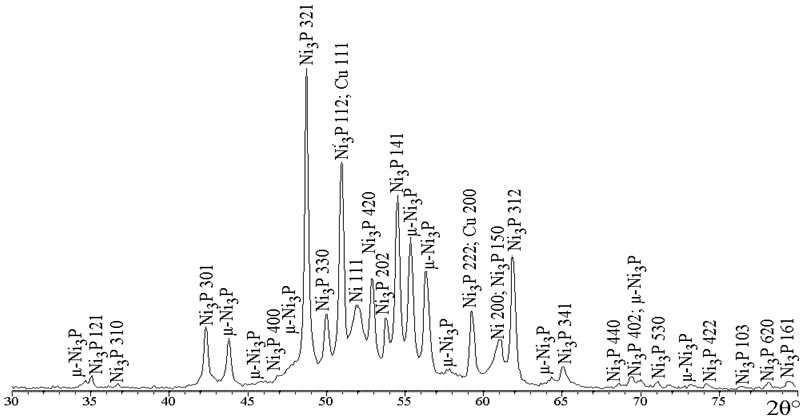
Рис. 5.2 – Фрагменты рентгеновских дифрактограмм (CoKα) покрытий Ni-Р, прогретых при 350 °С,
содержащих ат. % фосфора 13,0
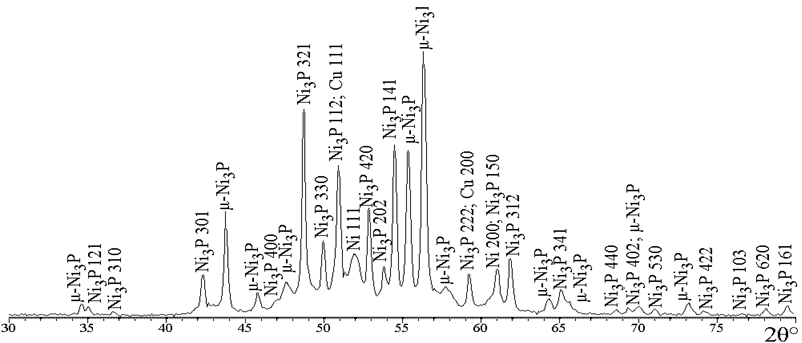
Рис. 5.3 – Фрагменты рентгеновских дифрактограмм (CoKα) покрытий Ni-Р, прогретых при 350 °С,
содержащих ат. % фосфора 21,5
Прогрев покрытий с большим содержанием фосфора при 350 °С приводит к кристаллизации фаз Ni3P, µ-Ni3P и фазы никеля, при этом, чем больше фосфора в покрытии, тем меньше относительная интенсивность фазы никеля после прогрева. Прогрев при 420 °С приводит к исчезновению линий фазы µ-Ni3P в покрытиях, содержащих 13,0 и 21,5 ат. % фосфора, а на рентгенограмме покрытия, содержащего 5,5 ат. % фосфора изменений не зарегистрировано.
Заключение
- Показано, что гипофосфит натрия является гораздо более эффективным донором фосфора по сравнению с фосфористой кислотой.
- Катодное восстановление аморфного сплава никель–фосфор протекает с меньшим перенапряжением по сравнению с восстановлением микрокристаллического покрытия Ni–P и никелевого покрытия.
- В зависимости от состава покрытий их прогрев может сопровождаться кристаллизацией фосфида никеля Ni3P или µ-Ni3P.
| Финансирование
Работы была выполнена при поддержке Белорусского республиканского фонда фундаментальных исследований, договор №Х19РМ-060 от 02 мая 2019 г. |
Funding
The work was carried out with the support of the Belarusian Republican Foundation for Fundamental Research, contract No. Х19РМ-060 dated May 02, 2019. |
| Конфликт интересов
Не указан. |
Conflict of Interest
None declared. |
Список литературы / References
- Schmetterer C. A new investigation of the system Ni–P / C. Schmetterer, J. Vizdal, H. Ipser // Intermetallics, 2009, Vol. 17, N 10, P. 826-834.
- Li G. Facile formation of a nanostructured NiP 2 @C material for advanced lithium-ion battery anode using adsorption property of metal–organic framework / G. Li, H. Yang, F. Li, et al. // Journal of Materials Chemistry A, 2016, Vol. 4, N 24, P. 9593-9599.
- Fullenwarth J. NiP 3 : a promising negative electrode for Li- and Na-ion batteries / J. Fullenwarth, A. Darwiche, A.Soares et al. // J. Mater. Chem. A, 2014, Vol. 2, N 7, P. 2050-2059.
- Lu Y. Ni 2 P/Graphene Sheets as Anode Materials with Enhanced Electrochemical Properties versus Lithium / Y. Lu, X. Wang, Y.Mai et al. // The Journal of Physical Chemistry C, 2012, Vol. 116, N 42, P. 22217-22225.
- Li Q. Interconnected Ni 2 P nanorods grown on nickel foam for binder free lithium ion batteries / Q. Li, J. Ma, H.Wang et al. // Electrochimica Acta, 2016, Vol. 213, P. 201-206.
- Brown R.J.C. The physical and chemical properties of electroless nickel–phosphorus alloys and low reflectance nickel–phosphorus black surfaces / R.J.C. Brown, P.J. Brewer, M.J.T.Milton // J. Mater. Chem., 2002, Vol. 12, No. 9, P. 2749-2754.
- Shamanaev I. V. Effect of precursor on the catalytic properties of Ni 2 P/SiO 2 in methyl palmitate hydrodeoxygenation / I. V. Shamanaev, I. V. Deliy, P. V. Aleksandrov et al. // RSC Advances, 2016, Vol. 6, N 36, P. 30372-30383.
- Deliy I. HDO of Methyl Palmitate over Silica-Supported Ni Phosphides: Insight into Ni/P Effect / Deliy I., Shamanaev I., Gerasimov E., et al. // Catalysts, 2017, Vol. 7, N 10, P. 298.
- Yu Z. Hydrodeoxygenation of phenolic compounds to cycloalkanes over supported nickel phosphides / Yu Z., Wang A., Liu S. et al. // Catalysis Today, 2019, Vol. 319, P. 48-56.
- Yang L. Hydrodesulfurization of 4,6-dimethyldibenzothiophene and its hydrogenated intermediates over bulk Ni2P / Yang L., Li X., Wang A. et al. // Journal of Catalysis, 2014, Vol. 317, P. 144-152.
- Liu D. Bulk and Al 2 O 3 -supported Ni 2 P HDS catalysts prepared by separating the nickel and hypophosphite sources / Liu D., Wang A., Liu C. et al. // Catalysis Communications, 2016, Vol. 77, P. 13-17.
- Liu D. Ni 2 P/Al 2 O 3 hydrodesulfurization catalysts prepared by separating the nickel compound and hypophosphite / Liu D., Wang A., Liu C. et al. // Catalysis Today, 2017, Vol. 292, P. 133-142.
- Cho K.-S. A new synthesis of highly active Ni2P/Al2O3 catalyst by liquid phase phosphidation for deep hydrodesulfurization / Cho K.-S., Seo H.-R., Lee Y.-K. // Catalysis Communications, 2011, Vol. 12, N 6, P. 470-474.
- Li M. NMR Crystallography for Structural Characterization of Oxovanadium(V) Complexes: Deriving Coordination Geometry and Detecting Weakly Coordinated Ligands at Atomic Resolution in the Solid State / Li M., Yehl J., Hou G. et al. // Inorganic Chemistry, 2015, Vol. 54, N 4, P. 1363-1374.
- Song L. A new route for synthesizing nickel phosphide catalysts with high hydrodesulfurization activity based on sodium dihydrogenphosphite / Song L., Zhang S., Wei Q. // Catalysis Communications, 2011, Vol. 12, N 12, P. 1157-1160.
- Albani D. Ensemble Design in Nickel Phosphide Catalysts for Alkyne Semi‐Hydrogenation / Albani D., Karajovic K., Tata B. et al. // ChemCatChem, 2019, Vol. 11, N 1, P. 457-464.
- Chen H. An effective and stable Ni 2 P/TiO 2 catalyst for the hydrogenation of dimethyl oxalate to methyl glycolate / Chen H., Tan J., Zhu Y. et al. // Catalysis Communications, 2016, Vol. 73, P. 46-49.
- Wei J. Urchin-like NixPy hollow superstructures: mild solvothermal synthesis and enhanced catalytic performance for the reduction of 4-nitrophenol / Wei J., Ni Y., Xiang N., Zhang Y. et al. // CrystEngComm, 2014, Vol. 16, N 11, P. 2113.
- Carenco S. Nickel phosphide nanocatalysts for the chemoselective hydrogenation of alkynes / Carenco S., Leyva-Pérez A., Concepción P. et al. // Nano Today, 2012, Vol. 7, N 1, P. 21-28.
- Song H. Preparation of a highly dispersed Ni 2 P/Al 2 O 3 catalyst using Ni–Al–CO 3 2− layered double hydroxide as a nickel precursor / Song H., Ren Q., Li F. et al. // Catalysis Communications, 2016, Vol. 73, P. 50-53.
- Guan Q. A feasible approach to the synthesis of nickel phosphide for hydrodesulfurization / Guan Q., Cheng X., Li R. et al. // Journal of Catalysis, 2013, Vol. 299, P. 1-9.

