В статье проведен анализ литературы, посвященной проблеме исходов беременности женщин, перенесших в детском возрасте лечение злокачественных опухолей
Содержание статьи
Введение
Благодаря современным достижениям в терапии злокачественных опухолей у детей долговременная выживаемость излеченных превышает 80% [1]. Следовательно, большинство пациентов достигают репродуктивного возраста.
Известно, что применяемые для лечения опухолей цитостатики и ионизирующее излучение являются потенциальными мутагенами и причиной увеличенного риска спонтанных выкидышей, мертворождения, рождения незрелых плодов и аномалий развитий плода, в т. ч. наличия у них злокачественных новообразований. Некоторые исследования доказывают влияние гамма- и нейтронного излучения на частоту мутаций через несколько лет после экспозиции, используя частоту мутаций в локусе гликофорина А [2, 3] или в локусе гипоксантингуанинфосфорибозилтрансферазы [4].
Все цитостатики можно классифицировать как мутагенные и немутагенные. К первой группе относятся доксорубицин, даунорубицин, циклофосфамид, ифосфамид, 1-(2-хлороэтил)-3-циклогексил-1-нитрозомочевина (ломустин), 1,3-бис (2-хлорэтил)-1-нитрозомочевина (кармустин), 5-(3,3-диметил-1-триазено)-имидазол-4-карбоксамид (дакарбазин), цис-диамминдихлороплатинум (II) (цисплатин), прокарбазин, хлорамбуцил, этопозид и меркаптопурин [5–9]. К немутагенным агентам причислены винкристин, винбластин, метотрексат, аспарагиназа и дактиномицин [7–10].
Исходы беременности у женщин, перенесших в детском возрасте лечение злокачественных опухолей, стали предметом многих исследований [11, 12]. Эмбриональные пороки диагностированы у 19,2% (10 из 52) плодов, матери которых получали в I триместре беременности аминоптерин [11], у 50% (3 из 6) плодов, матерям которых на том же сроке вводился циклофосфамид, у 50% (один из двух) после лечения матери хлорамбуцилом и у 9,1% (2 из 22) — бусульфаном [12]. Неоднозначны сообщения о последствиях применения метотрексата на фоне беременности: есть сообщения о рождении ребенка с множественными врожденными пороками [8], в то же время немало сообщений о рождении абсолютно здоровых детей на фоне приема метотрексата [13], и даже после полихимиотерапии (ПХТ) меркаптопурином, метотрексатом, винкристином, преднизолоном и в качестве реиндукции — винкристином, преднизолоном и доксорубицином [14].
Исходы беременности после онкологического лечения в детстве
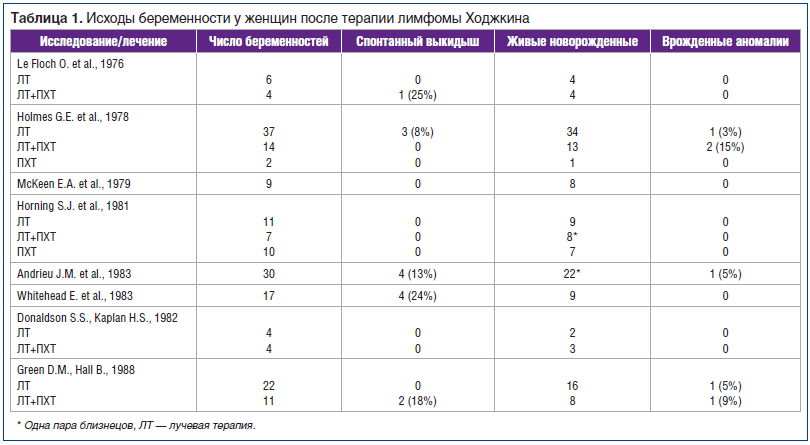
Большинство работ по изучению исходов беременности в основном связаны с первичной лимфомой Ходжкина (ЛХ), опухолью Вильмса и острым лимфобластным лейкозом (ОЛЛ). В таблице 1 представлены сведения об исходах беременности у больных, прошедших лечение по поводу первичной ЛХ [15–23].
По сообщениям G. E. Holmes и F. F. Holmes (1978), у пациентов, получавших ПХТ по поводу ЛХ, новорожденные дети чаще имели аномалии в развитии (аутизм, склеродерма, врожденные пороки), чем в группе контроля, которая включала здоровых сиблингов. Это исследование, одно из ранних по данной теме, интересно еще и тем, что одной из групп сравнения были пациенты, лечившиеся только с использованием лучевой терапии (ЛТ) [17].
В исследовании E.A. McKeen et al. (1979) у 50% новорожденных (4 из 8), родители которых лечились по поводу ЛХ, были диагностированы врожденные пороки, в то время как среди новорожденных, родители которых уже завершили лечебную программу, пороки имелись только у 14,7% (5 из 34), это доказывает вероятность временнóй связи терапии с частотой пороков [18].
Исследования S. S. Donaldson и H. S. Kaplan (1982), D. M. Green и B. Hall (1988) показали отсутствие нежелательных исходов беременности у пациенток, получавших терапию по поводу ЛХ в детском и подростковом возрасте (см. табл. 1) [22, 23].
D. M. Green et al. (1982) опубликовали сведения о 81 ребенке, родившемся от 27 женщин и 9 мужчин, в детстве лечившихся от опухоли Вильмса. Частота спонтанных абортов не отличалась от таковой в общей популяции. Вес новорожденных от женщин, получивших ЛТ брюшной полости, был достоверно ниже [24]. Это подтверждено в исследовании F. P. Li et al. (1987) [25]. Без врожденных пороков рождены несколько детей пациентками, в детстве лечившимися от ОЛЛ [26].
Наиболее масштабным было исследование исходов беременности у 20 276 больных, в детстве перенесших злокачественное заболевание и наблюдавшихся 5 и более лет после лечения (исследование выживших после рака в детском возрасте Childhood Cancer Survivor Study) [27]. У 1950 женщин было 4029 беременностей: 63% беременностей закончились рождением живых детей, 1% — мертворождением, 15% — самопроизвольным выкидышем, 17% — абортом. Соотношение новорожденных по полу (мальчиков и девочек) составило 1,09:1 (как и в здоровой популяции). Женщины в возрасте 21–25 лет чаще остальных прерывали беременность по медицинским показаниям.
У больных, леченных по поводу злокачественных опухолей ЦНС, чаще возникали самопроизвольные выкидыши: относительный риск (Relative Risk — RR) составил 1,65; 95% доверительный интервал (Confidence Interval — CI) 1,16–2,34 (p=0,006). Кроме того, краниоспинальное облучение увеличивало частоту выкидышей на сроках гестации более 12 нед. (RR=6,10; 95% CI: 3,06–12,2; p<0,0001). Выше риск выкидышей был и у больных, в поле облучения которых попадали яичники (RR=1,86; 95% CI: 0,82–4,18; p=0,14).
Достоверно чаще понадобилось прерывание беременности по медицинским показаниям в исследуемой группе, за исключением больных с неходжкинскими лимфомами.
Не было различий в частоте мертворождений в случаях излечения в детстве от злокачественных опухолей и у здоровых сиблингов. Исследованию взаимосвязей подверглись кумулятивные дозы цитостатиков и частота живых младенцев, мертворождений и самопроизвольных выкидышей.
Новорожденные, родителям которых проводилось в детстве облучение малого таза, чаще имели вес менее 2500 г (RR=1,85; 95% CI: 1,07–3,18; p=0,03).
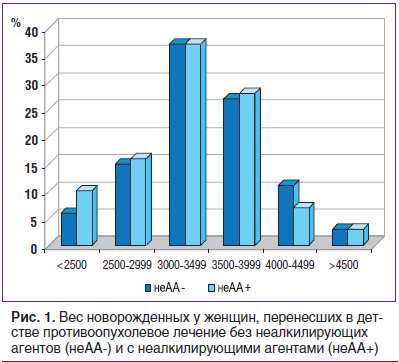
Не было достоверных различий в весе новорожденных детей, родители которых лечились с использованием алкилирующих агентов, однако достоверно чаще при применении у родителей неалкилирующих препаратов вес детей при рождении составлял менее 2500 г (RR=1,80; 95% CI: 1,15–2,83; p=0,01) (рис. 1).
RR был выше при использовании даунорубицина и доксорубицина (RR=1,92; 95% CI: 1,33–2,8; р=0,0005). В многофакторный анализ были включены такие признаки, как облучение малого таза, использование алкилирующих препаратов, дактиномицина, даунорубицина или доксорубицина, возраст, статус курильщика, алкоголизм и образование, при этом RR составил 2,67 (95% CI: 1,51–4,75; р=0,0008).
Не менее крупное исследование опубликовано E. J. Chow et al. (2017), в него вошли 10 938 человек (из них 2455 женщин), излеченных от злокачественных опухолей в детстве, и 3949 (из них 1379 женщин) сиблингов. По результатам работы оказалось, что к 30 годам число беременностей у женщин, леченных от злокачественных опухолей в детстве, меньше, чем у здоровых сиблингов, а к 45 годам число беременностей у таких женщин еще больше снижается. Примечательно, что в данном исследовании суммарная доза циклофосфамида у женщин не приводила к достоверному снижению числа беременностей в сравнении со здоровыми сиблингами: отношение шансов (Hazard Ratio — HR) составило 0,85; 95% CI: 0,74–0,98; p=0,023. Однако достоверно с уменьшением числа беременностей в контрольной группе оказались связаны бусульфан в дозе <450 мг/м2 (HR=0,22; 95% CI: 0,06–0,79; p=0,020), в дозе ≥450 мг/м2 (HR=0,14; 95% CI: 0,03–0,55; p=0,0051) и ломустин в дозе >411 мг/м2 (HR=0,41; 95% CI: 0,17–0,98; p=0,046) [28].
Группой по исследованию опухоли Вильмса (National Wilms Tumor Study Group) представлены сведения о 427 беременностях у пациенток, выживших после лечения опухоли Вильмса [29]. Был один самопроизвольный выкидыш, 4 мертворождения, 406 живых новорожденных и 12 двоен. Среди осложнений беременности авторы выделяют гипертензию, ранние или преждевременные роды, неправильное положение плода, слабость родовой деятельности, обвитие пуповиной. Ранние или преждевременные роды (p=0,03) и неправильное положение плода (p=0,007) чаще диагностированы у женщин, получавших в анамнезе ЛТ на органы малого таза.
Средний гестационный возраст у новорожденных, родившихся у женщин после облучения брюшной полости, составил 37,23±4,00 нед., у женщин, не подвергавшихся облучению, — 38,47±2,95 нед.
Средний вес новорожденных детей у больных, лечившихся с применением ЛТ, составил 3036±805 г, без ЛТ — 3245±620 г (p=0,02). Достоверно чаще вес ребенка при рождении составлял менее 2500 г у рожениц, в детстве получивших облучение (p=0,017). Большинство маловесных детей соответствовали гестационному возрасту. Не было различий в количестве маловесных детей в группе излечившихся только дактиномицином или винкристином и дактиномицином и в группе получавших трехкомпонентную схему ПХТ.
Причинами рождения детей с малым весом, по-видимому, являются недостаточная функция яичников, нарушения васкуляризации и объема матки, возникающие после облучения малого таза.
C. Anderson et al. (2017) пришли к выводу, что у подростков и молодых взрослых, излеченных от злокачественных опухолей, в будущем чаще рождаются недоношенные, маловесные дети, чем в никогда не болевшей популяции. А вот частота низкой оценки по шкале Апгар (менее 7 баллов) не коррелировала с наличием ПХТ и/или ЛТ в анамнезе [30].
В исследованиях, проведенных в группах пациентов, в детстве излеченных от опухоли Вильмса и от ОЛЛ, не выявлено повышения частоты рождения детей с врожденными пороками развития [31, 32]. По данным D. M. Green et al. (2002), 32 порока развития диагностированы у 309 новорожденных: 12 из них имели одиночный порок, 5 — по 2 порока, 2 — по 3 порока и один ребенок имел 4 порока развития. В данном исследовании подтверждена достоверность увеличения частоты аномалий у детей, матери которых получали ЛТ (p=0,054). Комбинации цитостатиков в данном исследовании на частоту аномалий развития влияния не имели [30].
Схожие результаты были опубликованы японскими учеными M. Sekiguchi et al. (2017). В исследование включена 61 женщина с общим числом родов 71. Из них 24% — преждевременные роды, в среднем на сроке 37,9 нед. Также характерно было рождение маловесных детей (средний вес новорожденных составил 2718 г). Число врожденных пороков — 4,2% (3 ребенка от общего количества беременностей). Исследователи отметили, что количество преждевременных родов было выше, а вес новорожденных — ниже у женщин, получавших в детском возрасте ЛТ на область малого таза, в сравнении с теми женщинами, кто ЛТ не получал (соответственно 42% и 16%, p=0,025; 2,436±737 г и 2,827±483 г, p=0,010) [33].
Дети, родившиеся в семьях с наследственно обусловленным фенотипом рака (билатеральная ретинобластома, нейрофиброматоз, семейный полипоз кишечника и др.), имеют повышенный риск развития злокачественной опухоли. Частота же новообразований у детей, родители которых в детстве лечились по поводу той или иной опухоли (генетически недетерминированной), составляет 0,3%, в группе контроля здоровых сиблингов — 0,23% [34].
Заключение
Таким образом, проанализировав данные литературы, можно сделать вывод, что результаты всех исследований схожи. У женщин, излеченных в детском возрасте от злокачественных опухолей, достоверно повышаются риски осложнений беременности и родов. Риски можно разделить на две группы: связанные с матерью и связанные с рожденным ребенком. К первой группе относятся повышенный риск выкидышей на раннем сроке, внутриутробной задержки роста и развития плода, гестационного диабета, артериальной гипертензии, преждевременных родов, анемии, разрыва матки в родах. Для детей, родившихся от матерей, излеченных в детстве от злокачественных опухолей, характерен более низкий вес при рождении, более низкий гестационный возраст, выше частота врожденных пороков развития, мертворождений в отличие от детей, рожденных от здоровых женщин.
Несомненно, беременные женщины, в детстве перенесшие злокачественное заболевание, требуют повышенного внимания к планированию и ведению беременности и родов, а их родившиеся дети обязательно должны быть тщательно обследованы на наличие стигм дизэмбриогенеза и пороков развития.
Информация с rmj.ru