В статье рассмотрены препараты инкретинового ряда, в первую очередь ингибиторы дипептидилпептидазы-4 (иДПП-4). Благодаря своему глюкозозависимому влиянию на секрецию инсулина и глюкагона иДПП-4 позволяют эффективно контролировать сахарный диабет 2 типа без значимых побочных эффектов.
Сахарный диабет (СД) 2 типа является гетерогенным, постоянно прогрессирующим заболеванием, в развитии которого участвует множество патофизиологических дефектов. Являясь, согласно определению экспертов ВОЗ, «проблемой всех возрастов и всех стран», СД давно приобрел характер неинфекционной пандемии XXI в. Сегодня численность больных СД достигла 415 млн человек, а уже к 2040 г. эта цифра возрастет до 642 млн человек [1]. Причем 320,5 млн больных СД 2 типа относятся к группе трудоспособного населения (20–64 года). Широкая распространенность, преждевременная инвалидизация и высокая смертность больных СД 2 типа возводят это заболевание в ранг чрезвычайно значимой медико-социальной проблемы, контроль за решением которой во многих странах мира осуществляется на государственном уровне.
В 2015 г. в России завершилось первое широкомасштабное эпидемиологическое исследование распространенности СД 2 типа — скрининговое исследование NATION, охватившее 8 федеральных округов РФ, 63 региона, 26 620 жителей в возрасте 20–79 лет. Согласно результатам данного исследования, распространенность СД 2 типа составила 5,4% — около 6 млн человек, причем у каждого 5-го пациента (19,2%) отмечался высокий уровень декомпенсации СД (гликированный гемоглобин (НbА1с) > 9%), более половины (54%) не знали, что больны СД, у каждого 5-го жителя (19,3%) был выявлен предиабет, а наибольший рост распространенности СД 2 типа был отмечен в активной, работоспособной (лица 45–64 лет) группе населения [2].
Для эффективного контроля такого многофакторного, патогенетически сложного заболевания, как СД 2 типа необходимо четкое понимание всех звеньев патогенеза, приводящих к его развитию и прогрессированию. В настоящий момент известны 11 основных патофизиологических дефектов, приводящих к СД 2 типа: прогрессирующая дисфункция β-клеток поджелудочной железы, инсулинорезистентность клеток печени и периферических тканей-мишеней, нарушения инкретинового эффекта, гиперпродукция глюкагона α-клетками поджелудочной железы, усиление реабсорбции глюкозы почками, активация липолиза адипоцитами, дисфункция нейротрансмиттерной передачи на уровне центральной нервной системы, системное воспаление, патологические изменения микрофлоры кишечника, повышение скорости абсорбции глюкозы на уровне желудка и тонкого кишечника (рис. 1).
Более глубокое и комплексное понимание природы и механизмов развития СД 2 типа изменило требования к управлению этим заболеванием. Теперь, персонализируя сахароснижающую терапию (ССТ) для каждого пациента наравне с гипогликемической эффективностью, необходимо обязательно оценивать множество факторов, характеризующих безопасность в контексте риска гипогликемических реакций и динамику массы тела, потенциальное влияние на сопутствующие заболевания и сердечно-сосудистые риски, удобство и доступность терапии, учитывать возраст пациента и длительность СД. Кроме того, современная стратегия управления СД 2 типа во многом ориентирована на максимально раннее достижение целевого гликемического контроля и его долгосрочное поддержание, на возможность патогенетической коррекции заболевания, максимально приближенной к физиологической норме [3–5]. Более того, убедительные данные доказательной медицины последних лет свидетельствуют о неожиданных органопротективных возможностях противодиабетической терапии, значительно улучшающих прогноз пациентов с СД 2 типа в отношении продолжительности жизни и кардиоваскулярных исходов. Все это дает понимание того, что не только прямые метаболические эффекты, устранение глюко- и липотоксичности, но и выбор конкретных препаратов противодиабетической терапии имеют крайне важное значение.
Вплоть до конца прошлого столетия традиционный подход к коррекции гипергликемии у пациентов с СД 2 типа был ограничен производными сульфонилмочевины (ПСМ) и бигуанидами — веществами, открытыми случайно, обладающими способностью снижать уровень глюкозы в крови, механизм действия которых до сих пор изучается. С 2006 г. в реальной клинической практике применяются инновационные таблетированные инкретиновые препараты, обладающие уникальным глюкозозависимым механизмом контроля уровней гликемии. Инкретиновый эффект — это значительное увеличение секреции инсулина в ответ на пероральное поступление углеводов, опосредованное действием инкретиновых гормонов кишечника. У здоровых людей инкретины отвечают за 50–70% всего секретируемого постпрандиального инсулина, т. е. в норме вклад «инкретинового эффекта» в прирост уровня постпрандиального инсулина составляет около 70%, а у пациентов с СД 2 типа он существенно снижен. Механизм действия препаратов класса иДПП-4 связан с высокоселективной блокадой активности субстратов фермента ДПП-4, ответственного за деградацию инкретинов, выброс которых индуцирован приемом пищи. Сейчас мы используем эффекты двух основных наиболее активных инкретиновых гормонов — глюкагоноподобного пептида‑1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП). ГПП-1 стимулирует секрецию инсулина β-клетками в ответ на повышение уровня глюкозы и снижает неадекватно повышенный уровень глюкагона, ГИП повышает чувствительность α-клеток к глюкозе в гипогликемическом диапазоне. Увеличение времени полужизни циркулирующих инкретинов, которые регулируют соотношение инсулина к глюкагону, ассоциировано не только со снижением постпрандиальной гликемии, но и с поддержанием уровней гликемии между приемами пищи, снижением ночной продукции глюкозы печенью и, как следствие, глюкозы плазмы натощак. Помимо влияния на гомеостаз глюкозы препараты класса иДПП-4 оптимизируют контррегуляторную секрецию глюкагона при гипогликемиях и обладают такими экстрапанкреатическими эффектами, как мобилизация липидов во время приема пищи, снижение секреции аполипопротеина B‑48 в кишечнике, снижение липолиза натощак и содержания жиров в печени, а также повышение дисперсности липопротеина низкой плотности. Особенно важно влияние иДПП-4 на снижение воспалительного ответа и функцию микробиоты кишечника при СД 2 типа.
В последнее десятилетие препараты из группы иДПП-4
доступны для клинического применения во всем мире как в монотерапии, так и в фиксированных комбинациях с метформином (табл. 1, 2) и ингибиторами натрий-глюкозного котранспортера (НГЛТ) 2-го типа.

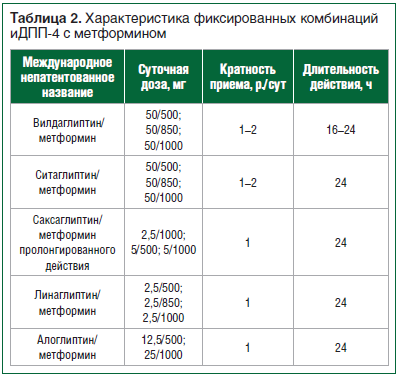
ИДПП-4, назначаемые в виде монотерапии (например, Галвус®) или в комбинации с метформином (например, Галвус Мет®), признаны одним из наиболее безопасных классов среди всех пероральных и инъекционных противодиабетических средств, особенно применительно к риску развития гипогликемических реакций, т. к. секреция инсулина, стимулированная их приемом, глюкозозависима, не связана с физической активностью или режимом питания, регулируется постпрандиальным уровнем гликемии, что было подтверждено результатами ряда рандомизированных контролируемых исследований (РКИ) [13–15].
Первым и наиболее подробным исследованием иДПП-4 в условиях реальной клинической практики (РКП) явилось исследование эффективности контроля СД 2 типа при лечении вилдаглиптином и вилдаглиптином в комбинации с метформином — EDGE (45 тыс. пациентов из 27 стран и 5 регионов). Уникальная особенность этого исследования заключалась в том, что в нем были отражены ключевые повседневные задачи ведения пациентов с СД 2 типа. Врач имел право на свое усмотрение повышать дозу вилдаглиптина в режиме монотерапии в случае его неэффективности и добавлять препараты сравнения в двухкомпонентную терапию с вилдаглиптином, которыми, как правило, были метформин в комбинации с ПСМ или метформин в комбинации с пиоглитазоном. Результаты наблюдения показали, что на фоне применения иДПП-4 достоверно снижался уровень HbA1c на 1,19% за 12 мес. лечения и что это снижение превосходило таковое у препаратов сравнения во все сроки оценки в течение периода наблюдения. Такое неожиданное превосходство результатов, полученных в программе EDGE, отражающей РКП согласно данным РКИ, могло быть связано с меньшей лечебной дозой ПСМ в стандартной клинической практике, в соответствии с современными требованиями, из-за страха развития гипогликемии и набора веса [15, 16] (рис. 2).
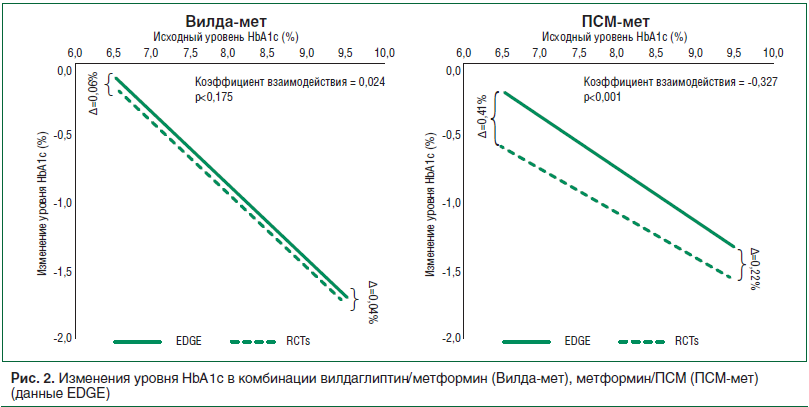
Исследование EDGE убедительно показало существенные различия потенциальных результатов терапии в реальной жизни по сравнению с ожидаемыми на основании РКИ, продемонстрировало региональные различия в привычных режимах лечения, наличие клинической инертности у врачей, которая влияет на интенсификацию терапии и переход на комбинированную терапию.
Клиническая эффективность и преимущества стартовой комбинированной терапии вилдаглиптином и метформином были показаны в 2009 году в ходе 24-недельного двойного слепого контролируемого исследования E. Bosi et al. (1179 пациентов с СД 2 типа, ранее не получавшие ССТ). Данное исследование продемонстрировало: среднее снижение уровня НbА1с в группе вилдаглиптин 50 мг и метформин 1000 мг 2 р./сут. через 24 нед. наблюдения составило 1,8%. эффективность и безопасность комбинированной терапии (с разными дозами метформина) в сравнении с монотерапией по отдельным компонентам. Кроме того, на фоне терапии отсутствовали эпизоды гипогликемии, в т. ч. тяжелой, не наблюдалось увеличения массы тела [17]. Таким образом, стартовая комбинация вилдаглиптина и метформина у пациентов, ранее не получавших ССТ, продемонстрировала высокую эффективность, отличный профиль безопасности, низкий риск гипогликемии.
В 2019 г. должны быть представлены результаты исследования VERIFY (2 тыс. пациентов с впервые выявленным СД 2 типа и легкой гипергликемией (уровень HbА1с в диапазоне 6,5–7,5%)). Исследование проводится с целью оценки клинической эффективности ранней комбинированной терапии вилдаглиптином и метформином в сравнении с монотерапией метформином по установленному стандарту лечения у пациентов с впервые выявленным СД 2 типа. Результаты исследования должны показать, обладает ли двухкомпонентная терапия эффектами отложенного времени до первичной неэффективности лечения или до инсулинотерапии [18, 19].
В последние годы НbА1с уже не рассматривается как единственный ключевой показатель эффективности контроля СД 2 типа. Все большую актуальность сегодня приобретает феномен гликемической изменчивости, или вариабельности гликемии (ВГ). Неблагоприятное влияние ВГ на сосуды связывают с опосредованным усилением оксидативного стресса и активацией системного воспаления. С появлением систем непрерывного мониторирования глюкозы возможности анализа ВГ существенно расширились. Поэтому тактика ССТ сегодня может и должна учитывать положительное влияние пероральных сахароснижающих препаратов (ПССП) на ВГ. В многочисленных исследованиях изучено влияние иДПП-4 на ВГ у больных СД 2 типа. Особенный интерес представляет сравнение влияния на ВГ препаратов из групп иДПП-4 и ПСМ как препаратов, стимулирующих секреторную активность β-клеток поджелудочной железы. Так, в сравнительном исследовании Y.L. He et al. изучали влияние терапии вилдаглиптином и глимепиридом у пациентов с СД 2 типа по данным непрерывного мониторинга гликемии. Было выявлено сравнимое уменьшение постпрандиальной гликемии, однако терапия вилдаглиптином показала более низкую ВГ, при этом показатель MAGE (показатель, по которому оценивают выраженность нестабильности гликемии) был на 20% ниже в группе вилдаглиптина [20]. Кроме этого, ПСМ из-за риска гипогликемии нежелательны для пожилых пациентов, пациентов с когнитивными нарушениями, с нарушением функции почек ввиду возможной кумуляции препаратов.
ИДПП-4 оказались первой фармакотерапевтической группой, доказавшей свою сердечно-сосудистую безопасность в соответствии с новыми требованиями Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и Европейского агентства лекарственных средств (EMA) [21, 22].
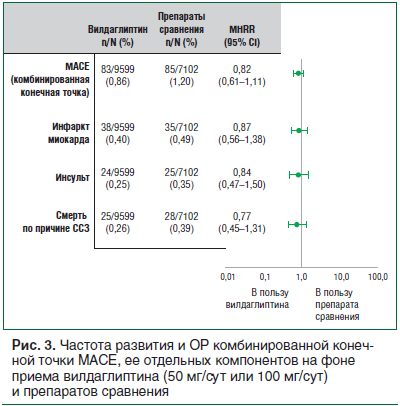
Сердечно-сосудистая безопасность вилдаглиптина была подтверждена в метаанализе нежелательных явлений со стороны сердечно-сосудистой (СС) системы в 40 исследованиях III и IV фазы (более 17 тыс. пациентов) с независимой проспективной экспертной оценкой [23, 24]. Величина MHRR (отношение рисков Мантеля — Хензеля) для частоты большого нежелательного СС события (МАСЕ) при лечении вилдаглиптином и препаратами сравнения была равна 0,82 (95% ДИ 0,61–1,11). Аналогичные отношения рисков (ОР) были определены для отдельных компонентов MACE, таких как нефатальный инфаркт миокарда (ИМ) (0,87, 95% ДИ 0,56–1,38), нефатальный инсульт (0,84, 95% ДИ 0,47–1,50) и смерть по причине ССЗ (0,77, 95% ДИ 0,45–1,131) [24] (рис. 3).
Плацебо-контролируемое исследование ТЕСОS (более 14 тыс. пациентов) по кардиоваскулярной безопасности ситаглиптина у пациентов с СД 2 типа и ССЗ выявило нейтральное влияние препарата на достижение комбинированной конечной точки МАСЕ у пациентов с высоким кардиоваскулярным риском (11,4% — в группе ситаглиптина (100 мг/сут), 11,6% — в группе плацебо). Кроме того, в обеих группах отмечалась сопоставимая частота госпитализаций по поводу сердечной недостаточности (СН): ОР=1,00 (ДИ 0,83–1,20); р=0,983. Ситаглиптин или плацебо были добавлены к уже существующей ССТ (ПССП ± инсулинотерапия продолжительностью не менее 3 мес.) [25].
Аналогичные результаты были получены и в проспективном плацебо-контролируемом исследовании СС безопасности саксаглиптина — SAVOR — TIMI (более 16 тыс. больных СД 2 типа с данными анамнеза о СС событии или с высоким риском его развития). Пациенты были рандомизированы в отношении 1:1 в группы саксаглиптина или плацебо в дополнение к стандартной терапии. По результатам исследования группа саксаглиптина не имела отличий как по первичной МАСЕ, так и по вторичной конечной точке — МАСЕ+ (дополнительные госпитализации по поводу нестабильной стенокардии, коронарной реваскуляризации). Однако в группе саксаглиптина было отмечено достоверное повышение на 27% частоты госпитализаций по поводу ХСН (3,5% — в группе саксаглиптина, 2,8% — в группе плацебо, р=0,007; ОР=1,27; 95% ДИ 1,07–1,51) по сравнению с контрольной группой, правда, без повышения смертности [26].
Плацебо-контролируемое исследование VIVIDD (254 пациента с СД 2 типа, рандомизация в соотношении 1:1 в группы активного лечения и плацебо в дополнение к стандартной терапии СД 2 типа) по безопасности вилдаглиптина у пациентов с СН и сниженной фракцией выброса показало отсутствие достоверных различий с контрольной группой по частоте госпитализаций в связи с ХСН (10,2% — в группе вилдаглиптина, 8,0% — в группе плацебо, р=0,552). Данные результаты, по-видимому, свидетельствуют о нейтральном влиянии вилдаглиптина на развитие или прогрессию ХСН у больных СД 2 типа [27, 28].
В плацебо-контролируемом исследовании безопасности алоглиптина — EXAMINE (более 5 тыс. больных с острым ИМ или нестабильной стенокардией, рандомизация в соотношении 1:1 в группы лечения алоглиптином и плацебо, около 28% больных в обеих группах имели ХСН) также не было найдено статистически значимых эффектов препарата в отношении событий, связанных с ХСН. Однако в группе алоглиптина госпитализация по поводу ХСН была первым событием в рамках исследования у 85 пациентов (3,1%) против 79 (2,9%) пациентов в группе плацебо (ОР 1,07; 95% ДИ 0,79–1,46). Отсутствие статистической значимости данного различия не исключает возможного вектора в сторону увеличения частоты развития ХСН при использовании алоглиптина [29]. Результаты проведенных РКИ в целом убедительно показали, что данный класс препаратов следует рассматривать как препараты с нейтральным действием в отношении основных кардиоваскулярных конечных точек (МАСЕ и МАСЕ+), т. е. они достаточно безопасны у пациентов с СД 2 типа с высоким кардиоваскулярным риском.
Обсуждается, следует ли соблюдать осторожность в отношении назначения саксаглиптина у пациентов с ХСН. Изучаются и потенциальные механизмы обнаруженного увеличения риска госпитализаций. Пока рекомендовано избегать применения саксаглиптина у пациентов с выраженными стадиями ХСН, однако признается его кардиоваскулярная безопасность в целом [30].
Безопасность и эффективность иДПП-4 были доказаны и в отношении особых групп пациентов — пациентов пожилого возраста, для которых характерны сочетанная полиорганная патология и нарушенное распознавание гипогликемий. Плацебо-контролируемое исследование INTERVAL с участием пациентов старше 70 лет из различных европейских стран (24-недельный период наблюдения, вилдаглиптин назначался либо в виде монотерапии, либо в качестве дополнительной терапии с индивидуально подбираемой гликемической целью) убедительно продемонстрировало возможность достижения индивидуализированных целей НbА1с в качестве конечной точки у данного контингента пациентов. Скорректированное отношение шансов достижения индивидуально подобранной гликемической цели составляло 3,16 (96,2% ДИ 1,81–5,52; p
Хроническая болезнь почек (ХБП) является еще одним фактором, который обязательно следует учитывать при выборе ССТ. По данным Национального фонда США по патологии почек (NKF), почти треть пациентов с СД имеют нарушение функции почек (ХБП 2–5 стадии) либо в виде снижения расчетной скорости клубочковой фильтрации (рСКФ), либо в виде микроальбуминурии, протеинурии [3]. Нарушение почечной функции значительно повышает кардиоваскулярный риск и затрудняет достижение компенсации из-за высокого риска гипогликемий. Тем не менее компенсация углеводного обмена крайне важна для профилактики развития ХБП и замедления ее прогрессирования у больных СД [33].
Несмотря на всю палитру ПССП, фармакокинетическая активность целого ряда препаратов на фоне нарушенной функции почек существенно меняется, поэтому приходится корректировать дозу или отменять препарат на выраженных стадиях ХБП. В частности, при нарушении функциональной активности почек значительно ограничены возможности метформина (риск развития лактатацидоза), большинства ПСМ и инсулина (риск гипогликемии), пиоглитазонов (задержка жидкости, усиление СС рисков) [34]. И поэтому препараты с физиологической стимуляцией секреции инсулина, низким риском гипогликемии представляются весьма привлекательными для данной популяции пациентов с СД 2 типа.
Эффективность и безопасность вилдаглиптина у пациентов с умеренными или тяжелыми нарушениями функции почек изучались в крупном однолетнем рандомизированном исследовании (525 человек) W. Kothny et al. [35]. Как показало исследование, профиль безопасности вилдаглиптина в режиме 50 мг 1 р./сут у пациентов с умеренными или тяжелыми нарушениями функции почек аналогичен профилю безопасности плацебо. В другом исследовании W. Kothny были определены аналогичные профили безопасности вилдаглиптина и ситаглиптина у 148 пациентов с тяжелыми нарушениями функции почек [36]. В ходе исследования было показано, что даже отсутствие корректировки дозы препаратов с учетом повышенного уровня их системного воздействия на фоне низкой СКФ не вызывало нефротоксического эффекта [37]. Лечение вилдаглиптином хорошо переносилось пациентами с тяжелыми нарушениями функции почек с недостаточным гликемическим контролем на фоне инсулинотерапии, пожилыми пациентами (≥ 75 лет), пациентами с впервые выявленным СД после трансплантации почки и пациентами на гемодиализе, а профиль нежелательных явлений (НЯ) и серьезных НЯ (СНЯ) был аналогичен таковому для плацебо [38–40]. Согласно российским клиническим рекомендациям, все препараты группы иДПП-4 могут быть использованы на продвинутых стадиях ХБП с соответствующим снижением дозы, кроме линаглиптина (очень низкий уровень почечной экскреции, до 80% препарата выводится через энтерогепатическую систему). Препарат также может быть использован у пожилых пациентов с СД 2 типа [13].
Говоря о безопасности данной группы препаратов, принципиально важно оценить их возможные риски в отношении функции печени. Согласно данным исследования EDGE, отклонения функциональных печеночных проб (ФПП) от нормы встречались нечасто: повышение уровня билирубина относительно верхней границы нормы (ВГН) наблюдалось у 411 из 9508 (4,3%) пациентов в группе лечения вилдаглиптином и у 190 из 4691 (4,1%) пациента в группах лечения другими ПССП [16]. В группах, получавших вилдаглиптин и препараты сравнения, отмечалась аналогичная частота развития НЯ со стороны печени (1,6 и 1,8 на 100 пациентов соответственно) и СНЯ со стороны печени (0,2 и 0,1 на 100 пациентов соответственно). Более того, у пациентов с СД 2 типа и хорошим гликемическим контролем (уровень гликированного гемоглобина HbA1c ≤ 7,9%) лечение вилдаглиптином приводило к клинически значимому снижению уровня триглицеридов в печени, что сопровождалось снижением уровня АЛТ и глюкозы в плазме крови. Редкие случаи повышения уровня печеночных ферментов были в основном бессимптомными и не имели клинических последствий [40, 41]. Тем не менее, согласно утвержденному стандарту ведения пациентов с СД 2 типа, требуется периодический контроль показателей АЛТ и/или АСТ всем больным, в том числе получающим иДПП-4, особенно, если исходный уровень данных показателей повышен [42, 23].
Тема безопасности препаратов из группы иДПП-4 не может быть окончательно раскрыта без ответа на вопрос о потенциальных рисках острого панкреатита. ИДПП-4 воссоздают эффект ГПП-1, но его концентрация, в отличие от препаратов из группы агонистов ГПП-1, физиологична [42]. В ходе анализа объединенных данных о безопасности исследований II–IV фазы была установлена аналогичная частота развития острого панкреатита при лечении вилдаглиптином и всеми препаратами сравнения (0,3/100 пациентов в обеих группах). Аналогичные исследования были получены для всех остальных лекарственных препаратов, воссоздающих эффект ГПП-1 [36]. Это наблюдение было подтверждено в метаанализе 69 исследований, который показал отсутствие повышенного риска панкреатита на фоне лечения вилдаглиптином по отношению к препаратам сравнения (ОШ 0,97; 95% ДИ 0,37–2,53) [43].
Заключение
Подводя итог, можно с полной уверенностью сказать, что сегодня иДПП-4 представляют собой одну из самых перспективных фармакотерапевтических групп ПССП. С их появлением в клинической практике лечение СД 2 типа стало более патофизиологически обоснованным, безопасным, эффективным. Колоссальная доказательная база эффективности и безопасности препаратов этой группы продемонстрирована результатами многочисленных РКИ, а также исследованиями в условиях РКП. Высокая безопасность иДПП-4 в отношении кардиоваскулярного риска, гипогликемии, возможность их использования у пациентов на любых стадиях ХБП, пациентов старших возрастных групп, а также их нейтральный эффект в отношении массы тела делают их максимально привлекательными для терапии пациентов с СД 2 типа.
Комбинация иДПП-4 (например, вилдаглиптина) с метформином является наиболее востребованной, охватывает подавляющую часть патофизиологических дефектов при СД 2 типа, доступна в фиксированной форме (например, Галвус Мет®). Применение в клинической практике препаратов класса иДПП-4 более 10 лет (например, Галвус®) позволяет считать, что их основные клинические эффекты окончательно выявлены, их можно систематизировать и обсуждать установленные преимущества и недостатки в управлении СД 2 типа.
Информация с rmj.ru





