α-Глицерофосфохолин в восстановлении ментальных способностей после церебральных ишемических атак. Итальянское многоцентровое клиническое исследование (реферат)
Содержание статьи
Введение
У пациентов, перенесших острое церебральное ишемическое событие (ТИА, p-ТИА, инсульт), может развиться синдром, характеризующийся чувствительно-двигательным и, зачастую, когнитивным расстройством в зависимости от типа окклюзии и индивидуальной ответной реакции [1, 2].
Как правило, второй причиной деменции считается цереброваскулярное расстройство, при этом случаи инсульта составляют 20–25% [3]. Термин «деменция» подразумевает изменение с течением времени психического состояния от одного уровня психического функционирования до более низкого. Причины повышенного риска развития деменции после инсульта все еще не вполне понятны: поражение различных областей мозга, каждая из которых отвечает за конкретные когнитивные функции, может привести к деменции только при наличии дополнительных факторов, или многофакторный механизм заболевания может быть обусловлен синергическим эффектом нескольких зон поражений. Проведены клинические испытания множества лекарственных препаратов для оценки возможности функционального восстановления пациентов.
К таким препаратам относится альфа-глицерофосфохолин (α-GPC) из группы доноров холина. Результы фармакокинетических и фармакологических исследований препарата показали, что у животных он влияет на интегративную нейронную функцию [4] и дозозависимо улучшает память и повышает способность к обучению [5, 6]. Проникая через гематоэнцефалический барьер, α-GPC непосредственно увеличивает синтез и высвобождение ацетилхолина и, являясь предшественником мембранных фосфолипидов, улучшает функции нейронных мембран [7–9].
В клинических исследованиях у здоровых волонтеров α-GPC помог предотвратить развитие нарушений памяти, вызываемое введением скополамина [10]. Кроме того, в ходе открытых и контролируемых клинических исследований [11–14] у значительного количества пациентов наблюдалось хорошее терапевтическое действие данного препарата на течение деменции, независимо от ее этиологии [15].
Целью настоящего исследования является оценка эффективности и переносимости α-GPC в устранении нейропсихических симптомов после острого инсульта.
Материал и методы
Дизайн экспериментов
Настоящее исследование представляло собой открытое многоцентровое неконтролируемое исследование с участием 176 лечебных центров терапевтического, гериатрического и неврологического профиля в Италии.
Исследование проводили в два этапа общей продолжительностью 6 мес.: в ходе первой части исследования (в течение 28 дней, в основном стационарно) α-GPC вводили пациентам парентерально в дозе 1000 мг/сут, а в ходе второй части исследования (начиная с 29-го дня по 6-й мес. включительно) α-GPC назначали перорально в дозе 1200 мг/сут по 400 мг 3 р./сут.
Клиническое обследование проводили во время первого приема (исходный уровень), в конце первой части исследования (через 1 мес.) и через 3 и 6 мес.
В таблице 1 представлены параметры клинической оценки и время контроля.
Первая часть исследования (исходный уровень, 28-й день): клиническая оценка включала в себя сбор анамнеза пациента (только на исходном уровне), физикальное и неврологическое обследование, контроль артериального давления и сердечного ритма, показатели шкалы Мэтью и анализ крови.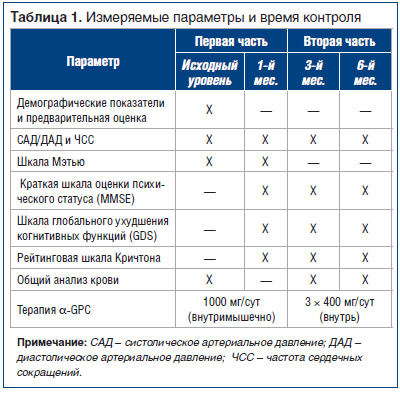
Вторая часть (28-й день, или второй исходный уровень, 3-й мес., 6-й мес.): клиническая оценка включала в себя физикальное и неврологическое обследование, показатели Краткой шкалы оценки психического статуса, Рейтинговой шкалы Кричтона и Шкалы глобального ухудшения когнитивных функций, контроль артериального давления и сердечного ритма, анализ крови.
Экспериментальный образец
В группу были включены 2058 пациентов в возрасте 45–85 лет, перенесшие в течение предыдущих 10 дней церебральные ишемические атаки (инсульт или ТИА).
Критериями исключения из исследования были: показатель шкалы Мэтью
Сопутствующая терапия
Лечение инсульта проводили традиционным методом; сопутствующую терапию другими препаратами, влияющими на мозг, исключили. Терапию, которая требовалась пациентам по поводу других заболеваний, на протяжении 6 мес. исследования не изменяли. Анксиолитики короткого действия назначали в дозах, которые в течение 30 дней были полностью стабилизированы, данные заносили в карты пациентов.
Прекращение лечения и побочные действия
Исследователи могли в любое время прекратить лечение с обязательной отметкой об этом в карте пациента, особенно если причиной такого прекращения явилось возникновение побочного действия, отмеченного самим пациентом или обнаруженного исследователем, которое можно было связать с приемом исследуемого препарата.
Статистический анализ
Данные исследования выражали в виде значения ± стандартное отклонение (SD). Статистический анализ проводился Службой медицинской статистики (Кастелланца, провинция Варесе, Италия); для анализа непрерывных переменных использовали параметрические тесты, а для оценки эффективности препарата — непараметрические тесты (критерий Фридмана, квадратичное отклонение χ2).
Результаты
Демографические характеристики
В общей сложности для исследования отобрали 2058 пациентов с ишемическими атаками. Критериям включения/исключения не соответствовали 14 пациентов, которых не учитывали в статистическом анализе. Причины исключения: возрастные ограничения (2 пациента), расхождение диагноза (2 пациента), неприемлемая доза препарата (1 пациент) и низкие показатели шкалы Мэтью (9 пациентов). Характеристики остальных 2044 пациентов представлены в таблице 2.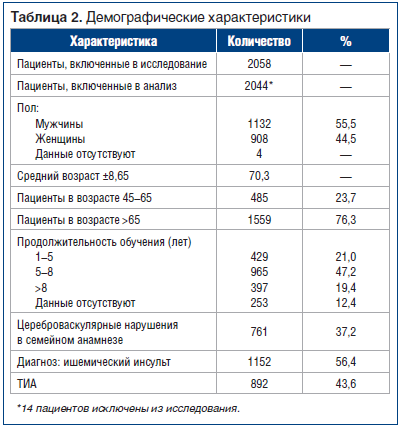
В исследовании приняли участие мужчины и женщины (55,5 и 44,5%соответственно). Средний возраст составил 70,3 года (485 пациентов (23,7%) в возрасте 45–65 лет; 1559 пациентов (76,3%) в возрасте 66–85 лет). Около 50% пациентов имели среднее образование с продолжительностью обучения 5–8 лет, примерно по 20% имели начальное или высшее образование. 1152 пациента (56,4%) перенесли ишемический инсульт и 892 (43,9%) — ТИА. Прекратили участие в исследовании 73 пациента (3,55%), 41 пациент умер (1,99%), нежелательные явления наблюдались у 14 пациентов (0,68%).
Большинство пациентов, включенных в исследование, имели сопутствующие заболевания, как показано в таблице 3. Фактически у 1781 пациента (87,1%) имелись сопутствующие заболевания, связанные в основном с сердечно-сосудистой системой (72,4%) и метаболическими нарушениями (31,5%).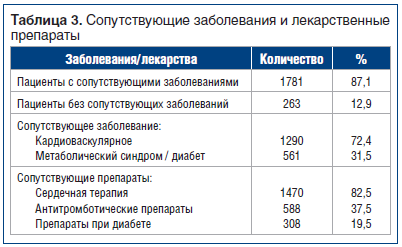
Помимо этого, 78,3% пациентов получали сопутствующую терапию, которая в большинстве случаев (82,5%) была представлена лекарственными препаратами для лечения сердечно-сосудистых заболеваний.
Первая часть исследования (дни 1–28)
Для оценки эффективности препарата α-GPC, который вводили внутримышечно (в/м) в течение первой части исследования (28 дней) в основном в больнице, использовали шкалу Мэтью; данная шкала имеет разметки от 0 (клиническая смерть) до 100 (пациент в совершенном сознании) [16]. В исследование включали пациентов с минимальным баллом 35 по шкале Мэтью, что соответствует уровню сознания, достаточному для проведения психометрических тестов.
Изменения и средние значения оценки по этой шкале на исходном уровне и на 28-й день лечения отражены на рисунке 1 и в таблице 4. Среднее значение по шкале Мэтью увеличилось с 58,7 до 74,6, что соответствует 15,9 пункта (p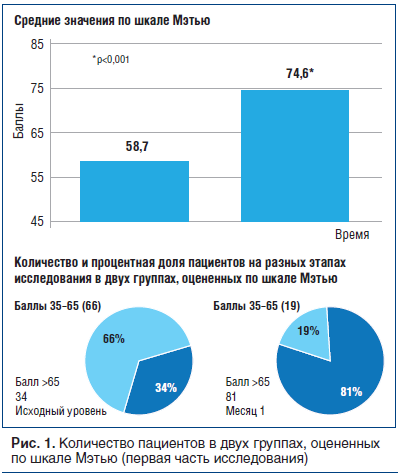
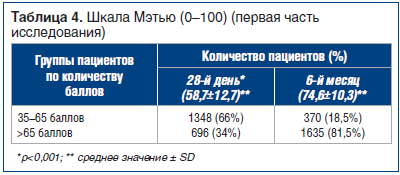
По принципу, использованному ранее в исследованиях Гельмерсом [17, 18], пациентов разделили на две группы: «с большей степенью ухудшения» (35–65 баллов) и «с меньшей степенью ухудшения» (>65 баллов). К концу первого этапа исследования улучшение состояния было отмечено у высокой процентной доли пациентов, которые перешли в категорию «с меньшей степенью ухудшения». Изменения эти были статистически значимыми (р
Вторая часть исследования (дни 29–180)
Для оценки эффективности препарата α-GPC во второй части исследования, в ходе которого пациенты принимали 400 мг перорально 3 р./сут (в основном амбулаторно), использовали Рейтинговую шкалу Кричтона (CRS) и Краткую шкалу оценки психического статуса (MMST). Оценку проводили в день изменения способа приема препарата (28-й день), а также на 3-й и 6-й мес. За «норму» принимали от 1 до 10 баллов по Рейтинговой шкале Кричтона [19], «легкое ухудшение» — 11–20 баллов, «умеренное ухудшение» — 21–30 баллов, «тяжелое ухудшение» — >30 баллов.
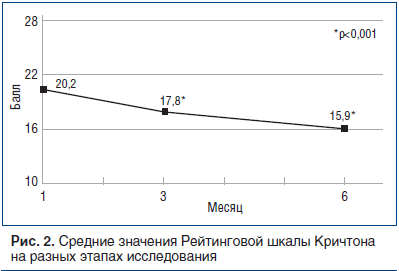
Изменения среднего значения оценки пациентов в период между 28-м днем и последним визитом показаны в таблице 5 и на рисунке 2: значительное снижение (улучшение) — на 4,3 пункта, от 20,2 до 15,9. На рисунке 2 показано количество пациентов с баллом, соответствующим «легкому ухудшению»: их количество растет со временем, увеличиваясь с 72,7% на 3-м мес. до 83,7% на последнем визите (6-й мес.).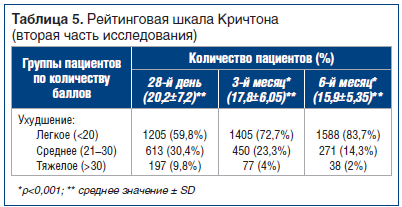
Когнитивные функции оценивали по Краткой шкале оценки психического статуса, где баллы от 0 до 23 обычно рассматривают как «аномальное ухудшение», а балл >23 — как «норму» [20]. Средние значения оценки со временем увеличились, показав повышение на 3-м мес. на 2,2 пункта (p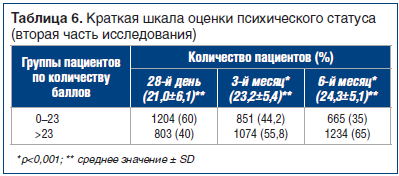
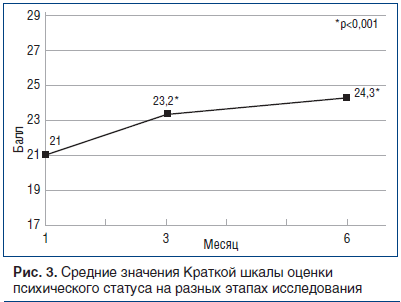
Кроме того, на рисунке 3 показан процент пациентов, у которых оценка изменилась с аномальной на нормальную: оценка повышается со временем — от 40% на 28-й день до 55,8% на 3-м мес. и до 65% на 6-м мес.
Степень глобального ухудшения оценивали с помощью Шкалы глобального ухудшения когнитивных функций (GDS) [21], где значение 0 означает норму, а 7 — тяжелое ухудшение. В таблице 7 и на рисунке 4 показаны тенденции изменения средних значений GDS. Средние значения уменьшились с 2,72 в начале второго этапа исследования до 2,16 в конце испытания; разница между средними баллами была статистически значимой (p
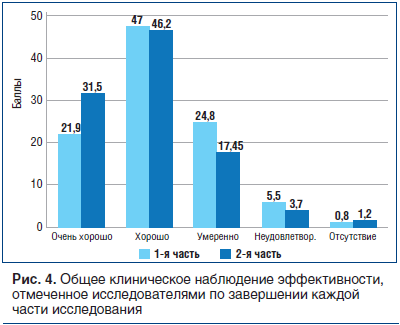
В конце каждой части испытания исследователей просили изложить их субъективные мнения об общей клинической эффективности и переносимости препарата α-GPC. На рисунке 4 представлены в процентном отношении мнения исследователей по завершении каждой части испытания.
68,9% (в первой части исследования) и 77,6% (во второй части) исследователей отметили эффективность как «очень хорошую»/«хорошую»; 24,8% (в первой части) и 17,5% (во второй части) – как «умеренную», а 6,3% (в первой части) и 4,9% (во второй части) — как «неудовлетворительную»/«отсутствие».
Системную переносимость препарата оценивали путем контроля артериального давления, частоты сердечных сокращений и анализа крови (общий анализ крови и исследование функции почек, печени).
Кроме того, пациентов наблюдали на предмет возникновения побочных эффектов, которые регистрировались при каждом контрольном визите. В ходе исследования каких-либо аномальных значений в анализах крови и других исследованиях не наблюдалось.
Выводы
Результаты исследования большей части пациентов с диагнозом острых церебральных ишемических атак подтверждают эффективное действие препарата α-GPC при восстановлении умственных способностей после инсульта.
По завершении первой части исследования (в конце 1-го мес. парентеральной терапии препаратом α-GPC) отмечены очень хорошие результаты как по переносимости, так и по эффективности: по шкале Мэтью зарегистрирован средний балл, эквивалентный менее выраженному ухудшению неврологического состояния (>65), отмечена хорошая переносимость: 34 случая осложнений (1,66%) и 10 случаев выхода пациентов из исследования (0,49%).
В течение следующих 5 мес. пероральной терапии улучшение сохранялось, а дальнейшее улучшение когнитивных функций статистически оценивалось по Краткой шкале оценки психического статуса, поведенческих функций — по Рейтинговой шкале Кричтона и медицинских показаний, связанных со снижением когнитивных функций, — по Шкале глобального ухудшения когнитивных функций.
Отмечена очень хорошая переносимость и во второй части исследования: 17 случаев осложнений (0,33%) и 4 случая выхода пациентов из исследования (0,2%).
Эти данные подтверждают эффективность и терапевтическую роль препарата α-GPC в улучшении когнитивных функций у большей части пациентов с острыми цереброваскулярными атаками (инсульт и/или ТИА): крайне редкие случаи возникновения побочных явлений подтверждают, что прием α-GPC в течение длительного периода после возникновения инсульта является
безопасным.
Реферат подготовлен по материалам статьи:
Barbagallo Sangiorgi G., Barbagallo M., Giordano M. α-Glycerophosphocholine in the mental recovery of cerebral ischemic attacks. An Italian multicenter clinical trial // Ann N Y Acad Sci. 1994. Vol. 30. № 717. P. 253–269.
Информация с rmj.ru




